两种方法对蒙药金诃子低温提取物多糖成分和含量测定结果比较
2014-12-02宣成睿赵小霞赵鹏伟杨丽敏
罗 夏,宣成睿,赵小霞,赵鹏伟,孙 鹏,杨丽敏
(1内蒙古医科大学,呼和浩特010059;2天津市第四中心医院)
现代药理学研究发现,诃子提取物中含有多种糖类,如阿拉伯糖、果糖、葡萄糖等,且这些糖类为其重要活性成分[1~3]。目前,指纹图谱被认为是能够较全面地反映药材提取物质量变化的质控技术,红外光谱因其专属性强、重现性好、操作方便等优势已成为中药研究化学图谱不可缺少的工具,其在中草药及中成药有效成分含量的测定中具有独特作用[4,5]。本研究选定红外光谱技术描绘蒙药金诃子不同部位的指纹图谱,同时通过硫酸—蒽酮比色法测定其5个部位中多糖的成分和含量,比较两种方法在多糖测定中的优缺点。
1 材料与方法
1.1 材料 蒙药金诃子购于内蒙古呼和浩特市中蒙医院;葡萄糖、蒽酮、浓硫酸等试剂购于北京化学试剂二厂。主要仪器:GZX-9070MBE电热恒温鼓风干燥箱、LGJ-18冷冻干燥机、UV-2401PC紫外分光光度计、UV-9200紫外分光光度计、DZG-303A离子纯水机、MK-08隔水式电热恒温培养箱、HHS恒温水浴锅。
1.2 方法
1.2.1 金诃子不同部位提取物的制备 取蒙药金诃子1 000 g,粉碎后为990 g,加入5 000 mL的超纯水,浸泡5 h,放入-25℃的冰箱冷冻,过夜。将冷冻后的金诃子解冻,4 000 r/min离心40 min,去渣,留上清液。上述方法重复两次,将两次获得的上清液混合,用不同的分离方法及透析膜分离技术分离出5个有效部位(1号部位为水提离心上清部位,2号部位为水提离心沉淀部位,3号部位为通过5万分子膜膜内部位,4号部位为醇提水解部位,5号部位为通过5万分子膜膜外部位),将不同部位的提取液冷冻干燥,即得5个部位的提取物干粉。
1.2.2 红外光谱技术检测金诃子提取物中多糖成分和含量 将5个部位的提取物在清华大学分析中心采用红外光谱技术进行成分和含量测定。
1.2.3 硫酸—蒽酮比色法检测金诃子提取物多糖成分和含量 ①硫酸蒽酮溶液的配制:称取蒽酮0.2 mg,加100 mL浓硫酸溶解。②对照品溶液的配制:称取70℃干燥至恒重的无水葡萄糖对照品0.200 3 g,置100 mL容量瓶中,加蒸馏水稀释至刻度,摇匀,然后取其10 mL,置于另一100 mL容量瓶中,加水稀释至刻度,摇匀,即得0.2 mg/mL的对照品溶液。③样品溶液的配制:分别称取金诃子的5个不同部位提取物的干燥样品粉末各100 mg,分别置于5个100 mL的容量瓶中,加蒸馏水稀释至刻度,摇匀。取上述5份溶液各10 mL分别置于100 mL的容量瓶中,分别加蒸馏水稀释至刻度,再次摇匀,得5个金诃子不同部位提取物的0.1 mg/mL的样品稀释液。④测定条件的选择:分别取1 mL葡萄糖标准对照品溶液和金诃子多糖样品溶液于50 mL具塞试管中,加蒸馏水稀释至刻度,再加入8 mL蒽酮溶液,摇匀。浸于冰水浴中冷却后,移至沸水浴中加热10 min,取出后置于冰水浴中10 min,然后倒入比色皿中,用紫外分光光度计分别在450~700 nm范围下进行扫描。⑤标准曲线的制备:取葡萄糖对照品溶液 0.2、0.3、0.4、0.5、0.6、0.8、1.0 mL,分别置于50 mL具塞试管中,各用蒸馏水补至2 mL作为5份供试品溶液。另取一空白具塞试管放入蒸馏水2 mL,与供试品管作以下同步处理,各管分别加入蒽酮试液8 mL,摇匀,浸于冰水浴中冷却,然后移至沸水浴中加热10 min,取出后置于冰水浴中放置10 min,在574 nm的波长处测定吸光度,平行测定3份。以吸光度为横坐标,浓度为纵坐标,绘制标准曲线。⑥精密度试验:取5份对照品1 mL(浓度0.2 mg/mL),按标准曲线的制备方法操作,测定吸光度,计算RSD值。⑦稳定性试验:以1号部位为代表,取样品2 mL(浓度0.1 mg/mL),按样品测定的方法操作,于室温自然光下放置,每20 min测定1次吸光度,共检测8次,观察其稳定性。⑧重复性试验:以1号部位为代表,取样品2 mL(浓度0.1 mg/mL),按样品测定的方法操作,测定吸光度,计算RSD值。⑨加样回收率测定:以1号部位为代表,取样品2 mL(浓度0.1 mg/mL)置于50 mL具塞试管中,按样品测定的方法测定其吸光度,并换算出金诃子多糖含量。再加入0.04 mg无水葡萄糖作对照,再次测定其吸光度,并换算出金诃子多糖含量,平行测定6次,计算加标回收率和RSD值。⑩蒙药金诃子不同提取物多糖含量的测定:取5份样品稀释液各2 mL置于5个50 mL具塞试管中,另取一空白具塞试管放入蒸馏水2 mL,与各样品管作以下同步处理。各管分别加入蒽酮试液8 mL,摇匀,浸于冰水浴中冷却,移至沸水浴中加热10 min,取出后置于冰水浴中放置10 min,以空白管为对照,在574 nm波长处测定各吸光度。每份样品平行测2次。
1.2.4 统计学方法 采用 SPSS10.0统计软件,计量资料以±s表示,比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 5个部位提取物多糖成分和含量比较 1号部位在1 169.89/cm、1 207.53/cm 附近有峰图,2 号部位在1 173.42/cm、1 027.26/cm 附近有峰图,3 号部位在1 166.73/cm、1 025.95/cm 附近有峰图,4 号部位在1 166.01/cm、1 025.72/cm 附近有峰图,5 号部位在1 196.02/cm、1 027.07/cm 附近有峰图,而红外光谱技术图谱中1 170/cm、1 028/cm附近的吸收峰为C-O的伸缩振动,说明样品中含有多糖类物质[6],提示5个部位提取物均含有多糖成分,但不同部位多糖含量比较P>0.05。
2.2 硫酸—蒽酮比色法波长的选择和标准曲线的制备 葡萄糖的紫外线最大吸收波长在580 nm处,而金诃子多糖的紫外线最大吸收波长在570 nm处,两者形状及葡萄糖吸收曲线基本一致,且最大吸收波长相差不大,说明用葡萄糖做标准品是可靠的[7]。故在实验中选择574 nm作为测定波长。其不同浓度葡萄糖570 nm波长下的线性回归方程为Y=0.205 1X-0.003 4,R=0.999 1(Y 代表多糖含量,X代表OD值,R代表判定系数),其标准曲线见图1。其标准曲线表明,每毫升样品中含40~200 μg葡萄糖时与其吸光度呈良好的线性关系。
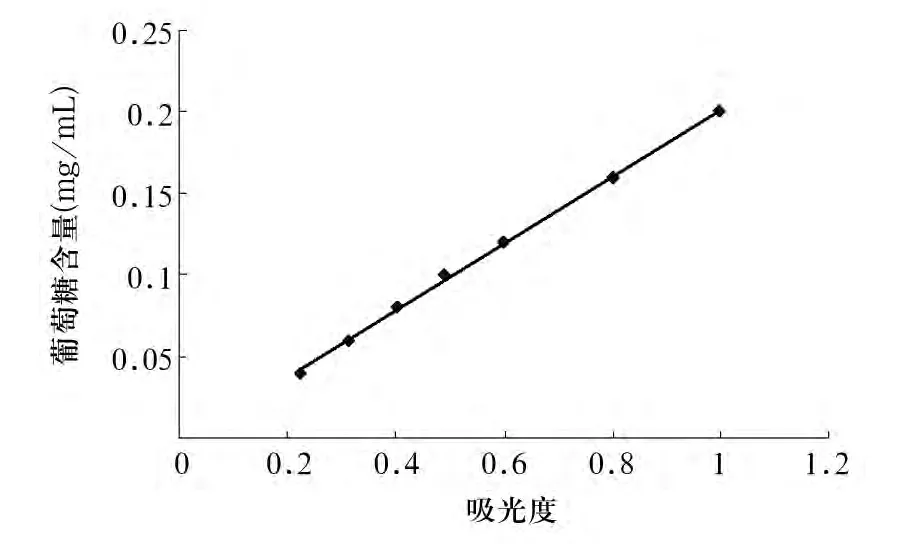
图1 574 nm波长下不同浓度葡萄糖吸光度标准曲线
2.3 硫酸—蒽酮比色法的精密度、稳定性、重复性、加标回收率 精密度:5份对照品RSD为0.460%(n=5);稳定性:以蒙药金诃子1号部位为代表,金诃子多糖含量在2 h内无统计学差异;重复性:以蒙药金诃子1号部位为代表,其RSD=1.616%(n=5);同样以蒙药金诃子1号部位为代表,其加标回收率为(110.13±0.010)%,RSD=0.946%。
2.4 5个部位提取物硫酸—蒽酮比色法多糖含量检测结果比较 1号部位多糖含量为(20.40±0.18)%,2 号部位为(19.45 ±0.20)%,3 号部位为(14.15 ±0.07)%,4 号部位为(22.15 ±0.12)%,5号部位为(17.40±0.05)%。多糖含量最少的3号部位与1号和2号部位比较差异均有统计学意义(P 均 <0.05)。
3 讨论
诃子为君子科植物诃子及其变种绒毛诃子干燥的成熟果实,晒干后入药,其味涩性平,可祛三弊所引起的诸疾,有解毒之功效,被誉为“蒙药之王”[8,9],而金诃子是蒙药诃子当中的最佳品种,其状如葫芦尾,果实中部呈卵形,里面有核,色如葫芦黄而有红色光泽,具有涩肠止泻、利咽、调和药性、解毒等功效。
中药炮制工艺能有效降低或消除药物毒副作用,改变药物的性状、性能或功效,对促进临床用药效果、安全性具有重要作用[9]。目前HPLC指纹图谱技术可以作为诃子工艺筛选过程中的有效评价手段[6],但是HPLC主要采用液相检测的方法,将药材溶于水或醇相进行检测,而红外光谱技术无需对样品预处理,反映药材真实的整体信息,可用于中药的定性和定量测定[7,10]。故本研究采用红外光谱技术和硫酸—蒽酮比色法检测蒙药金诃子中多糖成分和含量的差异,进而对检测方法进行优选。
本研究结果表明,两种方法均检测到了多糖成分。红外光谱技术检测结果表明,5个不同部位提取物在1 170/cm、1 028/cm附近均有吸收峰,此吸收峰为C-O的伸缩振动,说明样品中含有多糖类物质,5个部位之间多糖含量比较差异无统计学意义;而硫酸—蒽酮比色法检测结果显示,多糖含量在5个部位之间有显著性差异。这可能是因为红外光谱技术的定量分析不仅需要利用红外光谱信息,还需要依据标准方法,如药典规定的HPLC方法获得参考值建立模型。由于红外光谱技术测量的样品一般是微量的,而标准方法无法对微量样品进行分析,故目前红外技术很少应用于定量分析;但随着现代分析方法的进步,标准方法测量微量样品的精度将逐步提高,因此红外光谱技术发展的另一个趋势是微量分析[11]。
综上所述,我们认为可选择红外光谱技术对蒙药金河子低温提取物进行成分分析,同时分析其与原药材的成分差异,具体到含量测定可以选择《中国药典》中相应的方法进行检测。
[1]刘芳,秦红飞,刘松青.诃子化学成分与药理活性研究进展[J].中国药房,2012,23(7):670-672.
[2]Pfundstein B,El Desouky SK,Hull WE,et al.Polyphenolic compounds in the fruits of Egyptian medicinal plants(Terminalia bellerica,Terminalia chebula and Terminalia horrida):characterization,quantitation and determination of antioxidant capacities[J].Phytochemistry,2010,71(10):1132-1148.
[3]尹春梅,韩世柳,田成旺,等.诃子HPLC指纹图谱及模式识别研究[J].中草药,2010,41(9):1467-1469.
[4]孙素琴,周群,秦竹.中药二维相关红外光谱鉴定图集[M].北京:化学工业出版社,2003:1-464.
[5]Pei LK,Sun SQ,Guo BL,et al.Fast quality control of Herba Epimedii by using Fourier transform infrared spectroscopy[J].Spectrochim Acta A Mol Biomol Spectrosc,2008,70(2):258-264.
[6]刘雅敏,郭丹丹,杨晋,等.指纹图谱法优选诃子提取工艺的研究[J].中成药,2011,33(7):1168-1171.
[7]王丹,卜海博,李向日.红外光谱技术在中药炮制研究中的应用与展望[J].中国实验方剂学杂志,2011,17(7):269-270.
[8]任晓伟,俞腾飞.蒙药诃子研究进展[J].中国民族医药杂志,1999,5(2):48-49.
[9]陈建南,徐鸿华.诃子的产地和品种考证[J].中药材,1996,19(10):533-535.
[10]郭昊,杜伟锋,曹岗,等.红外光谱技术在中药炮制研究中的应用[J].中成药,2013,35(4):819-822.
[11]张锐,尹利辉,金少鸿.红外光谱成像在药品质量控制中的应用[J].中国药事,2013,27(6):635-638.
