不同剂量沐舒坦对老年慢性阻塞性肺疾病急性加重期痰液中炎性细胞因子的影响
2014-12-02张亚男张伟兵田晓彦赵春雨刘长萍
张亚男,张伟兵,田晓彦,张 慧,赵春雨,李 响,刘长萍
(哈尔滨医科大学附属第四医院,哈尔滨150001)
慢性阻塞性肺疾病(COPD)是一组以气流受限为特征的肺部疾病。COPD急性加重期(AECOPD)是COPD慢性炎症的急性加重,是指在该疾病过程中,短期内出现咳嗽、咳痰、气短和(或)喘息加重,痰量增多,呈脓性或黏液脓性,可伴发热等症状[1]。其发病机制尚不完全清楚。近年研究表明,炎性细胞因子(如 IL-6、IL-8、TNF-α 等)参与 COPD 的进展,且可作为 COPD 急性加重的指标[2,3]。这些细胞因子可引起破坏肺实质的中性粒细胞积聚和脱颗粒以及蛋白水解酶的释放,并互相激活,放大炎性损伤,加重肺实质的破坏[4]。因此,积极控制气道炎症是治疗AECOPD的关键。沐舒坦即盐酸氨溴索,是一种新型的呼吸道祛痰药,不仅具有祛痰、肺保护、抗氧化等作用,还具有抑制炎性细胞因子的作用,且呈剂量依赖性。但目前其治疗老年AECOPD患者的最佳剂量尚未明确。2011年12月~2013年6月,我们观察了3种剂量沐舒坦对老年AECOPD患者痰液中细胞因子(IL-6、IL-8、TNF-α)的影响,旨在寻找其最佳治疗效果的最小剂量。现报告如下。
1 资料与方法
1.1 临床资料 选取同期在我院住院的老年AECOPD患者194例。均符合2011年GOLD的修订版中关于COPD的诊断标准,分期为急性加重期。并排除:①AECOPD合并呼吸衰竭需使用呼吸机者;②急性上呼吸道感染或支气管哮喘、肺肿瘤、甲亢、自身免疫性疾病及其他可导致气流受限的支气管肺疾病者;③有严重心脑血管、肾、肝、血液等疾病者;④近期曾应用与本实验相关的药物者;⑤年龄<65岁。随机将患者分成A、B、C、D组。其中,A组46例,男33例、女13例,年龄 65~92(77.20±8.27)岁,病程20~40(30.12±3.62)年;B 组50例,男30例、女20 例,年龄65~90(76.60 ±9.68)岁,病程20~43(29.30±3.44)年;C 组 48例,男 40例、女 8例,年龄 66~89(77.36±9.13)岁,病程 22~39(29.69±4.53)年;D 组50例,男35例、女15例,年龄67~89(76.95±8.09)岁,病程21~38(28.27±2.64)年。各组临床资料具有可比性。
1.2 方法
1.2.1 治疗方法 所有患者入院后给予抗感染、止咳、平喘、解痉、免疫调节等常规治疗。A、B、C组分别给予沐舒坦30、90、330 mg/次,用氯化钠注射液100 mL或葡萄糖注射液100 mL稀释,每日3次,连续静脉输注7 d;D组给予若通4 mg/次,每日3次,连续静脉输注7 d。
1.2.2 IL-6、IL-8、TNF-α 检测 所有患者入院第1、4、7 天行痰诱导和处理。参照 Pinto-Plata 等[5,6]的方案,诱导痰前10 min让所有患者用清水漱口,吸入200 μg沙丁胺醇。15 min后,雾化吸入5 min 3%的氯化钠注射液。在患者留取深咳痰之前,嘱患者用双氧水漱口,清干鼻涕后,深咳痰液,此后每3 min深咳1次,最多不超过10 min,收集的痰液不少于1 mL且不含有唾液。即刻取1 mL或0.5 mL无唾液成分的痰液放入离心管中,加磷酸盐缓冲液3~5倍稀释,用力振荡2~3 min,再涡旋振荡1~2 min,使其均匀,4℃ 3 500 r/min离心20~30 min,留取上清液于-70℃冻存待测。另取1 mL或0.5 mL痰液,用含1%二硫苏糖醇的2 mL罕氏平衡盐溶液(HBSS)溶解,在室温下轻轻振荡均匀,再用HBSS稀释,轻轻振荡后,1 000 r/min离心10 min。取上清液保存在-80℃的环境中,同时沉淀物用作细胞学分析。合格细胞的标准为上皮细胞<20%,细胞存活率>40%。用HBSS冲洗细胞沉淀物成细胞悬液,倍比稀释后在细胞计数器上行总细胞计数,再留取少量细胞悬液制涂片,吉姆萨染色,行细胞分类检查。采用芬兰生产MK3多功能酶联免疫检测仪、ELISA法检测上清液中 IL-6、IL-8、TNF-α水平,使用武汉贝茵莱生物科技有限公司所提供的试剂盒。
1.2.3 统计学方法 采用 SPSS19.0统计软件,计量资料以±s表示,结果比较采用方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组不同时间痰液中 IL-6、IL-8、TNF-α 水平比较 见表1。
表1 各组不同时间痰液中IL-6、IL-8、TNF-α水平比较(ng/L,±s)
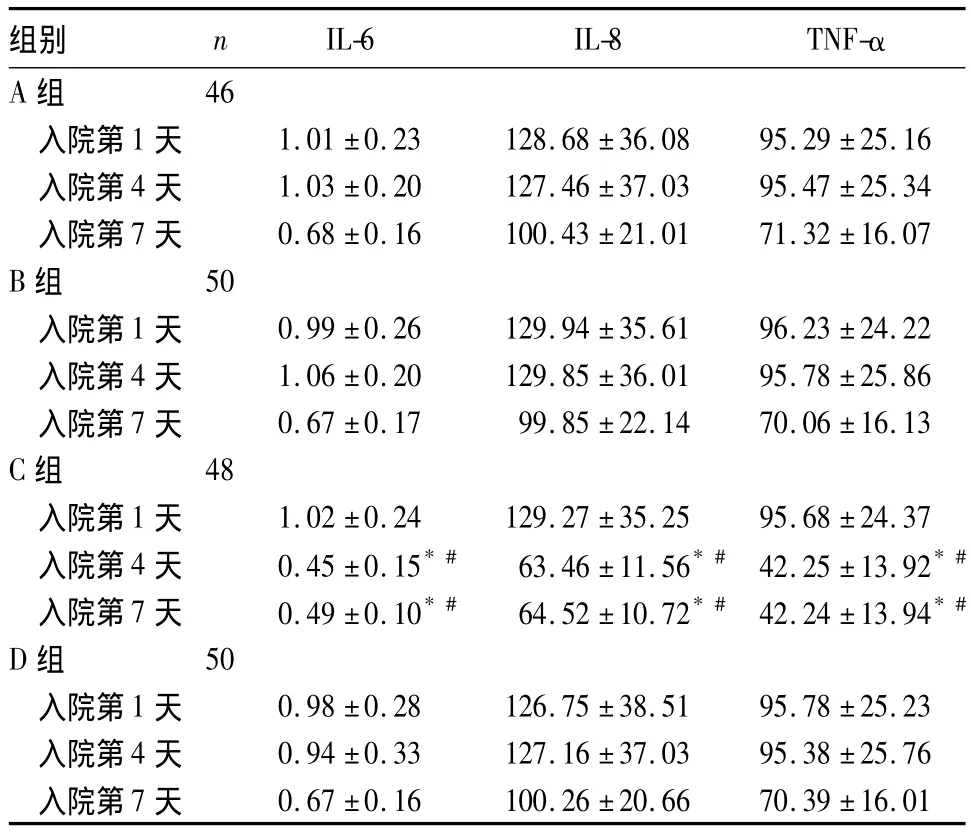
表1 各组不同时间痰液中IL-6、IL-8、TNF-α水平比较(ng/L,±s)
注:与同组入院第1天比较,*P<0.05;与 A、B、D组同期比较,#P <0.05
组别 n IL-6 IL-8 TNF-α A组0.67 ±0.16 100.26 ±20.66 70.39 ±16.01 46入院第1 天 1.01 ±0.23 128.68 ±36.08 95.29 ±25.16入院第4 天 1.03 ±0.20 127.46 ±37.03 95.47 ±25.34入院第7 天 0.68 ±0.16 100.43 ±21.01 71.32 ±16.07 B组 50入院第1 天 0.99 ±0.26 129.94 ±35.61 96.23 ±24.22入院第4 天 1.06 ±0.20 129.85 ±36.01 95.78 ±25.86入院第7 天 0.67 ±0.17 99.85 ±22.14 70.06 ±16.13 C组 48入院第1 天 1.02 ±0.24 129.27 ±35.25 95.68 ±24.37入院第4 天 0.45 ±0.15*# 63.46 ±11.56*# 42.25 ±13.92*#入院第7 天 0.49 ±0.10*# 64.52 ±10.72*# 42.24 ±13.94*#D组 50入院第1 天 0.98 ±0.28 126.75 ±38.51 95.78 ±25.23入院第4 天 0.94 ±0.33 127.16 ±37.03 95.38 ±25.76入院第7天
2.2 各组不良反应情况 四组均未出现明显不良反应。
3 讨论
COPD是一种慢性呼吸系统疾病,由于其缓慢进行性发展,可严重影响患者的劳动能力和生活质量,目前已成为世界上第五位死亡原因,且其病死率仍在上升[2]。AECOPD是COPD慢性炎症急性加重期,患者在短期内咳嗽、气短或喘息加重,痰量增多,呈脓性或黏液脓性,可伴发热等症状;亦可出现全身不适、失眠、嗜睡、疲乏、抑郁和精神紊乱等症状。当患者出现运动耐力下降、发热和(或)胸部影像异常时,可能为COPD加重的征兆。而老年AECOPD患者因机体抵抗力降低,病情反复发作,气道分泌物进一步增多,且纤毛运动功能差,痰液积聚不易咳出,极易并发细菌定植和生长。故患者机体可存在明显的全身炎症反应。Celli等[7]研究表明,参与全身炎症反应的重要细胞因子(如IL-6)与COPD患者肺功能的下降密切相关,可用来预测COPD的严重程度。Agustí等[8]的研究也得出相同结论。此外,IL-8 和TNF-α也是反映气道炎症水平的敏感性指标。IL-8能通过趋化中性粒细胞等炎性细胞,并与中性粒细胞、T细胞、单核细胞等靶细胞上的特异受体结合,通过激活Fas/FasL系统及核转录因子NF-κB,从而释放更多的炎性因子,能够加重气道局部炎症[9]。TNF-α具有多种前炎性介质的功能,促进炎性细胞趋化和活化,刺激IL-8的产生,激发炎症连锁反应。在这些刺激因素作用下,巨噬细胞分泌TNF-α增加,进而破坏气道结构,诱发气道炎症。另外,TNF-α诱导细胞间黏附分子(ICAM-1)的合成及白细胞表面黏附分子VIA-4、MAC-4表达上调,上述产生的黏附分子与内皮细胞上相应的黏附分子相互作用,与白细胞快速黏附,到达炎症部位参与炎性反应[10]。因此,降低IL-6、IL-8、TNF-α 在 AECOPD 患者气道的表达,可降低气道炎症及其对肺部的损伤。
沐舒坦即盐酸氨溴索,是一种新型的黏液溶解剂。有研究发现,沐舒坦具有抑制小鼠肺部炎性细胞因子的作用[11]。其治疗呼吸系统疾病的主要机制[12,13]如下:①刺激肺泡Ⅱ型细胞合成,促进肺泡表面活性物质生成,使气道黏膜分泌功能恢复正常、降低分泌物的浆液/黏液比值,减少气道壁上的黏痰,起到化痰作用并有利于痰液的排出,促进炎症的吸收;②在机体内达到一定的血药浓度后,与抗生素联合具有协同作用,提高抗生素在支气管分泌物中的浓度,减少抗生素的作用时间及剂量;③促进再生的纤毛上皮合成及其功能的恢复,加速纤毛运动,且与肺组织亲和力高,有效防止外界有害因素对气道的损伤;④增强肺组织自身氧化防御作用,控制炎性介质及超氧化物的释放,进而减轻肺损伤。
本研究结果显示,A、B、D组入院第4天痰液中IL-6、IL-8、TNF-α水平较入院第1天无明显改善,入院第7天较入院第1、4天均有所下降,考虑与应用沐舒坦的同时联用抗生素、解痉、化痰、调节免疫等治疗使气道炎症减轻有关;C组入院第4天痰液中IL-6、IL-8、TNF-α水平较入院第1天明显下降,且低于其他三组第7天检测结果,考虑为大剂量沐舒坦产生抗炎作用,协同抗生素加强抗炎,使气道炎性细胞因子迅速下降;入院第4天较入院第7天无明显变化,可能为COPD患者长期伴有气道慢性炎症、肺功能欠佳,且老年患者机体反应能力弱,咳嗽、排痰能力受限,气道炎症消退慢,气道炎症在迅速减轻后保持低炎症状态。故对老年AECOPD患者选择短期大剂量沐舒坦(990 mg/d)是安全且有效的,在达到一定血药浓度后,能明显抑制气道炎性细胞因子水平。
综上所述,短期大剂量应用沐舒坦能显著降低老年AECOPD患者痰液中 IL-6、IL-8、TNF-α水平,起到良好的抗炎作用,且呈现剂量依赖性。
[1]古立新,李长文,陈振华.中医药治疗慢性阻塞性肺疾病急性加重期的研究进展[J].广西中医药大学学报,2013,16(3):67-69.
[2]Rincon M,Irvin CG.Role of IL-6 in asthma and other inflammatory pulmonany diseases[J].Int J Biol Sci,2012,8(9):1281-1290.
[3]胡蓉.COPD 患者治疗前后血清 hs-CRP、TNF-α、IL-6、IL-8 检测的临床意义[J].放射免疫学杂志,2007,20(6):503-503.
[4]刘笑春,张雅军,马超楠,等.沙美特罗—丙酸氟替卡松对慢性阻塞性肺疾病稳定期的治疗[J].河南大学学报(医学版),2013,32(3):223-228.
[5]Pinto-Plata VM,Livnat G,Girish M,et al.Systemic cytokiness,clinical and physiological changes in patients hospitalized for xacerbation of COPD[J].Chest,2007,131(1):37-43.
[6]Feng E,Wan R,Yang S,et al.Expression levels of induced sputum IL-8 and IL-10 and drug intervention effects in patients with acute exacerbated COPD complicated with chronic cor pulmonate at high altitude[J].Exp Ther med,2013,6(3):747-752.
[7]Celli BR,Locantore N,Yates J,et al.Inflammatory biomarkers improve clinical prediction of mortality in chronic obstructive pulmonary disease[J].Am J Respir Crit Care med,2012,185(10):1065-1072.
[8]Agustí A,Edwards LD,Rennard SI,et al.Persistent systemic inflammation is associated with poor clinical outcomes in COPD:a novel phenotype[J].PloS One,2012,7(5):e37483.
[9]Kodama T,Matsuyama T,Kuribayashi K,et al.IL-8 deficiency selectively enhances allergen-induced eosinoPhilia in mice[J].J Allergy Clin lmmunol,2000,105(1 Pt 1):45-53.
[10]彭峰,杨印楼,张宏华.黄芪注射液对慢性阻塞性肺疾病患者痰液 IL-8及 TNF-α 水平的影响[J].广东医学院学报,2013,31(3):274-275.
[11]Jang YY,Song JH,Shin YK,et al.Depressant effects of ambroxol and erdosteine on cytokine synthesis,granule enzyme release,and flee radical production in rat alveolar macrophages activated by lipopolysaccharide[J].Pharmacol Toxicol,2003,92(4):173-179.
[12]陆权,张灵恩,王莹,等.沐舒坦R糖浆临床疗效随机对照研究[J].临床儿科杂志,2003,21(1):50-52.
[13]朱科明,李申,杨波,等.沐舒坦对呼吸系统的保护机制[J].国外医学:麻醉学与复苏分册,2001,22(1):49-51.
