不同动脉压力感受器对钌红反应的敏感性差异
2014-12-02赵海燕黄海霞张思韬钮伟真
赵海燕 黄海霞 刘 萍 张思韬 钮伟真 王 伟*
(1.首都医科大学燕京医学院机能教研室,北京100069;2.首都医科大学基础医学院生理学与病理生理学系,北京100069)
动脉压力感受性反射是机体维持血压稳定的重要调节机制之一,该反射的感受器是分布于颈动脉窦和主动脉弓的神经末梢,其主要作用是将血压变化对血管壁的机械牵张刺激转变为向中枢传导的神经冲动——即机械-电转导作用。早有文献[1-2]报道,窦神经和主动脉神经由A类和C类2种神经纤维组成。1969年,Fidone等[2]通过测量猫窦神经压力感受纤维的兴奋传导速度,从功能上证明A类和C类纤维均参与压力信息的传递。1977年,Thoren等[3]比较了家兔窦神经2种神经纤维的压力-反应关系(pressure-discharge relationship)的特点,发现2类纤维在阈压(pressure threshold Pth)、阈压时的放电频率(threshold frequency Fth)、最高放电频率、压力敏感性等方面均存在差异。这种差异陆续在不同动物、不同条件下以及不同感受部位(颈动脉窦或主动脉弓)得以证实[4-9]。压力感受器A类和C类纤维的这种差异提示压力感受器机电换能机制可能存在一定差异,其差异的分子基础值得探讨。普遍认为压力感受器由机械敏感离子通道介导[10]。然而,由于动脉压力感受器结构细微和缺乏特异性机械敏感通道阻断剂,使得动脉压力感受器机电换能过程的分子机制难于确定。有报道[11-16]认为退行性蛋白/上皮钠通道/酸敏感通道(degenerin/epithelial sodium channels/acid-sensing ion channels DEG,ENaC,ASICs)和瞬时感受器电位通道(transient receptor potential,TRPs)两大超家族中的某些成员可能参与动脉压力感受器的机电换能过程。为进一步研究动脉压力感受器的机电换能机制,本研究组曾研究多种相关工具药(Gd3+、氨基甙类抗生素、阿米洛利、钌红等)对动脉压力感受器机电换能过程的阻断作用[17-18]。TRP 通道家族中 TRPV1、TRPV4、TRPA1、TRPC1、TRPC3、TRPC6等多个成员被认为具有机械敏感性[10-11],可被钌红阻断[11]。本研究组[10]曾发现 100 μmol/L 钌红能完全阻断窦神经放电,但冲洗后不能恢复。本研究进一步发现,不同的窦神经纤维对钌红(20 μmol/L)的反应存在差异,可区分为钌红敏感和钌红不敏感纤维。深入分析还发现这2类纤维的电生理特点分别与C类和A类压力感受器相对应。
1 材料和方法
1.1 颈动脉窦-窦神经标本的制备
采用SPF级成年大耳白家兔(体质量2 kg左右),雌雄不拘,由首都医科大学实验动物部提供,实验动物许可证号:SCXK(京)2013-0004。在20%(质量分数)氨基甲酸乙酯(5 mL/kg)静脉麻醉下,于动物颈部正中切口,游离一侧颈动脉窦区。制备以颈内外动脉分支点为中心,包括颈总动脉(7 mm)、颈内动脉(5 mm,远端结扎)、颈外动脉(5 mm)和窦神经(7 mm)的组织,简称颈动脉窦-窦神经(carotid sinus-carotid sinus nerve,CS-CSN)标本。
1.2 标本灌流和颈动脉窦内压力的控制
在实验中采用自制的离体标本灌流-放电记录装置,同时从血管内外2条途径对标本进行灌流。血管内外的灌流液相同,温度控制在37℃。实验中持续用100%O2平衡灌流液,目的在于维持灌流液处于高O2分压和零CO2分压状态,以便充分抑制来自颈动脉体化学感受器的放电[8-9]。在研究[12]中通过计算机控制颈动脉窦内压力,计算机输出压力指令程序化控制压力调节阀(PRE-U,Hoerbiger,德国),该阀门进而控制高压纯氧(0.5 MPa)瓶的流量并输出预定气压。此压力用于推动储液瓶中的灌流液进入颈动脉窦内,同时控制窦内压。窦内灌流速度为5 mL/min。窦内灌流液出口处安置压力换能器(YH-4,北京航天医学工程研究所,中国),用于记录窦内压。颈动脉窦窦外灌流速度为1 mL/min。
1.3 压力感受器放电的记录
首先记录窦神经干放电,然后在体视显微镜下,用游丝镊将窦神经干分成神经纤维细束,以单极记录法引导含少量窦神经纤维的放电[19]。本研究将含有2~5个单位的混合放电称为少纤维放电(few-fiber discharge)[19]。所有记录的放电均显示压力依赖性。神经放电信号经前级(A1 402,Axon instrument,美国)、后级(CyberAmp380,Axon instrument,美国)放大和滤波,电压总增益为5 000倍,频带300 Hz~10 kHz。放大后的放电信号和窦内压信号由数据采集系统(Digidata 1440,pClamp 10.0,Axon instrument,美国)采集(采样率为20 kHz)。
1.4 窦神经单位放电信息的提取与处理
对颈动脉窦先后施加脉动式(100次/min,周期0.6 s,压力80 ~ 120 mmHg,1 mmHg=0.133 kPa)和斜坡式(0 ~200 mmHg,20 mmHg/s)的压力刺激,同时记录不同刺激波条件下窦神经的少纤维放电。在离线条件下,应用Spike2软件(Cambridge Electronic Design Limited,英国)将少纤维放电分类为若干个单纤维的放电[13]。对于每一单位放电,先计算脉动式刺激条件的平均放电频率。在斜坡式压力刺激下,确定每一纤维开始放电的初始压力,即压力阈值(pressure threshold,Pth)[7-9]。然后拟合斜波压力刺激下的时间-放电频率曲线[5,8]。对于后者以指数方程Y=Fsat×[1-exp(-x/τ)]拟合[5]。方程中 Y 是神经纤维放电的频率,Fsat为饱和放电频率(saturation frequency)或最大放电频率,τ为时间常数,x为时间。
1.5 灌流液成分与药物的应用
普通灌流液(mmol/L):NaCl 140,KCl 6,MgSO41.2,Glucose 5.5,CaCl21.1 和Hepes 10。钌红 (ruthenium red,RR;Sigma公司,美国)灌流液以普通灌流液配制,终浓度20 μmol/L。以上灌流液均以Hepes-NaOH调节,pH值在37℃时为7.38~7.42。
1.6 统计学方法
数据采用Prism 4.0统计学软件进行处理,数据都以均数±标准差(±s)表达,采用重复测量数据方差分析法进行比较,继之行t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 钌红对窦神经放电的抑制作用
以普通灌流液灌流标本,在脉动式窦内压(intrasinusal pressure,ISP)条件下,窦神经神经干特征性地呈簇状放电,放电频率的时间序列直方图显示放电频率与窦内压显著相关(图1)。用含20 μmol/L钌红的灌流液对标本灌流30 min后,窦神经放电活动被部分阻断(图1b),以普通灌流液冲洗30 min后放电可基本恢复。灌流20 μmol/L钌红30 min,平均使窦神经放电下降至对照组的(67±2)%(P<0.01,n=5)。
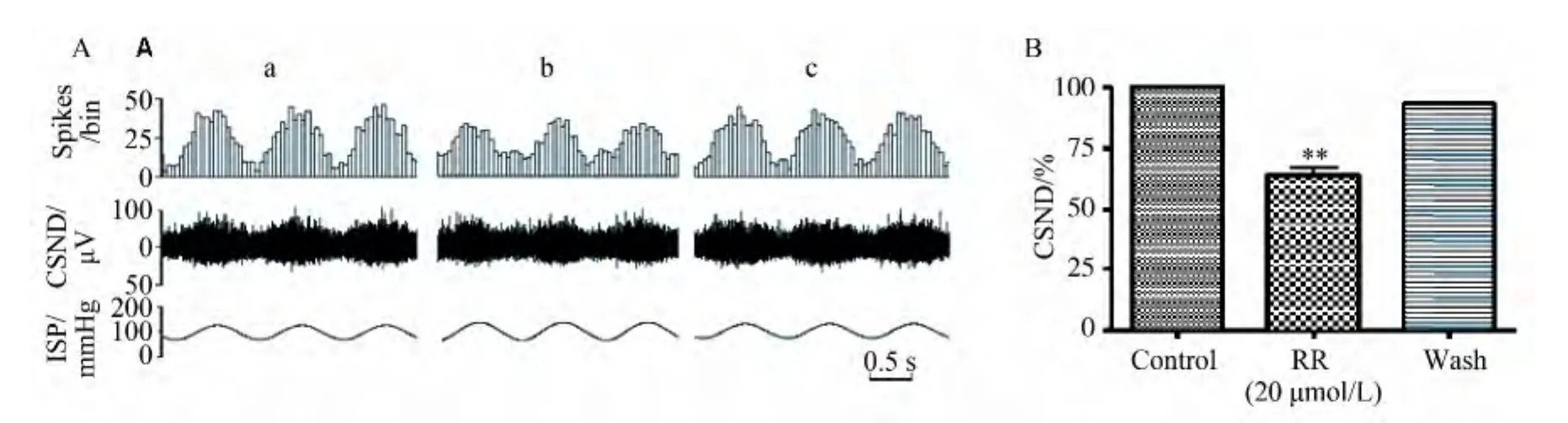
图1 钌红对颈动脉窦压力感受器放电的影响Fig.1 Effects of ruthenium red(RR)on the discharge of carotid baroreceptors
2.2 压力感受纤维放电对钌红反应的差异
1例脉动性压力刺激下窦神经少纤维放电,应用Spike2软件进行聚类分析,分解出3根单纤维的放电(图2A①~③)。所有纤维放电活动均显示明确的压力依赖性,表明所有单纤维均属于压力感受性纤维。实验中从6只家兔的窦神经中各记录到1例少纤维放电。经Spike2软件聚类分析,确认其中有1根细束含有2根单纤维,另一细束含4根单纤维、另外4根细束各含3个单纤维,共计18根单纤维。在20 μmol/L钌红作用下,每个标本中均有1根纤维的放电被明显抑制(如图2A③b),平均放电频率由(8.33±3.50)次/压力周期下降至(3.5±1.75)次/压力周期 (n=6,P <0.05,图2B),洗脱后恢复至(7.5±3.15)次/压力周期。这些被钌红明显抑制的纤维称为钌红敏感纤维。在图2A中,单位①和②对钌红不敏感。在12根纤维,在应用钌红前、后及洗脱后的平均放电频率分别为(16.50±3.75)、(16.01±3.86)和(16.25±3.41)次/压力周期(n=12,P>0.05,图2C),表明这些纤维对钌红不敏感。
2.3 钌红敏感和不敏感纤维的功能差异
图3和图2记录于同一窦神经细束,在斜坡压力周期的间歇期(压力为零)以及压力处于较低水平时,记录不到任何放电,放电仅在出现在窦内压力超过一定水平后,这些特征进一步证明所记录的放电内不包含化学感受纤维放电成分,而完全属于压力感受纤维的放电。应用Spike2软件对斜坡压力下的放电进行分类,得到与图2同样的3个单位放电,每个单位依次在不同压力水平开始放电,表明每根纤维具有各自的压力阈值(Pth)。随着压力升高,3根纤维分别在83.32、90.18 和101.09 mmHg(1 mmHg=0.133 kPa)下开始放电,其中单位③的压力阈值最高。在应用钌红的实验中,单位③已被确定为钌红敏感纤维;而单位①和②属于钌红不敏感纤维(图2)。测量所有钌红敏感纤维的压力阈值(Pth),结果为(95.61±7.13)mmHg(n=6),而不敏感纤维的压力阈值为85.64±6.63 mmHg(n=12),差异具有统计学意义(P=0.009)。同时,钌红敏感纤维的最大放电频率(35.28±1.82 Hz,n=6)低于钌红不敏感纤维[(50.52±1.47)Hz,n=12],两者比较差异有统计学意义(P=0.0081)。此外,本研究还比较了2种纤维在脉动性压力周期内的平均放电。应用指数方程拟合神经纤维的压力-放电频率曲线[7-9],通过拟合曲线获得了纤维放电的半激活压力(P50),比较后发现,钌红敏感纤维的P50为(131.3±3.28)mmHg(n=6),而钌红不敏感纤维的 P50为(118.5±3.66)mmHg(n=12,P=0.045),差异具有统计学意义。感受器的压力敏感性可以用拟合曲线的时间常数(τ)来表示,时间常数越大表示压力敏感性越低。钌红敏感纤维的τ为(0.85±0.070)s(n=6);钌红不敏感纤维的τ为(0.69±0.089)s(n=12,P=0.748),差异不具有统计学意义。钌红敏感和不敏感纤维在电生理特征性方面的差异汇总于表1。

图2 不同窦神经纤维对钌红反应的差异Fig.2 Effects of ruthenium red(RR)on discharges of different baroreceptor fibers
3 讨论
本室前期的研究[13]成果以及本实验表明,应用Spike2软件对窦神经少纤维放电(纤维数<5)进行聚类分析可获得分类相当可靠的单纤维放电数据。这种分类方法不但使获得单纤维放电信息变得相对容易,同时提供一种可能,即可在同样实验条件下对不同单纤维(如A类和C类纤维)的特点进行观察,然后再施加完全相同的干预,这样就使所获得的各种数据(如有关钌红作用的结果)更具可比性,分析也更为可靠。

图3 不同窦神经纤维压力阈值的差异Fig.3 Pressure threshold(Pth)of different fibres discharge of sinus nerve

表1 钌红敏感纤维与非敏感纤维在“压力-放电”关系中的一些特征性参数的差异Tab.1 Different pressure-discharge relationship characteristics of RR sensitive fiber and RR insensitive fiber
研究[2]早已证明,窦神经和主动脉神经中的压力感受性纤维包括A类和C类两种。有髓鞘的A类神经纤维直径较粗且传导速度快,而直径较细的无髓鞘C类神经纤维传导速度较慢[2-5]。自1977年以来,不同研究[3-9]从功能上比较了两种神经纤维的压力-放电关系(pressure-discharge relationship),发现两类纤维在阈压、最大放电频率等方面均存在差异。Coleridge等[9]报道,在狗颈动脉窦压力感受器,A类和C类纤维的压力阈值分别为(54.6±2.9)和(105.8±1.8)mmHg,而最大放电频率分别为(84.3±4.5)和(24.5 ±1.2)Hz。然而,对于同样动物,Seagard 等[5]曾报道,颈动脉窦压力感受器单纤维表现为两种放电模式,一些纤维仅在压力上升至某一水平后才开始放电(被称为type 1),而另一些在低压力下呈低频率放电,只有当压力上升至一定程度,放电频率才显著升高(称为Type 2)。值得注意Seagard的2类放电都可能来自A类和C类纤维,其第一类放电中A类和C类纤维的阈值分别为(71.4±5.0)和(80.4±13.3)mmHg,最大放电频率分别为(49.7±2.7)和(32.7±4.6)Hz,而在第二类放电中A类和C类纤维的阈值分别为(57.1±10.1)和(63.6±4.6)mmHg,最大放电频率分别为(17.3±3.0)和(20.5±3.0)Hz。对于家兔,Yao等[8]曾报道,颈动脉窦压力感受器C类纤维的放电频率低于A类纤维、C类纤维的压力阈值为(92±3)mmHg,A纤维的阈值较C类纤维大约低30 mmHg。此后,Thoren等[3]再次报道,家兔压力感受器A类和C类纤维的压力阈值分别为(53±2)和(95±3)mmHg,最大放电频率分别为(65±5.8)和(22.7±2.3)Hz。除了Seagard的第2类放电模式的最大放电频率外,上述研究的共同特点是A类纤维比C类纤维的阈值低而放电频率高。本研究发现,相对于钌红敏感纤维,钌红不敏感纤维阈值低(85.64±6.63 vs 95.61±7.13 mmHg)且最大放电频率高(50.52±1.74 vs 5.28±1.82 Hz)。这一结果提示钌红不敏感纤维和敏感纤维可能分属于A类和C类神经纤维。
钌红可阻断TRP家族中TRPC、TRPA、TRPV亚家族中多个可能具有机械敏感性的通道成员[11,13],因此成为研究动脉压力感受器的机电换能机制过程中的重要工具药物。单细胞实验条件下,钌红阻断TRP通道的有效浓度在 100 nmol/L~20 μmol/L之间[11,13]。本室前期研究发现,高浓度钌红(100 μmol/L)能完全阻断窦神经放电[17-20],本研究在组织水平实验发现,窦神经不同压力感受纤维在同时面对20 μmol/L钌红作用时,呈现不同的反应——一些窦神经纤维的活动被钌红抑制,而另外一些窦神经纤维则不受影响。结合钌红不敏感和敏感纤维分别与A类和C类神经纤维的对应特点,作者认为这2类压力感受器的机-电换能机制可能存在某些差异。TRP通道家族和退行性蛋白/上皮钠通道/酸敏感通道家族的某些成员可能参与动脉压力感受器的机械-电转导过程[11-16],由于缺乏研究通道的特异性工具药,目前还很难确定其机械-电转导的分子机制。钌红主要用于TRP家族通道的研究,虽然属于非特异性通道的阻断剂,但是钌红敏感和不敏感纤维的存在可能有助于推测动脉压力感受器不同纤维机械电-转导分子的通道家族属性。寻找特异性通道阻断剂,综合研究动脉压力感受器A类和C类纤维的各种药理学差异,将有助于阐明其转导分子的本质。
[1] Douglas W W,Ritchie J M,Schaumann W.Depressor reflexes from medullated and nonmedullated fibres in the rabbit's aortic nerve[J].Physiol:Lond,1956,132(2):187-198.
[2] Fidone S J,Sato A.A study of chemoreceptor and baroreceptor A and C-fibres in the cat carotid nerve[J].Physiol,1969,205(3):527-548.
[3] Thoren P,Saum W R,Brown A M.Mechanisms for activation of aortic baroreceptor C-fibres in rabbits and rats[J].Acta Physiol Scand,1999,166(3):167-174.
[4] Jennifer E,Angell-JAMES.Characteristics of single aortic and right subclavian baroreceptor fiber activity[J].Circ Res,1973,32(2):149-161.
[5] Seagard J L,van Brederode J F M,Dean C,et al.Firing characteristics of single-fiber carotid sinus baroreceptors[J].Circ Res,1990,66(34):1499-1509.
[6] Schild J H,Kunze D L.Differential distribution of voltage-gated channels in myelinated and unmyelinated baroreceptor afferents[J].Auton Neurosci,2012,172(1-2):4-12.
[7] Santa C,Chavez G C,Li B Y,et al.An afferent explanation for sexual dimorphism in the aortic baroreflex of rat[J].Physiol Heart Circ Physiol,2008,295(4):13-16.
[8] Yao T,Thoren P.Characteristics of brachiocephalic and carotid sinus baroreceptors with non-medullated afferents in rabbit[J].Acta Physiol Scand,1983,117(1):1-8.
[9] Coleridge H M,Coleridge J C G,Schultz H D.Characteristics of C fiber baroreceptors in the carotid sinus of dogs[J].J Physiol,1987,394:291-313.
[10]Goodman M B,Lumpkin E A,Ricci A,et al.Molecules and mechanisms of mechanotransduction[J].Neurosci,2004,24(42):9220-9222.
[11]Bernd N,Veit M,Flockerzi.Mammalian transient receptor potential(TRP)cation channels[J].Handb Exp Pharmacol,2014,223(1-2):729-1239.
[12] Chanet S,Martin A C.Mechanical force sensing in tissues[J].Prog Mol Biol Transl Sci,2014,126:317-52.
[13] Plant T D.TRPs in Mechanosensing and volume regulation[J].Handb Exp Pharmacol,2014,223:743-766.
[14] McCleskey E W.A molecular sensor for the baroreceptorreflex?[J].Neuron,2009,64(2):776-777.
[15] Ben-Shahar Y.Sensory functions for degenerin/epithelial sodium channels(DEG/ENaC)[J].Adv Genet,2011,76(4):1-26.
[16] Ichikawa H T,Sugimoto.The co-expression of VR1 and VRL-1 in the rat vagal sensory ganglia[J].Brain Res,2003,980(2):293-296.
[17]刘廷会,魏华,赵海燕,等.苄阿米洛利和钌红对颈动脉窦压力感受器放电的阻断作用[J].首都医科大学学报,2011,32(2):218-223.
[18]刘东霞,钮伟真,沈靖.氨基甙类抗生素对家兔离体颈动脉窦压力感受器放电的抑制作用[J].生理学报,2001,53(5):158-162.
[19]赵海燕,魏华,刘萍,等.窦神经压力感受器聚类分析[J].首都医科大学学报,2009,30(5):658-661.
[20]刘萍,赵海燕,王伟,等.颈动脉窦内压力控制方法的改进[J].首都医科大学学报,2013,34(6):900-903.
