干扰素γ介导噬血细胞综合征血细胞减少的机制研究
2014-12-02王旖旎
汤 然 王旖旎 张 嘉 李 硕 王 昭
(首都医科大学附属北京友谊医院血液内科,北京100050)
噬血细胞综合征(hemophagocytic syndromes,HPS),是一组因遗传性或获得性免疫功能异常导致的以过度炎性反应为基本特征的临床综合征。主要由淋巴细胞、单核细胞和吞噬细胞系统异常激活、增生,分泌大量炎性细胞因子,引起的一系列炎性反应[1]。在HPS的各种临床特点中,发热及血细胞减少最为常见。在介导血细胞减少的机制中,炎性反应因子,尤其是γ-干扰素(interferon-γ,IFN-γ)可能是影响骨髓造血的重要因素。因此,有必要深入了解IFN-γ对骨髓的影响情况及集落刺激因子对抗因IFN-γ使骨髓出现的抑制作用情况。为进一步提高对该病的认识,选择及时有效的治疗方案及改善疾病预后提供临床依据。
1 材料和方法
1.1 材料
1)标本来源:患者骨髓取自16例经临床及实验室检查确诊的HPS患者;正常对照组骨髓取自11例移植供者。上述两组取样前均未系统使用过免疫抑制剂、维甲酸类及影响造血功能的化疗药物。
2)实验试剂:淋巴细胞分离液(Ficoll,相对密度1.077),RPMI-1640培养液,胎牛血清(Hyclone公司),培养采用人造血干细胞甲基纤维素培养基(德国Miltenyi Biotec公司产品,StemMACS HSC-CFU,含1%甲基纤维素、IMDM、L-Glutamine(2 mmol/L)、Methylcellulose(1%)、FBS(30%)、BSA(1%)、β-mercaptoethanol(10-4mol/L)。CD34+抗体(德国美天旎公司)。干细胞因子(stem cell factor,SCF)和白介素-3(interleukin-3,IL-3)、粒细胞集落刺激因子(granulocyte-colony stimulating factor,G-CSF)、促粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage-colony stimulating factor,GM-CSF)、促红细胞生成素(erythropoietin,EPO)均为德国美天旎公司产品。
1.2 方法
1)人骨髓单个核细胞(mononuclear,MNCs)的制备:获取的骨髓常规用相对密度为1.077g/mL的淋巴细胞分离液,应用密度梯度离心法获得HPS患者及正常人MNCs,1 500r/min离心10 min,弃去上清,加入1 mL含15%胎牛血清的1640培养液,计数MNC数。
2)CD34阳性细胞的标记:按照磁珠试剂分离说明要求,将分离的骨髓单个核细胞按每1×107细胞加入悬浮于80 μL 4℃ buffer中,加入20 μL混匀的CD34+免疫磁珠进行配比,充分混匀,使磁珠与CD34+细胞充分结合,4℃冷藏30 min。
3)免疫磁珠法分选CD34阳性细胞:将标记好的MNCs,加入孵育体积10 ~20 倍 buffer,1 500 r/min 离心10 min,离心后充分吸除上清,加入500 μL buffer重悬细胞。准备好MS分离柱,置于Mini MACS磁力架上用500 μL buffer润柱。向MS柱中注入细胞悬液,结合CD34阳性细胞的磁珠吸附于磁力架中,收集CD34阴性成分。用500 μL的缓冲液冲洗柱子共3次。将柱子移开磁场到一合适的容器中,用1 mL缓冲液稍用力冲洗。收集CD34阳性细胞。
4)骨髓造血干、祖细胞集落的培养:采用甲基纤维素半固体培养体系培养CD34+细胞,检测集落形成能力。培养体系含1%甲基纤维素、IMDM、L-Glutamine(2 mmol/L)、Methylcellulose(1%)、FBS(30%)、BSA(1%)、β-mercaptoethanol(10-4mol/L)、SCF、IL-3、G-CSF、GM-CSF、EPO 和 CD34+细胞(5 ×103/mL)。在35 mm培养皿中培养(每孔1.1 mL,复种1皿),37C,5%CO2及饱和湿度下培养14 d,分别计数粒-巨噬细胞集落生成单位(colony forming units-granulocyte macrophage,CFU-GM)、爆式红系集落生成单位(burst forming unit-erythroid,BFU-E)、红系集落生成单位(colony forming units,CFU-E)、混合系集落生成单位(colony forming units-granulocyte erythroid macrophage megakaryocyte,CFU-GEMM),其总数为集落形成细胞(colony forming cell,CFC)数。
5)体外实验IFN-γ对血细胞减少的影响:在上述培养体系中加入不同浓度的 IFN-γ,分别为0.1、1、10、100 ng/mL,14 d后观察集落生长情况,并设未添加IFN-γ组为对照组,观察不同浓度梯度IFN-γ对骨髓细胞定向分化的影响。
6)对照组:从上述实验组筛选出能够使骨髓细胞分化发生改变的最低IFN-γ浓度组,以原体系的2倍、5倍、10倍提高G-CSF、GM-CSF及EPO的浓度,并设不提高细胞因子组为对照组,14 d后观察集落生长情况,观察提高细胞生长因子的浓度是否能够克服IFN-γ对骨髓细胞定向分化的干扰,以及相应的浓度比例。
1.3 统计学方法
应用SPSS17.0统计学软件进行统计分析,实验中所涉及的数据均为计量资料,对其分布进行正态性检验,服从正态性检验的数据用均数±标准差(±s)表示,不服从正态性检验的数据应用中位数(四分位数)表示。在两两比较分析中,服从正态分布的计量资料采用t检验,非正态的资料采用秩和检验。组间比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞生长状况的观察
2.1.1 骨髓造血干、祖细胞的生长状况
培养即刻观察,细胞基本分布均匀;培养3 d时,细胞增多,有形成集簇的倾向,以粒单系为主(图1A);培养7 d可见集落增多(图1B),各集簇细胞数目增多;培养14 d时肉眼可见集落形成,集落中心致密,边缘较松散,可见 CFU-GM、BFU-E、CFU-E、CFUGEMM(图1C)。CFU-GM:细胞集落扁平,集落中可含有大小2种类型的细胞,粒细胞较小,单核细胞相对较大;BFU-E:细胞由于含有血红蛋白,颜色可为红色、橙红色或褐色集落,大约含有>200个早期红系祖细胞,越是成熟,颜色越明显(图1D);CFU-E:细胞由于含有血红蛋白,颜色可为红色、橙红色或褐色,集落大约含有8~200个红系祖细胞(图1E)。CFUGEMM类似“煎蛋”的集落形态,具有一个紧凑的中心区域以及透明细胞组成的外周扁平区,含有血红蛋白的细胞呈红色、橙红色或褐色,位于集落外周的细胞有大有小,透明发亮,细胞数目是所有集落类型中最多的(图1F);培养21 d时集落细胞数目增多,但细胞生长状况呈下滑趋势。
2.1.2 应用瑞士染色鉴定集落组成
在显微镜下用毛细吸管吸取目标集落,经瑞氏染色后显微镜下可见幼稚红细胞(图2)。
HPS骨髓与正常人骨髓CD34+细胞在甲基纤维素半固体培养基培养14 d后集落总数目未见差异(130.87 vs 122.67,P=0.493),各系集落中集落数目及集落总数详见表1。
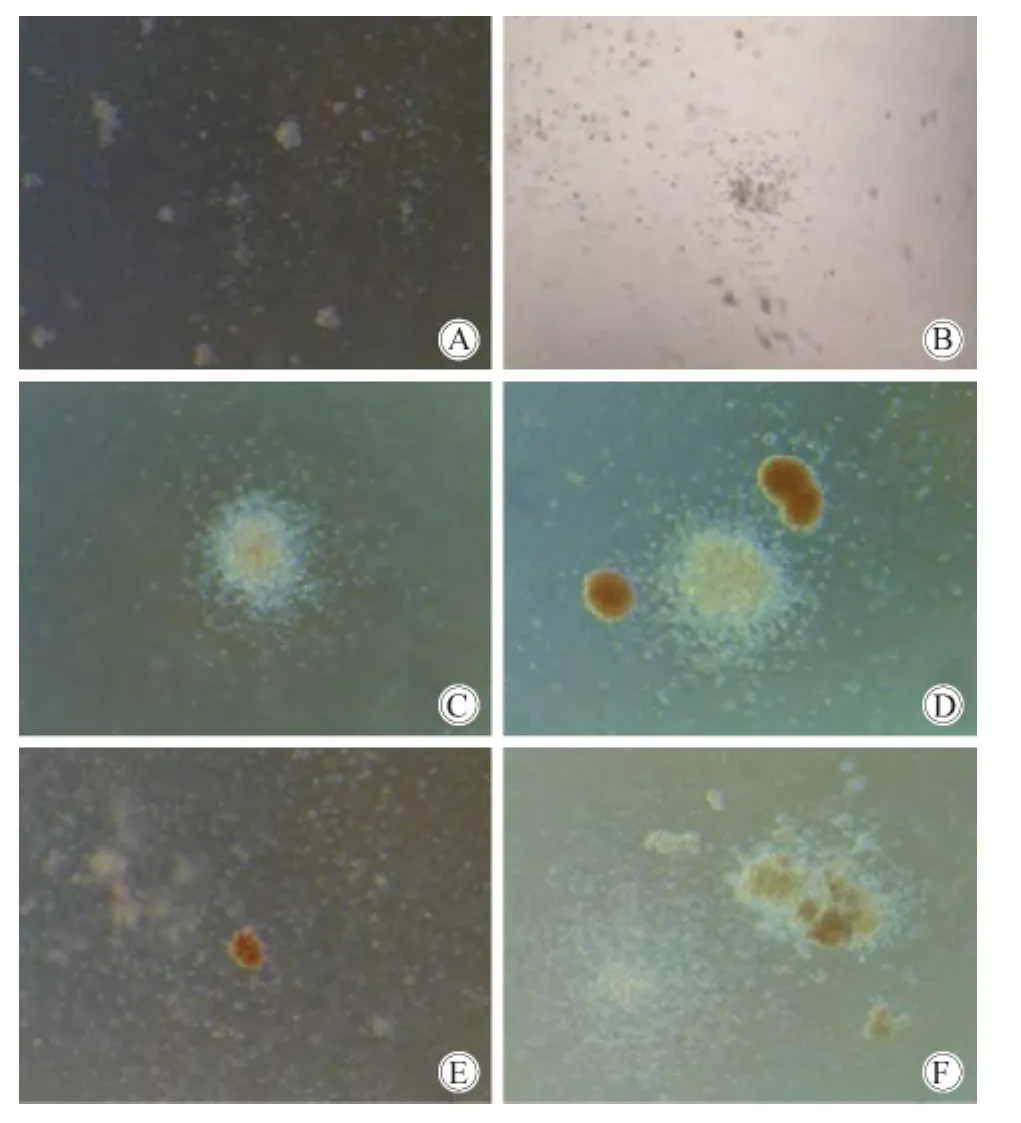
图1 不同天数的集落培养情况Fig.1 CFU colony in different days(40 × )
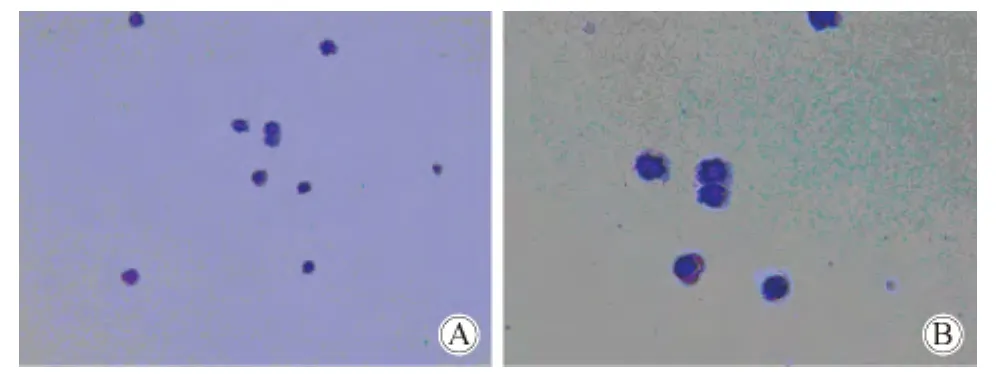
图2 镜下可见幼稚红细胞Fig.2 Immature red blood cells can be seen
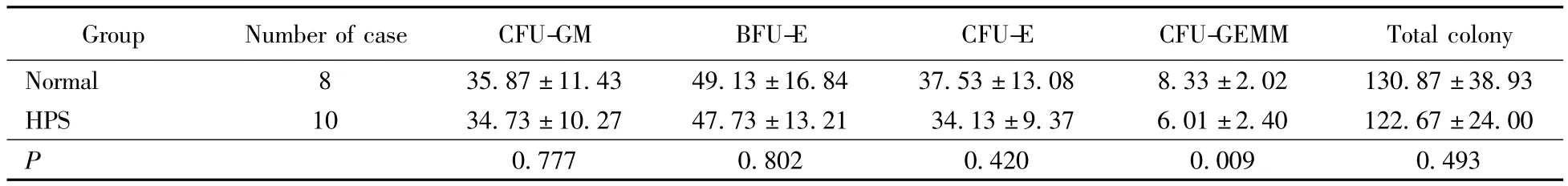
表1 不同组间CFU-GM、BFU-E、CFU-E、CFU-GEMM集落数比较Tab.1 Comparison of the number of CFU-GM,BFU-E,CFU-E,CFU-GEMM of different groups
2.2 IFN-γ对血细胞减少的影响
高倍镜下,培养第3天时,对照组细胞形态饱满、透明度高、折光性强,鲜见毛刺状突起,而不同浓度梯度IFN-γ培养的骨髓细胞可见毛刺状突起,于IFN-γ浓度1 ng/mL起毛刺状突起逐渐增多,形似蝌蚪状,部分细胞可见固缩、凋亡(图3)。
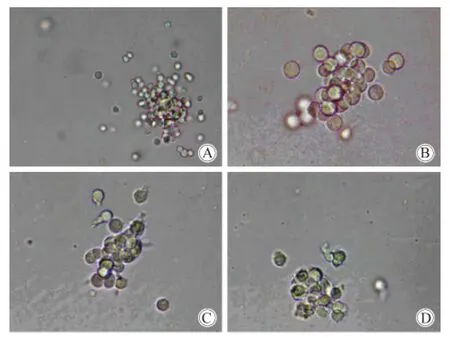
图3 培养3 d后,不同浓度IFN-γ下集落生长情况Fig.3 The growth of colonies in different concentration gradient of IFN-γ at day 3
培养14 d后观察各组细胞,对照组、0.1 ng/mL组集落大小与形态差异无统计学意义、1 ng/mL组大部分集落大小、形态与对照组相比,差异无统计学意义,10 ng/mL组有些集落与对照组相比偏小,100 ng/mL组集落与对照组相比明显偏小(图4)。

图4 培养14 d后,不同浓度IFN-γ下集落生长情况Fig.4 The growth of colony in different concentration gradient of IFN-γ 14 days later(40 ×)
当IFN-γ浓度为0.1 ng/mL时,集落总数目差异无统计学意义(111.83 vs 110.83,P=0.968)各系集落均无差异;当IFN-γ浓度提高到1 ng/mL,集落总数目差异无统计学意义(111.83 vs 86.00,P=0.281),但骨髓细胞的分化已经开始出现影响,CFU-GEMM(8.83 vs 4.17,P=0.004)已经出现明显差异;当IFN-γ浓度提高到10 ng/mL时,集落总数目差异均有统计学意义(111.83 vs 51.50,P=0.024),除CFU-GM外,IFN-γ10 ng/mL组各集落与对照组相比差异均有统计学意义,其中 CFU-GEMM差异有统计学意义。当IFN-γ浓度提高到100 ng/mL时,集落总数目差异有统计学意义(111.83 vs 20.50,P=0.005),IFN-γ100 ng/mL组CFU-GM集落数目与对照组相比差异有统计学意义,其余各集落与对照组相比差异有统计学意义。当IFN-γ浓度提升到10 ng/mL时为体外培养中影响血细胞生长的节点,所以在提升集落刺激因子的实验中,选取IFN-γ浓度10 ng/mL为实验基础。不同浓度IFN-γ组集落数差异比较采用秩和检验法检验,结果表明在不同浓度IFN-γ下,集落数存在差异,详见表2。
2.3 提高细胞因子浓度后,IFN对骨髓细胞定向分化的影响
当集落刺激因子提高到2倍浓度时,集落总数目差异有统计学意义(59.60 vs 101.00,P=0.014,图5),各集落中 BFU-E差异有统计学意义(15.54 vs 25.33,P=0.008),其余集落差异无统计学意义;当集落刺激因子提高到5倍浓度时,集落总数目差异有统计学意义(59.60 vs 127.00,P=0.001),各集落差异有统计学意义,其中CFU-GM、BFU-E差异有统计学意义;当集落刺激因子提高到10倍浓度时,集落总数目差异有统计学意义(59.60 vs 133.67,P=0.001),各集落差异有统计学意义,其中CFU-GM、BFU-E差异有统计学意义。不同浓度集落刺激因子集落数差异比较采用秩和检验法检验,结果表明在不同浓度集落刺激因子条件下,集落数差异有统计学意义。依据上述结果可以看出,在IFN-γ浓度为10 ng/mL时,以原体系的2倍、5倍、10倍提高 G-CSF、GM-CSF及EPO的浓度,骨髓生长情况均较原体系好转(表3)。
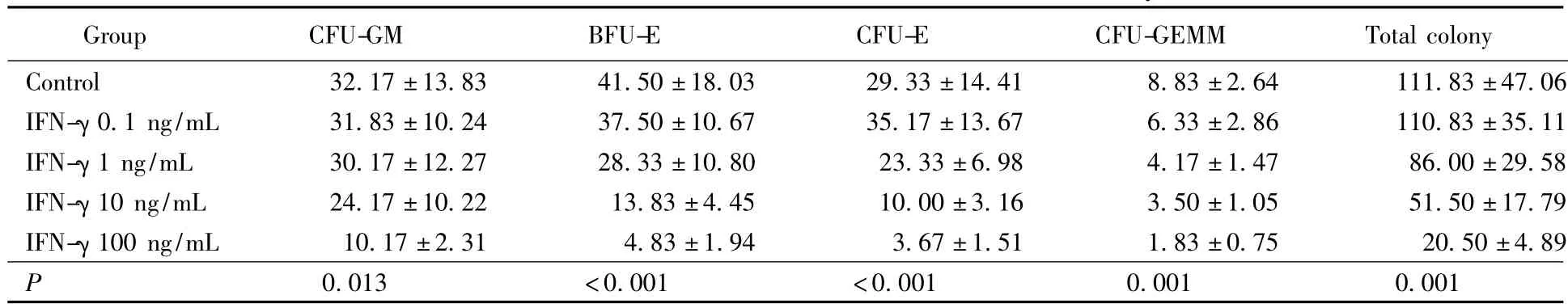
表2 不同浓度IFN-γ组集落数差异比较Tab.2 Comparison of the number of colony in different IFN-γ groups (n=6)
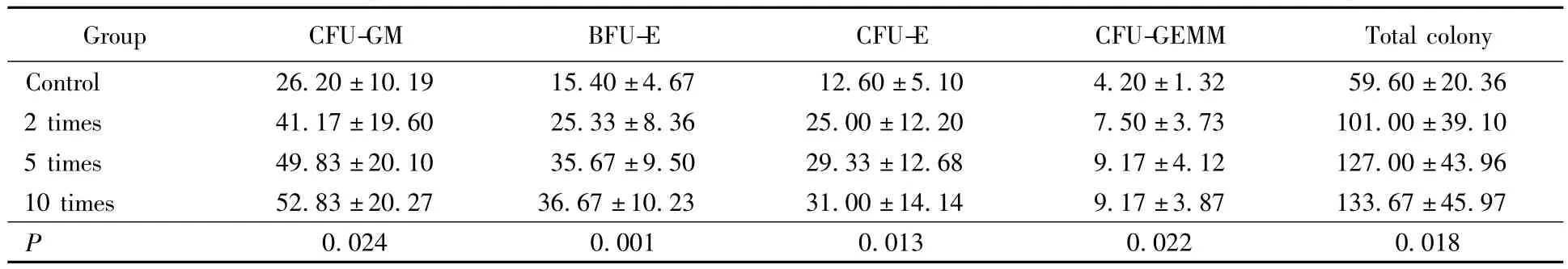
表3 不同浓度集落刺激因子组集落数差异比较Tab.3 Comparison of the number of colony in different colony stimulating factor groups (n=6)
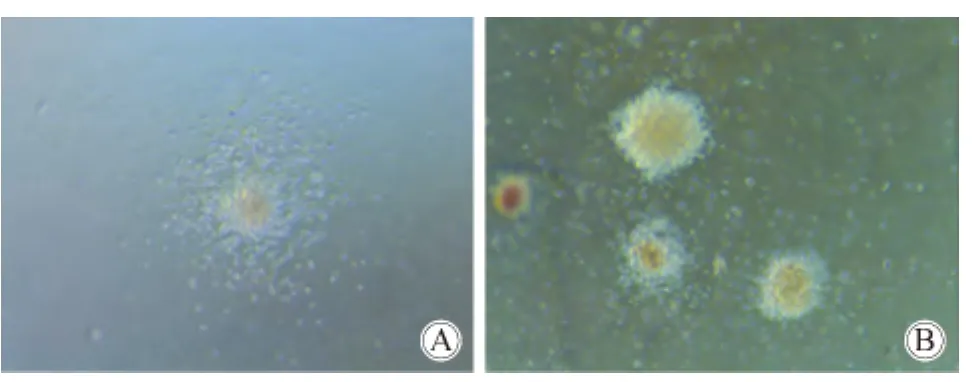
图5 不同浓度集落刺激因子组集落差异比较Fig.5 Comparison of the colony of different colony stimulating factor groups(40×)
3 讨论
在HPS的各种临床特点中,发热及血细胞减少最为常见,几乎见于所有患者,其中外周血两系及以上血细胞减少占97.2%,全血细胞减少者占31.9%[2-3]。而2013年美国血液学年会(American Society of Hematology,ASH)更是指出HPS典型症状为持续高热、肝脾肿大、血细胞减少三联征。各种成分的血细胞减少使患者易于发生感染、出血以及供血和血液携氧功能障碍直接导致患者死亡,并且持续难以纠正的血细胞减少以及因此而产生的各种合并症进一步加重各脏器功能的损害,使患者无法耐受药物治疗的毒性,丧失治疗机会。有研究[4]报道在败血症等感染性疾病中,无法解释的持续性血细胞减少与不良预后密切相关。全血细胞减少的基本成因主要有两大方面,一是骨髓生成障碍,二是外周消耗过多。全血细胞减少被认为是由高浓度的IFN-γ和TNF-α以及噬血现象造成的,噬血现象可以直接导致血细胞被吞噬减少,而IFN-γ介导血细胞减少的机制是什么,其通过何种途径介导血细胞减少尚不明确。造血干细胞是各种血细胞和免疫细胞的起始细胞,具有自我复制和多向分化增生的能力[5-6]。在相应的集落刺激因子的刺激下可以分化为不同的细胞。本实验中发现加入IFN-γ的实验组中,早期即可见到部分骨髓细胞呈毛刺状突起,并有固缩、凋亡现象。细胞凋亡是指为维持内环境稳定,由基因控制的细胞自主的有序的死亡。细胞凋亡首先是细胞缩小,胞质凝缩,内质网疏松并和胞膜融合,核糖体、线粒体等聚集,但结构无明显改变。染色质逐渐凝集成新月状,附在核膜周边,嗜碱性增强。之后细胞核固缩成均一的致密物,进而核碎裂,胞膜完整。继之核膜出芽,固缩染色质脱落,形成膜包凋亡小体。最终凋亡小体被周围吞噬细胞吞噬降解[7]。本实验中加入干扰素培养第3天时,对照组细胞形态饱满、透明度高、折光性强,鲜见毛刺状突起,而不同浓度梯度IFN-γ培养的骨髓细胞可见毛刺状突起,于IFN-γ浓度1 ng/mL起毛刺状突起逐渐增多,形似蝌蚪状,可疑为细胞凋亡过程中的膜出芽阶段。IFN-γ是一种具有多种生物学活性的细胞因子。已有研究[8-10]证明,在动物及人体内可以通过诱导CD34阳性细胞Fas的表达及促进半胱天冬酶1、3、8的上调和活化,促进造血干祖细胞的凋亡,引起全血细胞减少。IFN-γ可以上调细胞表面CD95数目,增强Fas/FasL凋亡途径,从而促进细胞凋亡。体外实验[11]也已证实,外源性IFN-γ对髓系、红系、巨核细胞系等多能集落形成有直接抑制作用。本实验中不同浓度的IFN-γ实验组,骨髓生长状态有着不同的表现,当IFN-γ浓度在0.1 ng/mL时,骨髓的增生、分化基本不受影响,培养14 d后各系集落数目以及集落数目总和与对照组相比差异无统计学意义。显微镜下观察集落形态与对照组差异无统计学意义,集落致密。当IFN-γ浓度提高到1 ng/mL时,虽然粒系、红系以及集落数目总和较对照组没有明显变化,但镜下可见一部分集落形态偏小。当IFN-γ浓度逐渐升高后,小集落所占比例也相应增高。当IFN-γ浓度增加至100 ng/mL时,可见骨髓生长受到明显抑制。证实了干扰素在骨髓抑制中起到了重要的作用。
体外半固体细胞培养集落形成单位是评价造血前体细胞增生分化能力的重要指标,在适宜的集落刺激因子诱导下,不同的定向祖细胞可产生相应的集落,如 CFU-GM、BFU-E、CFU-E、CFU-GEMM 等。集落刺激因子通常可以用于化疗后骨髓抑制,或疾病后造血因子缺乏造成的血细胞减少[12]。本实验中提高集落刺激因子浓度后集落数目有明显增长,证明对IFN-γ的骨髓抑制作用有一定的改善作用。目前集落刺激因子在HPS患者中的应用尚存争议。有研究[13]表明在HPS治疗早期,联合使用血小板生成素(thrombopoietin,TPO)可以提高血小板计数水平、缩短血小板减少的持续时间,促进血小板恢复正常范围,减少输血次数和严重出血事件发生,并且对HPS治疗无任何负面影响。
[1] Veerbsky J W,Grossman W J.Hemophagocytic lymphohistiocytosis:diagnosis,pathophysiology,treatment,and future perspectives[J].Ann Med,2006,38:20-31.
[2] Janka G E.Familial and acquired hemophagocytic lymphohistiocytosis[J].Eur J Pediatr,2007,166(2):95-109.
[3] 王旖旎,王昭,吴林,等.多中心72例噬血细胞综合征诊疗分析[J]. 中华血液学杂志,2009,30(12):793-798.
[4] Imran M N,Leng P H,Yang S,et al.Early predictors of mortality in pneumococcal bacteraemia[J].Ann Acad Med Singapore,2005,34(7):426-431.
[5] 蔡大利,高峰,高然,等.异基因外周血造血干细胞联合骨髓移植治疗重型再生障碍性贫血4例报告[J].中国医科大学学报,2013,42(4):379-381.
[6] 陈惠仁.血液科造血干细胞移植技术新进展与发展设想[J]. 解放军医药杂志,2013,25(4):1-5.
[7] 赵卫红.细胞凋亡的生物学特征.见赵卫红,寿好长,闫福岭,等主编.细胞凋亡[M].郑州:河南医科大学出版社,1997,7-11.
[8] Welsh J P,Rutherford T R,Flynn J,et al.In vitro effects of interferon-gamma and tumor necrosis factor-alpha on CD34+bone marrow progenitor cells from aplastic anemia patients and normal donors[J].Hematol J,2004,5(1):39-46.
[9] Dai C,Krantz S B.Interferon-γ induces upregulation and activetion of caspases 1,3,and 8 to produce apoptosis in human erythroid progenitor cells[J].Blood,1999,93(10):3309-3316.
[10] Platanias L C.Mechanisms of type-Ⅰ-and type-Ⅱ -interferon-mediated signalling[J].Nat Rev Immunol,2005,5(5):375-386.
[11] Chatterjee S,Dutta R K,Basak P,et al.Alteration in marrow stromal microenvironment and apoptosis mechanisms involved in aplastic anemia:an animal model to study the possible diseasepathology [J]. Stem CellsInt, 2010,2010:932354.
[12]陈勤,汤屹,孟力.骨髓呈再生障碍性贫血样表现的低增生性白血病[J].临床误诊误治,2012,25(1):11-14.
[13] Wang Y,Wang Z,Wu L,et al. Recombinant human thrombopoietin is an effective treatment for thrombocytopenia in hemophagocytic lymphohistiocytosis[J]. Ann Hematol,2013, 92( 12) : 1695-1699.
