FOXP3基因多态性与儿童ITP发病及进展的相关性研究
2014-12-02刘夫红陈振萍马静瑶魏沄沄吴润晖
刘夫红 陈振萍 马静瑶 魏沄沄 吴润晖
(首都医科大学附属北京儿童医院血液肿瘤中心,北京100045)
免疫性血小板减少症(immune thrombocytopenia,ITP)是一种最常见的获得性免疫介导的、以血小板数目下降和皮肤黏膜出血为主要临床表现的出血性疾病[1]。迄今为止,认为ITP的主要发病机制尚不明确,但是免疫失耐受被认为是出现自身免疫异常的核心环节。近年来对ITP免疫失耐受的机制进行了很多的研究,其中调节性T细胞(CD4+/CD25+regulatory T cells,Treg)的研究尤为引人注目。
调节性T细胞可产生抑制性细胞因子[如白介-10(interleukin-10,IL-10)、肿瘤坏死因子-β(transforming growth factor-β,TGF-β)等]依赖细胞毒 T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)等共刺激分子,通过细胞-细胞接触依赖的抑制模式发挥作用,最终通过抑制Th细胞的活化/分化及直接抑制B细胞活化产生抗体两种途径来阻止自身免疫病的发生[2]。FOXP3(Forkhead Box P3)基因特异性表达于 Treg细胞,调节Treg细胞的抑制功能,从而在免疫性疾病的发病中起到重要作用[3-4]。研究[5]表明在慢性 ITP患儿中存在Th17/Treg平衡紊乱。ITP患儿中CD4+CD25+T细胞明显减低,并且FOXP3呈低表达状态[6-7]。提示FOXP3基因表达差异及Treg细胞数量在ITP的发病中起重要作用。而FOXP3基因表达的差异被认为与基因的单核苷酸多态性(single nucleotide polymorphism,SNP)有关,并且目前研究[8-9]表明FOXP3基因单核苷酸多态性与多种自身免疫性疾病如系统性红斑狼疮(systemic lupus erythematos,SLE)、类风湿性关节炎等相关。ITP作为一种比较经典的自身免疫性疾病,Treg细胞及FOXP3在其发生及发展中起到了重要作用,推测FOXP3基因多态性与ITP遗传易感及疾病进展相关性有关,但尚未见报道。结合 HapMap网站[10]中汉族人群资料,由于在中国人群中 FOXP3基因启动子区及外显子区的SNP位点均无频率,故本研究选取了第1内含子区内变异频率相对较高且研究较为广泛的3个SNP位点:rs2232365、rs3761547和rs3761548进行基因测序研究。
1 材料与方法
1.1 病例来源
本研究从2009年10月至2013年12月收集首都医科大学附属北京儿童医院血液肿瘤中心病房确诊的儿童ITP患者病例标本及病例资料作为研究组;同期收集与实验组患儿临床资料相匹配的健康志愿者的血液标本作为对照组。所有入组患儿鉴护人均签署知情同意书。
1.2 疾病定义及分组标准
ITP的诊断标准与既往研究[1]报道相同。
由于实验组与健康对照组年龄存在差异,为避免年龄差异所导致的偏倚,故在与对照组进行比较时,对实验组年龄匹配,具体原则为:在统计专家指导下,实验组患儿从最小年龄开始逐一剔除,保证2组年龄差异无统计学意义的同时保证最大样本量,匹配后实验组病例共135例,其中男81例,女54例。中位年龄:94月,两组在性别、年龄上差异均无统计学意义(P值分别为0.838和0.098)。
实验组根据病程及转归又分为2组,观察时间不足12个月且尚未缓解者及失访患儿不计入上述2组:
(1)病程在12个月以内组:ITP患儿在12个月内获得完全缓解,血小板计数>100×109/L;
(2)病程在12个月以上组:ITP患儿在12个月内尚未获得完全缓解,血小板计数仍<100×109/L。
1.3 DNA 提取
紫帽管(含EDTA抗凝剂)收集,并保证在采集后2 h内提取全血细胞。利用DNA提取试剂盒DNeasy Blood&Tissue Kit(QIAGEN)提取全血细胞DNA。
1.4 基因型测定
采用Sequenom SNP位点分型检测方法进行基因多态性位点检测。
10%样本进行重复测定并同时利用直接测序的方法进行比对,其一致率100%,再次确认实验过程及结果的准确性和可信性。
1.5 统计学方法
采用SPSS 17.0进行统计分析。计数资料采用例数及百分比表示,组间比较采用Person χ2检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 研究对象的临床特征
入选该实验并进行SNP统计学计算的样本包括实验组病例328例,其中男194例,女134例;中位年龄:36个月,范围1~210个月;对照组219例,其中男129例,女90例;中位年龄:84个月,范围36~156个月。实验组根据临床随访1年转归分为:1)病程在12个月以内组:197例;2)病程在12个月以上组:68例;3)观察时间不足12个月尚未缓解者:40例;4)失访:23例。具体详见表1。
2.2 基因型及基因频率在各组之间的比较
对照组FOXP3基因3个SNP位点与基因频率与HapMap中统计的中国北京汉族健康人群的基因频率相一致,差异无统计学意义。具体详见表2。提示对照组的代表性及实验的可靠性。

表1 一般病例资料Tab.1 The characteristics of the subjects

表2 FOXP3 3个位点在对照组及HapMap中中国北京汉族健康人群基因频率比较Tab.2 FOXP3 SNP alleles in controls and CHB
SNP位点等位基因和基因型频率分布及其在性别年龄均匹配实验组与对照组之间的比较:rs2232365位点基因型在性别年龄均匹配实验组及对照组之间差异有统计学意义(P=0.035),且性别年龄均匹配实验组AG基因型频率较正常对照组明显增高(P=0.013,OR值2.093,95%可信区间范围1.156~3.793)。rs3761547位点基因型及频率在性别年龄均匹配实验组及对照组之间差异无统计学意义(P值分别为0.738和0.787)。rs3761548位点基因型及频率在性别年龄均匹配实验组及对照组之间差异无统计学意义(P值分别为0.711和0.811)。详见表3。
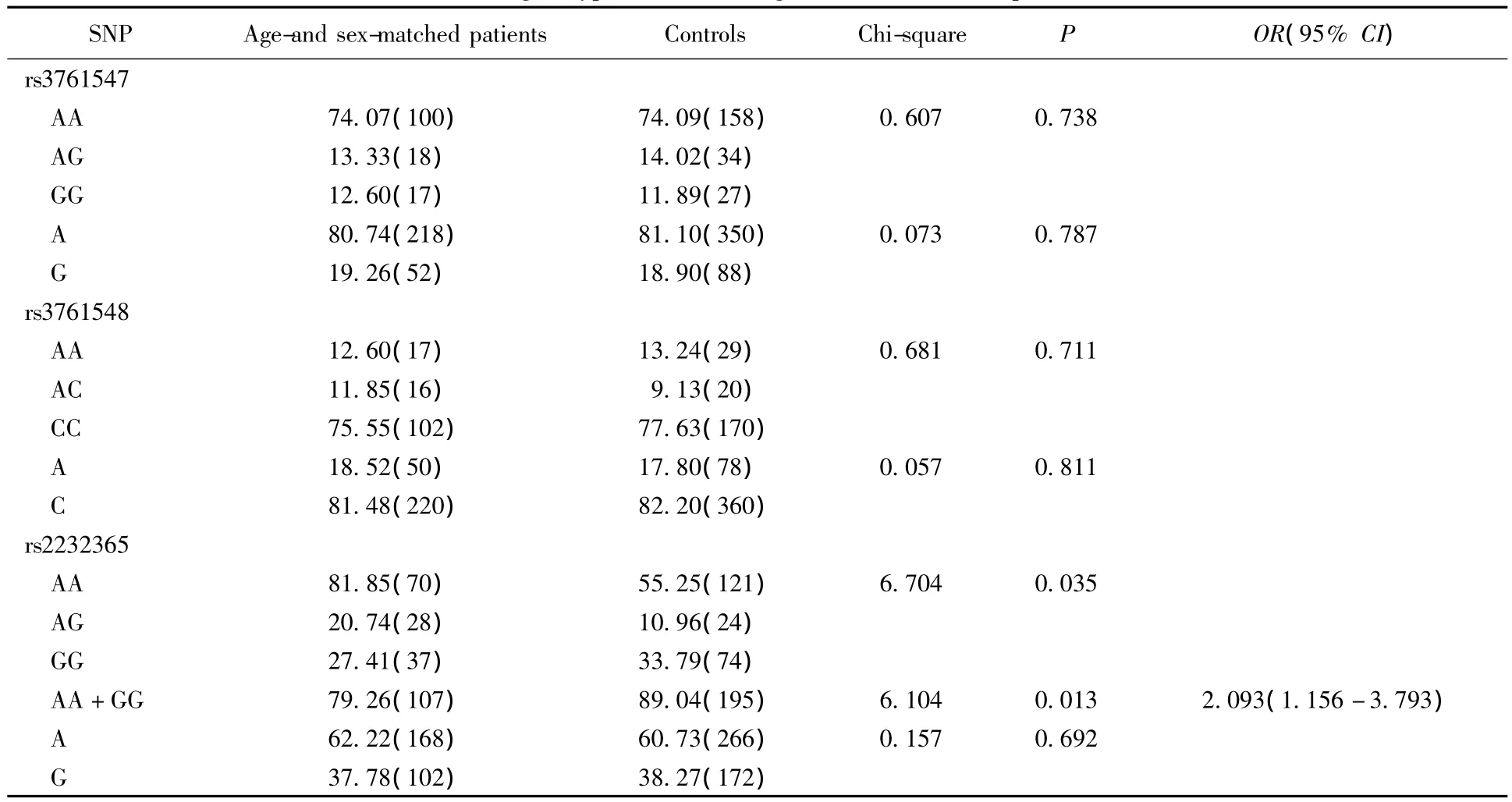
表3 FOXP3 SNP各位点基因型和等位基因的频率在性别年龄均匹配实验组及对照组之间的比较Tab.3 FOXP3 SNP genotypes/alleles in age-and sex-matched patients and controls n(%)
SNP位点等位基因和基因型频率在不同病程间的比较:rs3761547位点基因型在不同病程间差异有统计学意义(P=0.027),且12个月以上组GG基因型较 12月以内组明显增高,(P=0.008,OR值2.579,95%可信区间范围1.255至5.299)提示携带GG型基因患者可能预后欠佳,病程迁延,且该位点A与G基因频率在两组之间差异有统计学意义(P=0.001),提示该位点单核苷酸多态性与儿童ITP病程及疾病进展有相关性,携带G型基因更易发展为慢性,病程迁延。
rs3761548位点基因型及频率在不同病程间差异无统计学意义(P值分别为0.839和0.506),提示该位点单核苷酸多态性与 ITP病程进展无相关性。rs2232365位点基因型在不同病程间差异无统计学意义(P=0.232),但该位点A与G基因频率在2组之间差异有统计学意义(P=0.033),提示该位点基因频率单核苷酸多态性与ITP病程进展有相关性,携带G型基因更易发展为慢性,病程迁延详见表4。

表4 FOXP3 SNP位点各基因型和等位基因的频率及其在不同病程中的比较Tab.4 FOXP3 SNP genotypes/alleles in different disease course groups n(%)
3 讨论
自身免疫性疾病是一类复杂的,多有遗传背景的疾病,其发生及发展可能是遗传因素及环境因素相互作用的结果[11-12]。单核苷酸多态性(single nucleotide polymorphism,SNP)研究有助于解释个体的表型差异,其多态性研究可能会进一步揭示基因不同表达导致其参与免疫调控差异的多样性机制。人类FOXP3基因突变和单核苷酸多态性被证实可以导致多种自身免疫性疾病的产生。目前已经被证实FOXP3基因单基因突变(AAUAAA→AAUGAA)可以导致人类免疫失调、多发性内分泌腺病、肠病、X连锁综合(即IPEX 综合征)[13]。Ban 等[14]研究表明 FOXP3 基因多个位点基因多态性与高加索及日本地区自身免疫性甲状腺疾病密切相关。国内Chen等[15]研究证实FOXP3基因rs2280883和rs3761549多态性可能与B型乙型肝炎病毒相关性原发性肝癌有相关性;Lan等[16]研究表明FOXP3基因rs3761549基因多态性与SLE相关,且T等位基因为壮族自治区SLE的危险因素,Zhang等[17]证实 FOXP3 IVS9+459基因与重症肌无力有相关性。从而提示FOXP3基因多态性在免疫系统稳态中的重要作用。而在与本文相关的3个位点研究中:
3.1 在FOXP3 rs3761547位点研究中
Song[18]发现该位点基因多态性与银屑病的发病相关,携带AA+AG基因型者更有遗传易感性;此外国内研究[19]表明该位点与过敏性鼻炎的发病相关性不大,但是与尘螨过敏患者发展为过敏性鼻炎相关[20]。本研究结果表明该位点基因多态性在不同ITP病程间差异有统计学意义,且病程在12个月以上组GG基因型较病程12月以内组明显增高,提示该位点单核苷酸多态性与儿童ITP病程及疾病进展有相关性,携带GG型基因患者及G型基因患者更易发展为慢性,病程迁延,预后不佳。但与儿童ITP的遗传易感性无相关性。
3.2 在FOXP3 rs3761548位点研究中
研究[21]表明rs3761548 AA基因型携带者肾移植后获得免疫排斥反应的概率是rs3761548 CC型携带者的4倍,rs3761548基因多态性与肾移植后免疫排斥反应有显著相关性;携带rs3761548A型等位基因可以增加不明原因流产的风险[22]。rs3761548 AA型在汉族及匈牙利民族变应性鼻炎中均为保护因素,在女性狼疮患者中有更低的ds-DNA表达,但却有更高的白癜风及牛皮癣患病可能[18,23-25]。但也有学者研究[26-29]表明rs3761548与银屑病、多发性硬化、先兆子痫、子宫内膜异位、重症肌无力等疾病的发病无相关性。本实验结果显示该位点基因多态性在性别年龄均匹配实验组及对照组之间差异无统计学意义,在不同病程之间的比较中差异也无统计学意义,提示该位点与儿童ITP的发病及疾病进展尚无明显的相关性。
3.3 在FOXP3 rs2232365位点研究中
Wu等[22]研究表明rs2232365G型可以增加不明原因流产的风险;rs2232365AA型患者有更高的银屑病遗传易感性[13],但也有研究[24]证实该位点基因多态性与汉族人群银屑病遗传易感性尚无明显相关性。本实验结果显示rs2232365位点AG基因型频率在性别年龄均匹配实验组较正常对照组明显增高,提示位点基因型多态性与儿童ITP发病相关,携带AG基因型可能为儿童ITP发病的易感因素,且在实验组不同病程之间比较时差异有统计学意义,携带G型基因更易发展为慢性,病程迁延。
本研究结果提示FOXP3基因作为Treg细胞重要的调节因子,其单核苷酸多态性可能与儿童ITP的疾病发生及病程进展相关,有助于儿童ITP的诊断及预后判断。外源性引入FOXP3+Treg细胞有效阻止了异基因移植排斥反应[30],在移植中起到重要作用[31]。提示FOXP3基因可作为免疫性疾病靶向治疗的关键。而本实验中rs2232365位点基因多态性提示与ITP的发生发展均有相关性,有可能是疾病机制的关键,更有可能为疾病的治疗靶点提供证据。
结论:rs2232365位点基因型单核苷酸多态性与ITP发病相关,携带AG基因型可能为ITP发病的易感因素,rs3761547 GG基因型及 G等位基因、rs2232365位点G等位基因的ITP患儿更易发展为慢性,病程迁延。rs3761548位点单核苷酸多态性表达与儿童 ITP疾病进展及转归无相关性。FOXP3 rs2232365位点单核苷酸多态性与儿童ITP的发生发展均相关,可能是疾病机制的关键,更有可能为疾病的治疗靶点提供证据。
[1] Rodeghiero F,Stasi R,Gernsheimer T,et al.Standardization of terminology,definitions and outcome criteria in immune thrombocytopenic purpura of adults and children:report from an international working group[J].Blood,2009,113(11):2386-2393.
[2] Yeh H,Moore D J,Markmann J F,et al.Mechanisms of regulatory T cell counter-regulation by innate immunity[J].Transplant Rev(Orlando),2013,27(2):61-64.
[3] Janson P C,Winerdal M E,Marits P,et al.FOXP3 promoter demethylation reveals the committed Treg population in humans[J].PLoS One,2008,3(2):e1612.
[4] Lee S M,Gao B,Fang D.FoxP3 maintains Treg unresponsiveness by selectively inhibiting the promoter DNA-binding activity of AP-1[J].Blood,2008,111(7):3599-3606.
[5] Wang J D,Chang T K,Lin H K,et al.Reduced expression of transforming growth factor-β1and correlated elevation of interleukin-17 and interferon-γ in pediatric patients with chronic primary immune thrombocytopenia(ITP)[J].Pediatr Blood Cancer,2011,57(4):636-640.
[6] Aboul-Fotoh Lel-M,Abdel Raheem M M,El-Deen M A,et al.Role of CD4+CD25+T cells in children with idiopathic thrombocytopenic purpura[J].Pediatr Hematol Oncol,2011,33(2):81-85.
[7] Zahran A M,Elsayh K I.CD4+CD25+High Foxp3+regulatory T Cells,B lymphocytes,and T lymphocytes in patients with acute ITP in Assiut children Hospital[J].Clin Appl Thromb Hemost,2014,20(1):61-67.
[8] Stelmaszczyk-Emmel A,Jackowska T,Rutkowska-Sak L,et al.Identification,frequency,activation and function of CD4+CD25(high)FoxP3++regulatory T cells in chidhood with juvenile idiopathic arthritis[J].Rheumatol Int,2012,32(5):1147-1154.
[9] Atfy M,Amr G E,Elnaggar A M,et al.Impact of CD4++CD25high regulatory T-cells and FoxP3 expression in the peripheral blood of patients with systemic lupus erythematosus[J].Egypt J Immunol,2009,16(1):117-126.
[10] Morgan M E,Van Bilsen J H,Bakker A M,et al.Expression of FOXP3 mRNA is not confined to CD4+CD25+T regulatory cells in humans[J].Hum I mmunol,2005,66(1):13-20.
[11]张春梅.免疫性血小板减少症患者淋巴细胞亚群表达及其与血小板抗体、临床特征的相关性研究[J].中国煤炭工业医学杂志,2012,15(10):1524-1526.
[12]贲莹,张凤华,张冬.免疫细胞及相关细胞因子在格林-巴利综合征和实验性自身免疫性神经炎中的作用研究进展[J]. 解放军医药杂志,2013,25(2):14-16.
[13] Harbuz R,Lespinasse J,Boulet S,et al.Identification of new FOXP3 mutations and prenatal diagnosis of IPEX syndrome[J].Prenat Diagn,2010,30(11):1072-1078.
[14] Ban Y,Tozaki T,Tobe T,et al.The regulatory T cell gene FOXP3 and genetic susceptibility to thyroid autoimmunity:an association analysis in Caucasian and Japanese cohorts[J].J Autoimmun,2007,28(4):201-207.
[15]Chen Y,Zhang H,Liao W,et al.FOXP3 gene polymorphism is associated with hepatitis B-related hepatocellular carcinoma in China[J].J Exp Clin Cancer Res,2013,32:39.
[16] Lan Y,Tang X S,Qin J,et al.Association of transcription factor FOXP3 gene polymorphism with genetic susceptibility to systematic lupus erythematosus in Guangxi Zhuang population[J].Zhonghua Yi Xue Yi Chuan Xue Za Zhi,2010,27(4):433-436.
[17] Zhang J,Chen Y,Jia G,et al.FOXP3-3279 and IVS9+459 polymorphisms are associated with genetic susceptibility to myasthenia gravis[J].Neurosci Lett,2013,534:274-278.
[18]Song P,Wang X W,Li H X,et al.Association between FOXP3 polymorphisms and vitiligo in a Han Chinese population[J].Br J Dermatol,2013,169(3):571-578.
[19]张媛,王成硕,张罗.FOXP3基因多态性与变应性鼻炎的相关性研究[J].中华耳鼻喉头颈外科学杂志,2010,45(5):397-400.
[20]娄玮,王成硕,张罗.调节性T细胞在过敏性鼻炎及抗原特异性免疫治疗中的作用[J].首都医科大学学报,2012,33(6):729-734.
[21]Qiu X Y,Jiao Z,Zhang M,et al.Genetic association of FOXP3 gene polymorphisms with allograft rejection in renal transplant patients[J].Nephrology(Carlton),2012,17(4):423-430.
[22] Wu Z G,You Z S,Zhang C,et al.Study on association of functional polymorphisms in Foxp3 gene with the susceptibility to unexplained recurrent spontaneous abortion [J].Zhonghua Fu Chan Ke Za Zhi,2011,46(10):763-768.
[23] Fodor E,Garaczi E,Polyanka H,et al.The rs3761548 polymorphism of FOXP3 is a protective genetic factor against allergic rhinitis in the Hungarian female population[J].Hum Immunol,2011,72(10):926-929.
[24] Gao L,Li K,Li F,et al.Polymorphisms in the FOXP3 gene in Han Chinese psoriasis patients[J].J Dermatol Sci,2010,57(1):51-56.
[25] Jahan P,Cheruvu R,Tippisetty S,et al.Association of FOXP3(rs3761548)promoter polymorphism with nondermatomal vitiligo:A study from India[J].J Am Acad Dermatol,2013,69(2):262-266.
[26]Lin Y C,Lee J H,Wu A S,et al.Association of singlenucleotide polymorphisms in FOXP3 gene with systemic lupus erythematosus susceptibility:a case-control study[J].Lupus,2011,20(2):137-143.
[27] Andre G M,Barbosa C P,Teles J S,et al.Analysis of FOXP3 polymorphisms in infertile women with and without endometriosis[J].Fertil Steril,2011,95(7):2223-2227.
[28] D'Amico F,Skarmoutsou E,Marchini M,et al.Genetic polymorphisms of FOXP3 in Italian patients with systemic sclerosis[J].Immunol Lett,2013,152(2):109-113.
[29]Metz T D,Nelson L M,Stoddard G J,et al.FOXP3 gene polymorphisms in preeclampsia[J].Am J Obstet Gynecol,2012,206(2):165.e1-6.
[30]Xia G,Shah M,Luo X.Prevention of allograft rejection by amplification of Foxp3+CD4+CD25+regulatory T cells[J].Transl Res,2009,153(2):60-70.
[31] Tang Q,Bluestone J A,Kang S M.CD4+Foxp3+regulatory T cell therapy in transplantation[J].J Mol Cell Biol,2012,4(1):11-21.
