中国对虾选育群体与近交群体不同生长时期的生长性状和存活率的比较*
2014-12-02王清印曹宝祥
罗 坤,孔 杰,栾 生,王清印,曹宝祥,刘 宁
(1.中国海洋大学,山东 青岛 266003;2.中国水产科学研究院黄海水产研究所,山东 青岛 266071)
中国对虾(Fenneropenaeuschinensis)是我国最具代表性的水产养殖种类之一,养殖区主要在黄渤海沿岸。中国对虾的养殖产量在最高年份(1990年前后)曾占到我国对虾养殖产量的70%,达15万t左右[1-2]。但1990年代初出现的病害肆虐、种质退化等问题已严重影响了本养殖业的发展[3-4]。针对中国对虾养殖业面临的困境,中国水产科学研究院黄海水产研究所于1997年开展了中国对虾的遗传选育工作,并于2003、2008年先后培育出中国对虾“黄海1号”(GS-01-001-2003)、中国对虾“黄海2号”新品种(GS-01-002-2008),为中国对虾养殖业的二次创业注入了活力。
无论是人工养殖还是自然条件下,近交的发生通常会导致物种某些表型性状的降低[5],即近交衰退。已有研究表明,近交不仅使猪、牛、羊等哺乳动物的生产性状产生严重的衰退[6-8],对水生动物的近交衰退影响也较为严重,如鱼类[9]、贝类[10]和虾类[11]等,普遍存在近交衰退现象。尽管目前已有不少研究对虾近交的报道[12-15],但关于选育多代后选育群体的全同胞近交一代与选育核心群体在不同时期的生长、存活研究则鲜有报道。
本实验选用中国对虾“黄海2号”(G11)的核心群后代(G12),及育种过程中建立的全同胞兄妹交配形成的近交一代群体为材料,这些群体均有完整的系谱记录,通过研究2个群体类型不同时期的体重和存活率性状来评价中国对虾经多代选育后的核心群体与全同胞近交一代群体的生长、存活差异及近交衰退程度,为进一步的良种选育工作提供数据支持。
1 材料与方法
1.1 实验用虾
选育群体来源:中国对虾“黄海2号”核心家系(G11),近交系数在1%以内。
全同胞近交一代群体来源:选取中国对虾“黄海2号”核心家系(G11)进行全同胞兄妹交配,获得全同胞近交一代群体,近交系数为25%。
1.2 家系构建
采用人工授精技术,以中国对虾“黄海2号”核心家系(G11)为亲本进行选育群体(G12)、全同胞近交一代群体的家系构建,并按照标准化操作程序进行家系苗种的培育,以最大限度地降低养殖环境对家系培育的影响。挑选性腺发育成熟的雌虾移入单个产卵桶内,在14℃水温下孵化2d;随机选取3 000尾无节幼体放入200L桶内进行幼体的培育;幼体变态至仔虾时,随机选取400尾仔虾放入200L桶内进行单独培育;仔虾第20天时,随机选取120尾仔虾移入3m3缸内进行中间培育。
为减少日龄引起的家系差异,选择出生日期在3d之内的家系进行性状测试,每个群体类型各选择8个家系。
1.3 性状测试
仔虾经过中间培育后平均体长达到3cm时,选择颜色组合对每个家系的个体进行第6腹节的荧光标记,用以区分不同的家系。每个群体类型的家系各标记30尾个体,逐尾称量初始体重后平均放入2个池子中进行各类别家系的共同养殖,测试2个群体的生长和存活率。
水泥池规格为3m×3m×1.5m,每池放入240尾,每天投喂配合饲料4次,日投喂量为对虾体重的5%~8%,每天换水1/3。为了分析不同生长时期(生长早期、生长中期和收获期)2个群体的生长和存活率差异,于混合养殖后的第10、20、30、50、第80天进行对虾体重的测量和家系存活数量的统计。
1.4 数据分析
应用SPSS软件对数据进行单因素方差分析(ANOVA),采用最小显著差数法(LSD)进行多重比较,比较其差异显著性。
生长性状的特定生长率(SGR)通过以下公式获得:

其中:Wb和We分别指初始体重和终末体重;t为养殖天数。
近交衰退系数(The inbreeding depression coefficient,IDC)通过下列公式估计:
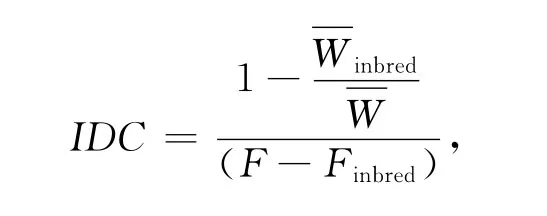
2 结果
2.1 生长性状
中国对虾选育群体、全同胞近交一代群体不同养殖阶段的平均体重值及生长趋势情况见表1。方差分析及显著性检验表明,2个群体共同养殖测试时的初始体重差异不显著(P>0.05),随着养殖时间的延长,选育群体与全同胞近交一代群体体重逐渐增加,并出现显著性差异(P<0.05)。其中,共同养殖测试第10天,选育群体、全同胞近交一代群体的体重无显著性差异(P>0.05);共同养殖测试第20、30、50、80天,选育群体的体重均与全同胞近交一代群体存在显著性差异(P<0.05),在这4个养殖阶段,选育群体的平均体重比全同胞近交一代群体分别高出12.42%、16.95%、13.74%、16.18%。
2个群体不同养殖阶段的体重变异系数见表2。从各个养殖阶段来看,选育群体的体重变异系数范围为14.89%~24.80%,属于中等变异,说明选育群体依然具有较大的选育空间;全同胞近交一代群体的体重变异系数范围为20.94%~33.95%,且体重变异系数在每个养殖阶段均大于选育群体,在第50天,2个群体体重的变异系数最大,分别为24.80%、33.95%,说明选育群体和全同胞近交一代群体在第50天养殖阶段的体重性状离散程度达最大,由于2个群体的平均体重存在显著差异,也说明全同胞近交一代群体存在一定程度的性状分离。
中国对虾选育群体、全同胞近交一代群体不同养殖阶段的特定生长率结果见表3。从表3可以看出,在不同养殖阶段,2个群体的特定生长率不同,选育群体在第20天特定生长率最高,为3.52,全同胞近交一代群体在第10天特定生长率最高,为3.00;在第30、50和80天,2个群体的特定生长率均呈现下降趋势;从整个养殖测试阶段来看,选育群体的特定生长率高于全同胞近交一代群体,分别为2.04、1.91。

表1 中国对虾选育群体、全同胞近交一代群体不同养殖阶段体重比较Table 1 Comparison of body weight between selected population and first inbreeding generation of full-sibling mating population at different ages

表2 中国对虾选育群体、全同胞近交一代群体不同养殖阶段体重变异系数Table 2 Coefficient of variation of body weight of selected population and inbreeding population at different ages

表3 中国对虾选育群体、全同胞近交一代群体不同养殖阶段特定生长率比较Table 3 Comparison of specific growth rate between selected population and first inbreeding generation of full-sibling mating population at different ages
2.2 存活率
中国对虾选育群体、全同胞近交一代群体不同养殖阶段的平均存活率结果见表4。如表4所示,在第10、20天的养殖阶段,选育群体与全同胞近交一代群体的存活率均较高,达85%以上,且2个群体的存活率均不存在显著差异(P>0.05);在第30、50和90天养殖阶段,2个群体的存活率呈下降趋势,群体间存活率均存在显著差异(P<0.05),且选育群体平均存活率均高于全同胞近交一代群体,其平均存活率分别比全同胞近交一代群体高出4.79%、6.50%、7.88%,可以看出,随着养殖时间的延长,选育群体与全同胞近交一代群体的平均存活率差异越来越大。

表4 中国对虾选育群体、全同胞近交一代群体不同养殖阶段的平均存活率比较Table 4 Comparison of survival between selected population and first inbreeding generation of full-sibling mating population at different ages
2个群体各家系在不同养殖阶段的存活情况见表 5。由表5可以看出,2个群体内各家系的存活率在不同养殖阶段呈现出不同的变异范围,但在每个养殖阶段,选育群体存活率变异系数均小于全同胞近交一代群体;从第20天起,随着养殖时间的延长,2个群体的平均存活率变异系数也呈现逐渐增大的趋势;从整个养殖阶段看,选育群体平均存活率变异系数范围为2.01%~3.69%,近交群体平均存活率变异系数范围为3.37%~7.44%,2个群体在第80天实验结束阶段的变异系数达到最大值,分别为3.69%和7.44%。

表5 中国对虾选育群体、全同胞近交一代群体不同养殖阶段各家系存活率比较Table 5 Survivorship of selected population and first inbreeding generation of full-sibling mating population at different ages
2.3 近交衰退
全同胞近交一代群体在不同养殖阶段的生长、存活近交衰退情况见表6。如表6所示,在5个养殖阶段,全同胞近交一代群体的生长和存活性状普遍表现出一定的近交衰退。生长性状的衰退系数范围为-5%~-14.49%,其中第10天的近交衰退系数最低,为-5%,第20~80天生长性状的衰退系数相差不大,但均高于-10%,第30天的衰退系数最高,为-14.49%。存活性状的衰退系数范围为-1.78%~-7.3%,且随着养殖时间的延长,近交衰退系数逐渐增大,实验结束时存活性状的衰退系数最高,为-7.3%。全同胞近交一代群体生长性状的近交衰退系数在5个不同养殖阶段均高于存活性状,说明生长性状发生近交衰退的程度要高于存活性状。
图1反应了近交系数每增加10%所引起生长性状和存活性状产生近交衰退的情况。从图1可以看出,近交系数每增加10%所引起的近交衰退程度在不同生长阶段是不同的,在第30天,生长性状的衰退最高,可引起-5.79%的近交衰退,存活性状在第10天的衰退程度最小,可引起-0.71%的近交衰退。在相同养殖阶段,不同性状的衰退系数也不同,第80天实验结束时,近交系数每增加10%,引起-5.57%的生长性状衰退和-2.92%存活衰退。

表6 全同胞近交一代群体不同养殖阶段生长、存活性状的近交衰退情况Table 6 Inbreeding depression on growth and survival of Fenneropenaeus chinensis at different stages

图1 近交系数每增加10%所引起的生长、存活衰退情况Fig.1 Inbreeding depression of growth and survival by per 10%increase of inbreeding coefficient of F
3 讨论
由于大多水产动物都具有强的繁殖能力,产生的后代数量大,通过提高选择强度,可以在短期内实现性状的快速改良[16-18],但是对高繁殖力物种进行群体选择时,留种个体往往具有一定亲缘关系,群体内近交就不可避免[19]。由于近交降低了种群的杂合度,使群体内的加性遗传变异降低,进而增加了近交衰退的可能性[20]。关于水产动物全同胞近交引起生长性状近交衰退的研究,在鱼类方面有过报道,Cooper[21]对美洲红点鲑(Salvelinusfontinalis)全同胞兄妹交配一代的生长衰退进行了研究,结果表明,在7个月生长性状的近交衰退 为 -27.7%,在 19 个 月 达 到 -34.4%;Kincaid[22-23]报道了虹鳟(Salmogairdneri)的兄妹交配一代产生的生长性状近交衰退,在147日龄时为-11.0%,364日龄时为-23.2%;Moav[24]等研究了鲤(Cyprinuscarpio)全同胞近交群体生长性状的近交衰退情况,其相对生长率降低了15%。本研究所采用近交群体为中国对虾“黄海2号”选育群体的全同胞兄妹交配一代群体,近交系数为25%,从实验结果看,全同胞近交一代群体在不同养殖阶段均出现生长性状的近交衰退,且随着养殖时间的增加,中国对虾“黄海2号”全同胞近交一代群体产生的生长性状近交衰退系数也呈现逐渐增长趋势,生长衰退系数由第10天的-5%增长至第80天的-13.92%。从整个养殖阶段看,本实验中全同胞近交一代群体的特定生长率明显低于选育群体,特定生长率降低了6.81%。
近交也会引起水产动物存活率性状的衰退,Longwell等[25]报道了美洲牡蛎(Crassostreavirginica)全同胞交配(F=0.25)后的存活率显著降低;刘振等[26]研究了菲律宾蛤仔白斑马品系(Ruditapesphilippinarum)的全同胞家系子二代近交家系的存活率情况,各家系近交衰退明显,衰退率为-4.56%~-36.27%。本实验中国对虾,存活率在第10、20天未表现出衰退,但在第30天~第80天的养殖阶段,均表现出一定程度的近交衰退(系数范围为-1.78%~-7.3%),且随着养殖时间的延长,衰退程度呈增大趋势。全同胞近交一代群体在不同时期生长和存活的近交衰退系数并不一致,反应了群体内各家系近交衰退程度的不同,也说明近交衰退率的变化依赖于近交水平和遗传基础的变化[25]。
近交衰退的程度随着物种的不同、近交程度的差异、测量指标的特性等而产生差异[20]。对于水产物种的总体适应性性状来说,近交系数每增加10%就会引起-3%~-50%的近交衰退[27-29]。Moss等[30]研究表明,近交系数每增加10%会引起凡纳滨对虾(Litopenaeusvannamei)-2.6%~-3.9%的生长衰退;Keys等[11]报道近交系数为28%~31%的近交,近交系数每增加10%,可引起日本对虾(Penaeusjaponicus)-3.34%的生长衰退和-3.43%的存活率衰退;Gjerde等[31]对虹鳟(Oncorhynchusmykiss)近交3个世代的研究表明,近交每增加10%,仔鱼生长率降低3.0%,18个月海水中生长率降低5.1%。本研究也得到了类似结果,近交系数每增加10%可引起生长性状衰退系数范围为-2%~-5.57%,引起存活性状的衰退系数范围为-0.71%~-2.92%。生长性状和存活率性状均出现不同程度的近交衰退,在5个不同养殖阶段,近交群体生长性状的近交衰退系数均高于存活性状生长性状,说明生长性状比存活性状更容易引起近交衰退。从整个养殖阶段来看,选育群体比全同胞近交一代群体的体重高出16.18%、存活率高出7.88%,且选育群体与全同胞近交一代群体在体重、存活率指标上差异显著,说明即使对于选育多代后的育种群体,全同胞姊妹交配一代产生的近交仍会造成显著的近交衰退,所以应该在中国对虾“黄海2号”后面的育种过程中仍需尽量避免全同胞姊妹交配的发生。
在一个选育计划中,绝大多数的选择响应是来源于不同父母本群体的等位基因的定向整合,由于仅有等位基因的加性效应可以遗传给子代,所以育种群体中应保留尽可能多的加性遗传变异。通过利用个体间的加性遗传变异,选择育种可能是唯一从遗传学上提高优良野生水产物种性能的方法[32],而近交能降低群体内的加性遗传变异[33-34]。因此,在开展水产生物育种项目时,通常需要采取严格的近交控制策略,如增加有效群体的数目、增加构建家系数目以及选择合适的选育方法等手段,来保持更多的加性遗传变异,实现优良品种的选育。
[1]刘瑞玉,胡超群,曹登宫.我国对虾养殖的现状、研究进展与存在的若干问题[C].第四届世界华人虾类养殖研讨会,2004:2-10.
[2]农业部渔业局.中国渔业统计年鉴[M].北京:中国农业出版社,1988.
[3]蔡生力,黄偼,王崇明,等.1993-1994年对虾暴发病的流行病学研究[J].水产学报,1995,19(2):112-119.
[4]战文斌,俞开康,孟庆显.中国对虾(Penaeuschinensis)杆状病毒的研究[J].中国水产科学,1995,2(3):22-29.
[5]Frankham R,Gilligan D M,Morris D,et al.Inbreeding and extinction:Effects of purging[J].Conserv Genetics,2001,2:279-285.
[6]Dickerson G E.Experimental design for testing inbred lines of swine[J].J Anim Sci,1942,1:326-341.
[7]Dinkel C A,Busch D A,Minyard JA,et al.Effects of inbreeding on growth and conformation of beef cattle[J].J Anita Sci,1968,27:313-322.
[8]Terrill C E.Fifty years of progress in sheep breeding[J].J Anim Sci,1958,17:944-959.
[9]Bondari K,Dunham R A.Effects of inbreeding on economic traits of channel catfish[J].TAG Theoretical and Applied Genetics,1987,74(1):1-9.
[10]Naciri G Y,Launey S,Lebayon N,et al.Influence of parentage upon growth in Ostrea edulis:evidence for inbreeding depression[J].Genet Res,2000,76:159-168.
[11]Keys S J,Crocos P J,Burridgeb C Y,et al.Comparative growth and survival of inbred and outbredPenaeus(Marsupenaeus)japonicus,reared under controlled environment conditions:indications of inbreeding depression[J].Aquac,2004,241:151-168.
[12]张洪玉,罗坤,孔杰,等.近交对中国明对虾生长、存活及抗逆性的影响[J].中国水产科学,2009,16(5):744-750.
[13]Yang C H,Kong J,Wang Q Y,et al.Effects of inbreeding on growth and WSSV resistance of the juvenile Chinese shrimp,Fenneropenaeuschinensis[J].Journal of Fisheries of China,2007,31(2):226-234.
[14]Moss D R,Arce S M,Otoshi C A,et al.Effects of inbreeding on survival and growth of Pacific white shrimpPenaeus(Litopenaeus)vannamei[J].Aquaculture,2007,272(Sup.):30-37.
[15]Keys S J,Crocos P J,Burridge C Y,et al.Comparative growth and survival of inbred and outbredPenaeus(Marsupenaeus)japonicus,reared under controlled environment conditions:indications of inbreeding depression[J].Aquaculture,2004,241:151-168.
[16]De Donato M,Manrique R,Ramirez R,et al.Mass selection and inbreeding effects on a cultivated strain ofPenaeus(Litopenaeus)vannameiin Venezuela[J].Aquaculture,2005,247(1-4):159-167.
[17]Goyard E,Patrois J,Reignon J M,et al.Selection for better growth ofPenaeusstylirostrisin Tahiti and New Caledonia[J].Aquaculture,2002,204(3-4):461-468.
[18]李健,刘萍,何玉英,等.中国对虾快速生长新品种“黄海1号”的人工选育[J].水产学报,2005,29(1):1-5.
[19]Bentsen H B,Gjerde B.Design of fish breeding programs[C].//Charles S.Proceedings of the 5th World Congress on Genetics Applied to Livestock Production.Guelph:University of Guelph,1994:353-359.
[20]Bentsen H B,Olesen I.Designing aquaculture mass selection programs to avoid high inbreeding rates[J].Aquaculture,2002,204(3):349-359.
[21]Cooper E L.Growth of wild and hatchery strains of brook trout[J].Trans Am Fish Soc,1961,90:424-438.
[22]Kincaid H L.Effects of inbreeding on rainbow trout populations[J].Trans Am Fish Soc,1976,105(2):273-280.
[23]Kincaid H L.Inbreeding in rainbow trout(Salmogairdneri)[J].J Fish Res Board Can,1976,33(11):2420-2426.
[24]Moav R,Wohlfarth G W.Breeding schemes for the improvement of edible fish[C].Israe:Prog Rep Fish Breeding Assoc,1962:44.
[25]Longwell A C,Stiles S S.Gamete cross incompatlbility and inbreeding in the commercial Americal American oyster,CrassostreavirginicaGmelin[J].Aquaculture,1973,38(3):521-533.
[26]刘振,闫喜武,霍忠明,等.蛤仔白斑马品系的家系选择及近交效应研究[J].大连海洋大学学报,2013,28(4):355-360.
[27]Gallardo J A,Garcia X,Lhorente J P,et al.Inbreeding and inbreeding depression of female reproductive traits in two populations of coho salmon selected using BLUP predictors of breeding values[J].Aquac,2004,234:111-122.
[28]Li S,Cai W Q.Genetic improvement of the herbivorous blunt snout bream(Megalobramaamblycephala)[J].Naga,2003,26:20-23.
[29]Su G S,Liljedahl L E,Gall G A E.Effects of inbreeding on growth and reproductive traits in rainbow trout(Oncorhynchus mykiss)[J].Aquac,1996,142:139-148.
[30]Moss D R,Arce S M,Otoshi C A,et al.Effects of inbreeding on survival and growth of Pacific white shrimpPenaeus(Litopenaeus)vannamei[J].Aquac,2007,272(Sup.1):30-37.
[31]Gjerde B,Gunners K,Gjedrem T.Effect of inbreeding on survival and growth in rainbow trout[J].Aquac,1983,34:327-332.
[32]马大勇,胡红浪,孔杰.近交及其对水产养殖的影响[J].水产学报,2005,29(6):849-856.
[33]Falconer D S,Mackay T F C.An Introduction to Quantita tive Genetics[M].4th Edn.Harlow Essex:Longman,1996:480.
[34]Lynch M,Walsh B.Genetics and Analysis of Quantitative Traits[M].Sunderland:Sinauer Associates Inc Publishers,1998:980.
