龙须菜新品系ZC的生长和生理生化参数的测定及其SCAR标记的开发*
2014-12-02王津果隋正红常连鹏马金华张学成
王津果,隋正红,周 伟,常连鹏,张 淑,马金华,张学成
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
龙须菜是一种重要的产琼胶海藻,琼胶含量可达干重的20%~30%,所产琼胶量是世界琼胶总产量的53%[1-2]。龙须菜由于含有丰富的营养物质而成为人们喜爱的海洋蔬菜,也可广泛用作鲍鱼饵料[3]。龙须菜还具有生长快速、适应环境能力强等优点,并能有效地吸收N、P,防止水体富营养化,改善水质[4]。另外,我们可以在实验室内培养并完成其生活史,且可能在任何时间得到四分孢子和果孢子,龙须菜还是进行遗传学研究的理想材料[5]。
中国江蓠的栽培可以追溯到1950年代[6];1970年代中国探索出了江蓠的半人工育苗技术;1980年代龙须菜的浮筏栽培研究取得巨大成功[7],并提出了龙须菜南移栽培思路;1990年代龙须菜南移栽培示范养殖成功,栽培面积逐年提高,尤其是1998年龙须菜耐高温品种981培育成功,极大地促进了栽培业和相应产业的发展[8]。本世纪龙须菜栽培业发展更为迅速,成为中国继海带和紫菜之后的第三大海藻栽培业,栽培面积超过13 333万m2,平均年产鲜重高达10万t,产值过亿。
近年来,受海区恶劣环境的影响,龙须菜栽培过程中出现的问题日益严重,栽培品系的一些优良性状正逐步退化[9-11]。由于环境条件可加强、加速江蓠营养藻体的遗传改变,导致同一藻体形态特征和生长响应的差异,且单一的种质不能适应和满足所有海区环境及需求[12-14]。据2006年《中国渔业统计年鉴》统计,全国江蓠栽培规模已达5 266hm2,年产量达98 563t鲜品,2007年龙须菜产量相比2006年减产了5.9%,栽培面积仅为2006年的63.5%。因此种质改良与良种选育是维持龙须菜产业化发展的重要一环。孟琳等[15]以981为出发藻株,通过亚硝基胍诱变和耐羟脯氨酸筛选,选育出龙须菜新品系07-2,并对其性状进行了分析,发现其在生长速度、抗逆性以及与琼胶代谢有关的α-半乳糖苷酶活性方面均比981更具优势。
本实验室采用优势株选育的策略,结合采孢子育苗技术,于2010年10月培育出龙须菜新品系ZC,并在青岛市胶州湾养殖海区进行栽培试验。在近3年的培育期间ZC表现出优良的生产性状,如藻体颜色鲜红、长度长、分枝多、生长快速、杂藻附生少、抗逆性强等,具有推广潜力。
SCAR (Sequence Characterized Amplified Regions,序列特征化扩增区)标记被广泛应用于一些形态上难以区分而且经济价值差异较大的种和品种鉴别及种质评价[16]。由于龙须菜新品系ZC与栽培品系981、07-2在外观形态上很难区分,因此本研究通过分析981、07-2、ZC以及湛山湾野生四分孢子体的 RSAP[17](Restriction Site Amplified Polymorphism,限制性位点扩增多态性)指纹图谱,旨在筛选获得ZC的特异条带,并将其转化为稳定可靠、特异性高的SCAR标记,利用该特异标记将龙须菜新品系ZC与其他龙须菜材料区分开来,可应用于产业品系分子鉴定。
本文还在实验室条件下比较了ZC与981、07-2、湛山湾野生四分孢子体的生物量累积速率、线性生长速度及色素含量等生理生化参数,进一步证实ZC具有某些优良特性,并获得其SCAR分子标记,以期为龙须菜新品系ZC的推广应用提供科学理论依据。
1 材料与方法
1.1 材料与处理
龙须菜新品系ZC、栽培品系981与07-2于2010年10月采自青岛胶州湾养殖海区;湛山湾野生四分孢子体于2010年10月采自青岛湛山湾,将采回的野生藻株切片置于显微镜下观察,在皮层细胞中分布有呈十字形分裂的四分孢子囊的即为四分孢子体[18]。
在海水中用消毒毛刷除掉藻株表面附着的杂藻和泥砂后,无菌海水冲洗3次,置于灭菌、加Pro培养基[19]的海水中,在光强40~50μmol·m-2·s-1、光周期12L∶12D、温度23℃的培养箱中培养,每周更换1次新鲜培养基。
1.2 数量性状的测定
1.2.1 生物量累积速率的测定 参考程晓杰等[20]的方法,每个样品取1g的鲜重藻体,1 000mL三角瓶中充气培养,每3d更换1次新鲜培养基,2周后测定每个样品的鲜重;重新切回藻体鲜重1g,重复2次,取3次测量结果的平均值,单位以%/d表示。
1.2.2 线性生长速度的测量 参考程晓杰等[20]的方法,每个样品取20个长度2cm幼嫩藻尖置于培养皿中培养,每周更换新鲜培养基,2周后测定长度,将所有分枝计入总长;切回2cm长,重复2次,取平均值,单位以mm/d表示。
1.2.3 藻红蛋白(PE)含量的测定 藻株在实验室经2周培养后,参照林贞贤等[21]的提取方法和达维斯[22]的计算公式,依据测定的吸光值和公式计算出PE的含量,每个样品设3个平行,取平均值,单位以mg/g鲜重藻体表示。
1.2.4 叶绿素a(Chla)含量的测定 Chla的提取和计算公式参照Moran[23]的方法,依据测定的吸光值和公式计算出Chla的含量,每个样品设3个平行,取平均值。
1.2.5 总蛋白质含量的测定 藻株在实验室经2周培养后,滤纸吸干表面水分,称取0.2g鲜重藻,在冰上研磨,离心,考马斯亮蓝法[24]测定总蛋白含量,每个样品设3个平行,取平均值,单位用mg/g表示。
1.2.6 光合放氧和呼吸耗氧速率的测定 藻株在实验室经2周培养后,滤纸吸干表面水分,称取0.1g鲜重藻,切成小段,利用微呼吸测量系统,采用氧电极法[25]测定光合放氧和呼吸耗氧速率,每个样品设3个平行,取平均值,单位为nmol O2·g-1FW·h-1。
1.3 统计分析
实验均设置3个平行样,实验数据以平均值±标准偏差表示,用统计软件SPSS 12.0对所得数据进行方差分析和多重比较,显著性水平为P=0.05。
1.4 SCAR标记的开发与验证
1.4.1 龙须菜基因组DNA的提取 采用天根植物基因组DNA提取试剂盒(TIANGEN BIOTECH,北京)提取3个981样品,3个07-2样品,3个ZC样品及15株湛山湾野生四分孢子体共计24个龙须菜样品的基因组DNA。
1.4.2 RSAP扩增 RSAP-PCR的反应体系与条件参考杜晓华等[17]的方法并作了适当的改进。其中引物由上海生工技术有限公司合成,引物序列如表1。6个引物可分别与其它任何1个引物组合而得到15对引物,利用这15对引物对24个龙须菜样品DNA进行PCR扩增。20μL PCR反应体系中各反应物含量:2μL10×PCR buffer,30ng基因组DNA,2.5mmol·L-1MgCl2,0.15mmol·L-1dNTP,0.4μmol·L-1引物,2UTaqDNA聚合酶。PCR反应在杭州朗基96孔精品型PCR仪上进行,反应程序为:94℃预变性5min;94℃1min,35℃ 1min,72℃1min,5个循环;94℃1min,46℃1min,72℃1min,30个循环;72℃延伸5min,4℃保存。
15对引物在24个样品中进行RSAP扩增,每对引物每个样品的扩增产物分别通过6%的变性聚丙烯酰胺凝胶电泳(Polyacrylamide Gel Electrophoresis,PAGE)分离,银染后进行分析[26]。
1.4.3 ZC特异条带回收与测序 分析筛选PAGE板上出现的ZC特异条带,参照Poly-gel DNA extraction kit说明进行聚丙烯酰胺凝胶胶回收。将回收的目的片段进行量的放大,经琼脂糖凝胶电泳后,按照TaKaRa Agarose Gel DNA Purification Kit说明书进行琼脂糖凝胶回收。目的片段按照pMD 18-T Vector说明书连接,转入DH5α,经过氨苄青霉素抗性筛选,挑取单菌落以PCR反应检测分子量,克隆产物由上海生工3730测序仪进行单向测序。
1.4.4 SCAR引物的设计与验证 将去载体后序列进行同源性比对。此外,将该序列载入软件Primer Premier 5.0,在其两端设计特异引物,并送上海生工合成。参照2.3.1提取981、07-2、ZC各2株和30株湛山湾野生四分孢子体的基因组DNA,进行PCR扩增,1.5%琼脂糖凝胶电泳进行目的片段的检测。

表1 RSAP分析与SCAR验证所用的引物Table 1 Information of the primers used in RSAP analysis and SCAR verification
2 结果与分析
2.1 生物量累积速率和线性生长速度比较

图1 4种不同龙须菜之间生物量累积速率和线性生长速度比较Fig.1 Comparison of biomass accumulation and linear growth rate among 4strains of G.lemaneiformis
生物量累积速率结果比较表明,不同来源的龙须菜显示出较为明显的差异。由图1可知,栽培品系中,生物量累积速率最快的是9.50%/d的07-2,其次是8.99%/d的981,ZC则为8.80%/d,3者之间没有显著性差异;野生的最慢,仅为6.36%/d,并且显著低于3个栽培品系。
从线性生长速度来看,不同来源的龙须菜差别较大。与生物量累积速率不同,栽培品系中,ZC的线性生长速度最快,达9.89mm/d,其次为8.48mm/d的981和6.52mm/d的07-2,统计分析3个栽培品系间具有显著性差异;6.45mm/d的野生显著低于3个栽培品系。
2.2 PE和Chl a含量比较

图2 4种不同龙须菜之间藻红蛋白和叶绿素a含量比较Fig.2 Comparison of phycoerythrin and chlorophyll acontents among 4strains of G.lemaneiformis
不同材料2种光合色素含量见图2。以野生为参考标准,其PE与 Chla含量分别为3.53mg/g、1.94 mg/g,981的PE和Chla含量分别增加了7.4%和10.8%;07-2的色素含量相差幅度都较大,PE和Chla比野生高24.4%、49.0%;而ZC的PE含量比野生高9.3%,Chla则低2.6%。多重比较结果显示,ZC的PE含量显著低于07-2,与981无明显不同,但显著高于野生;ZC的Chla含量与野生没有明显不同,显著低于栽培品系981、07-2。
2.3 总蛋白质含量比较
由图3可知,4种龙须菜的总蛋白质含量呈现显著性差异。其中,ZC的总蛋白质含量最高,为7.21mg/g,显著高于野生6.99mg/g及栽培品系6.80mg/g的981与6.36mg/g的07-2。
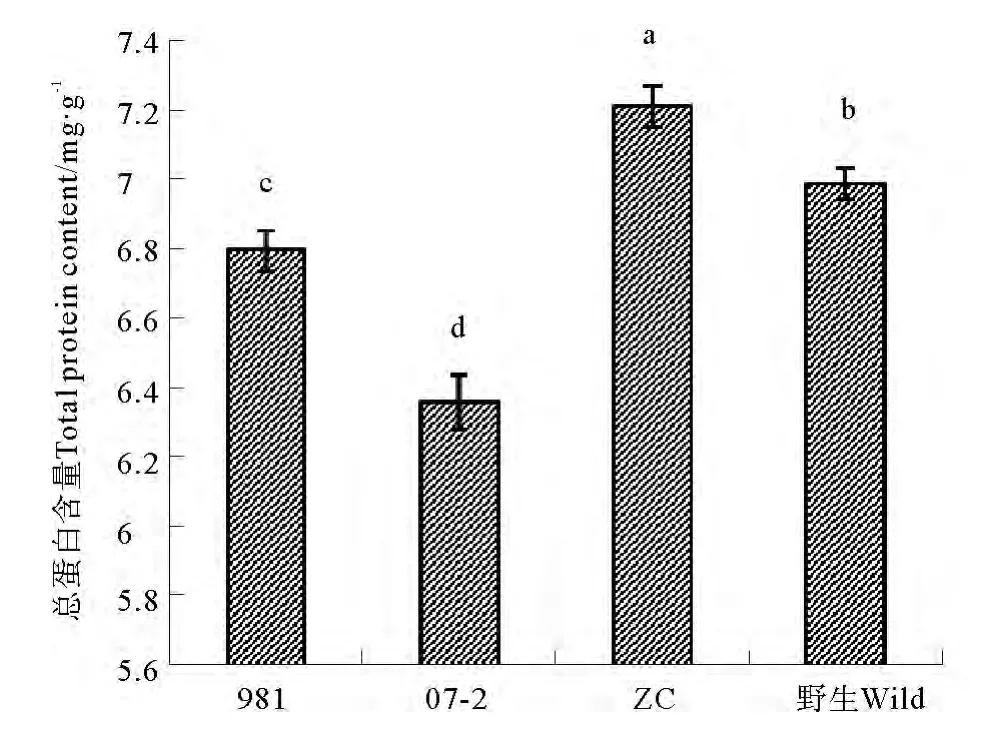
图3 4种不同龙须菜之间总蛋白质含量比较Fig.3 Comparison of total protein content among 4 strains of G.lemaneiformis
2.4 光合放氧和呼吸耗氧速率比较
由图4可知,4种龙须菜的光合放氧速率从高到低依次为ZC(20 714.0nmol O2·g-1FW·h-1)>981(20 382.5nmol O2·g-1FW·h-1)>野生(15 832.5 nmol O2·g-1FW·h-1)>07-2(13 122.7nmol O2·g-1FW·h-1);呼吸耗氧速率最高的是ZC,为4 433.0 nmol O2·g-1FW·h-1,最低的是2 482.5nmol O2·g-1FW·h-1的野生,栽培品系981与07-2介于二者之间。多重比较结果显示,4种龙须菜的光合放氧和呼吸耗氧速率并无明显不同。

图4 4种不同龙须菜之间光合放氧和呼吸耗氧速率比较Fig.4 Comparison of the rate of photosynthetic oxygen evolution and respiration oxygen consumption among 4strains of G.lemaneiformis
2.5 SCAR标记的开发与验证
2.5.1 RSAP扩增结果 24个个体、15对引物共扩增出669个位点。RSAP扩增结果的聚丙烯酰胺凝胶电泳情况见图5。

图5 龙须菜24个样品RSAP扩增结果的聚丙烯酰胺凝胶电泳图示Fig.5 RSAP amplification result of 24samples of G.lemaneiformis resolved by PAGE analysis
2.5.2 ZC特异条带的回收、测序以及SCAR引物设计与验证 将筛选得到的ZC特异条带回收测序后,得到大小为726bp的片段。在序列两端设计SCAR引物,引物信息见表1。SCAR2引物对981、07-2、ZC各2个样品和30株湛山湾野生四分孢子体共计36个龙须菜样品的基因组DNA扩增结果见图6,扩增片段大小为680bp。结果表明,特异SCAR2引物对981与ZC基因组DNA都可以扩增出预期大小的特异条带,而在07-2和湛山湾野生四分孢子体中均无扩增条带。利用之前本实验室针对981的特异条带设计的SCAR1引物(引物序列见表1)对ZC基因组DNA进行了扩增,发现在ZC中无扩增条带的出现。用SCAR1和SCAR2引物组合进行基因组DNA扩增,ZC品系具有不同于其它样品的扩增结果。结合这两对SCAR引物达到对龙须菜新品系ZC进行特异检测的目的。
3 讨论
龙须菜栽培品系981与07-2都是经过诱变处理选育而来的,具有耐高温、速生抗逆等优良性状[9,15],自被选育出来一直都是生产上的苗种来源,为龙须菜产业的迅速发展提供了坚实的基础。但是在生产实践中,随着时间的推移都逐渐出现了种质退化的迹象。本实验室通过采孢子育苗和优势株选育相结合的方法,将野生藻体释放的孢子(果孢子和四分孢子)采集到网帘上,通过水平挂养的方式养成,筛选出耐高温、速生和抗逆性强的新品系ZC,测定了其一系列数量性状,并与其他不同来源的龙须菜进行了比较研究。

图6 SCAR2引物对龙须菜新个体的验证PCR电泳图Fig.6 Agarose gel profile of G.lemaneiformis individuals amplified with the SCAR2primer
有研究表明,江蓠藻体生物量累积速率、PE含量等参数易受外界环境因素的影响,如培养的条件、所用的培养基、试验所取样品的部位等,甚至连藻体生长状况都会影响到试验的结果[27]。因此,本试验在进行生物量累积速率、线性生长速度以及色素含量等数量性状的测定与测量时,尽量保持了培养条件的一致以及取样部位的一致(如都尽量取三级分支),以确保本研究结果的准确可靠。
龙须菜优良品种的其中一个衡量参数是线性生长速度[15]。孟琳等[15]和陈伟洲[11]分 别将其 作为龙 须菜栽培品系07-2的筛选指标以及对栽培品系07-2、07-1与981进行比较的指标。本研究结果显示,ZC的线性生长速度显著地高于栽培品系981、07-2及野生个体,显示了其较好的产业开发价值。
PE位于藻胆体中,是红藻中的主要辅助色素,起到将光能转移到光合体系的反应中心转变为化学能的作用,是藻类光合作用能力的一个重要的衡量生理指标[28-31]。另外在氮元素缺乏时PE还可以作为功能性储存氮来合成其他的蛋白质[32]。Chla是所有藻类中含量最丰富和最基本的光合色素[33]。许多环境因素如光波长、金属离子与N、P浓度等都能够影响植物光合色素的含量[28,34-35]。Xu等[36]研究了不同水深处(离海水表层的距离)龙须菜的光合色素含量,随水深的增加色素含量增加,特定生长速率降低。Han等[37]认为藻类把能量用在色素的合成上,而用在生长的能量减少,从而使生长受到抑制。有研究表明,龙须菜具有三级分枝,不同分枝色素含量不同,一级分枝色素含量高于二级分枝,三级分枝色素含量最低[38]。本研究结果表明,ZC的PE含量明显低于07-2,与981无显著性差异,但Chla含量显著地低于2个栽培品系。作者在实验中也发现ZC的分支程度显著高于981、07-2,这也许是导致其测定色素含量低的原因,而多分枝性状可较好地满足产业需求。
研究表明,龙须菜蛋白质含量高,且必需氨基酸所占比例较高、种类齐全、比例也较适宜,是营养价值较高的蛋白质资源[39]。另外,蛋白质的含量在一定程度上反映了其体内色素含量和酶水平[40]。通过比较来源不同的4个四分孢子体龙须菜,ZC的总蛋白含量显著地高于2个栽培品系和野生藻株,可作为一种提供更高蛋白质来源的鲍鱼饵料使用[41]。
光合和呼吸作用是植物在生长过程中物质和能量的来源,反映了代谢水平的高低。本试验通过测定光合放氧和呼吸耗氧速率来研究龙须菜的光合和呼吸作用。藻类只能利用自由CO2和HC,并且对溶解于水中的CO2有高亲和力,对HC的亲和力较低[42],因此藻类的光合和呼吸速率易受水中无机碳含量[43-44]和pH[45]的影响。另有研究表明,江蓠属红藻的光合和呼吸速率还受到光强和光质[46]、氮和氨浓度[47-48]的影响。本研究结果显示ZC与目前的主要栽培品系981、07-2以及野生株在光合放氧和呼吸耗氧速率方面并无显著性差异,表明ZC在光合和呼吸作用方面并未与其他龙须菜材料显现出明显不同。
SCAR标记一般是由RAPD,AFLP等转化而来,一般情况下,研究者均是在筛选得到某一样品的特异条带后再进行这一工作[49]。由随机标记转化为SCAR标记,其成功的概率总体而言不是很高[50-52]。本研究中,对RSAP指纹图谱进行分析时筛选到了龙须菜新品系ZC区别于其他材料的特有条带,但是在验证时对ZC和981基因组DNA都扩增出了同样大小的条带。一方面是受电泳凝胶分辨率和引物结合位点特异性的影响;另一方面是因为在设计引物时,只设计了一对引物组合,不可避免的影响了SCAR标记转化的成功率[49]。这同时也说明了SCAR标记开发时验证试验的必要性。将此标记与之前本实验室获得的981的SCAR标记结合使用,可以实现对新品系ZC特异、稳定鉴定。
通过测定一系列的不同来源龙须菜材料的生长与生理生化参数,丰富了龙须菜数量性状的数据,同时也可以看出新品系ZC相较现有的栽培品系具备一定的栽培优势。另外,利用分子手段获得了能够鉴定ZC的、可能与其优良经济性状相关的特异性条带。通过对ZC进行的生理生化及分子的相关研究工作,为龙须菜新品系ZC的后续推广与应用工作奠定一定的基础。
[1]McHugh D J.Worldwide distribution of commercial resources of seaweeds includingGelidium[C].International Workshop onGelidium[s.1.].Springer,1991.
[2]Marinho-Soriano E.Agar polysaccharides fromGracilariaspecies(Rhodophyta,Gracilariaceae)[J].Journal of Biotechnology,2001,89(1):81-84.
[3]刘朝阳,孙晓庆.龙须菜的生物学作用及应用前景 [J].养殖与饲料,2007,5(27):55-58.
[4]Zou D H,Xia J R,Yang Y F.Photosynthetic use of exogenous inorganic carbon in the agarophyteGracilarialemaneiformis(Rhodophyta)[J].Aquaculture,2004,237(1):421-431.
[5]张学成,费修绠,王广策,等.江蓠属海藻龙须菜的基础研究与大规模栽培 [J].中国海洋大学学报:自然科学版,2009,39(5):947-954.
[6]Tseng C K.Algal biotechnology industry and research activities in China[J].Journal of Applied Phycology,2001,13(4):375-380.
[7]Li Ren-Zhi,Chong Ren-Yi,Meng Zhao-Cai.A preliminary study of raft cultivation ofGracilariaverrucosaandGracilariasjoestedtii[C].[s.1.]:Eleventh International Seaweed Symposium,1984.
[8]Fei Xiugeng and Zhang Xuecheng.A research on the transplant ofGracilarialemaneiformis[C].[s.1.]:A Presentation at 4th International Phycological Congress,1991.
[9]陈伟洲.龙须菜海水栽培技术 [J].科学养鱼,2006(12):38-39.
[10]严志洪.龙须菜南移栽培技术 [J].中国水产,2003(8):62-63.
[11]陈伟洲,徐涤,王亮根,等.两个龙须菜新品系经济性状及琼胶特性的初步研究[J].中国海洋大学学报:自然科学版,2009,39(3):437-442.
[12]Santelices B.Seaweed research and utilization in Chile:Moving into a new phase[C].Valdivia:Fifteenth International Seaweed Symposium,1996.
[13]Meneses I,Santelices B.Strain selection and genetic variation inGracilariachilensis(Gracilariales,Rhodophyta)[J].Journal of Applied Phycology,1999,11(3):241-246.
[14]Buschmann A H,Hernández-González M C,Astudiillo C,et al.Seaweed cultivation,product development and integrated aquaculture studies in Chile [J].World Aquaculture-Bation Rouge,2005,36(3):51.
[15]孟琳,徐涤,陈伟洲,等.龙须菜新品系07-2的筛选及性状分析[J].中国海洋大学学报:自然科学版,2009,39(3):94-98.
[16]Mikhailova N A,Gracheva Y A,Backeljau T,et al.A potential species-specific molecular marker suggests interspecific hybridization between sibling speciesLittorinaarcanaandL.saxatilis(Mollusca,Caenogastropoda)in natural populations[J].Genetica,2009,137(3):333-340.
[17]杜晓华,王得元,巩振辉.一种新型DNA标记技术-限制性位点扩增多态性(RSAP)的建立与优化 [J].西北农林科技大学学报:自然科学版,2006,34(9):45-49.
[18]张学成,秦松,马家海,等.海藻遗传学[M].北京:中国农业出版社,2005:239-241.
[19]Pflugmacher S,Steinberg C.Activity of phase I and phase II detoxification enzymes in aquatic macrophytes [J].Angewandte Botanik,1997,71(5-6):144-146.
[20]程晓杰,任雪莹,刘滨,等.龙须菜数量性状及AFLP分析 [J].武汉大学学报:理学版,2008,54(6):739-744.
[21]林贞贤,宫相忠,李大鹏.光照和营养盐胁迫对龙须菜生长及生化组成的影响 [J].海洋科学,2007,31(11):22-26.
[22]达维斯C J.海洋植物学 [M].厦门:厦门大学出版社,1989.
[23]Moran R.Formulae for determination of chlorophyllous pigments extracted with N,N-dimethylformamide[J].Plant Physiology,1982,69(6):1376-1381.
[24]陈毓全.生物化学实验方法和技术 [M].北京:科学出版社,2002.
[25]库姆斯J,霍尔D,朗S P,等.生物生产力和光合作用测定技术[M].北京:科学出版社,1986.
[26]丁弘叶.青岛野生种群不同倍性龙须菜AFLP遗传多样性分析以及与性别相关SCAR标记的开发与验证 [D].青岛:中国海洋大学,2011.
[27]Kursar T A,van der Meer J,Alberte R S.Light-Harvesting System of the Red AlgaGracilariatikvahiaeI.Biochemical Analyses of Pigment Mutations[J].Plant Physiology,1983,73(2):353-360.
[28]Xia J R,Li Y J,Lu J,et al.Effects of copper and cadmium on growth,Photosynthesis,and pigment content inGracilarialemaneiformis[J].Bulletin of Environmental Contamination and Toxicology,2004,73(6):979-986.
[29]Rodrigo M,Robaina R R.Stress tolerance of photosynthesis in sporelings of the red algaGrateloupiadoryphoracompared to that of Stage III thalli[J].Marine Biology,1997,128(4):689-694.
[30]颜昌宙,曾阿妍,金相灿,等.不同浓度氨氮对轮叶黑藻的生理影响[J].生态学报,2007,27(1):1050-1059.
[31]Korbee N,Figueroa F L,Aguilera J.Effect of light quality on the accumulation of photosynthetic pigments,proteins and mycosporine-like amino acids in the red algaPorphyraleucosticta(Bangiales,Rhodophyta)[J].Journal of Photochemistry and Photobiology B:Biology,2005,80(2):71-78.
[32]Ryder E,Nelson S G,McKeon C,et al.Effect of water motion on the cultivation of the economic seaweedGracilariaparvispora(Rhodophyta)on Molokai,Hawaii[J].Aquaculture,2004,238(1):207-219.
[33]郭翠,陈伟洲,曹会彬,等.不同龙须菜品系在高温胁迫下的生理响应比较 [J].南方水产科学,2011,7(3):14-19.
[34]Gao K S,Xu J T.Effects of solar UV radiation on diurnal photosynthetic performance and growth ofGracilarialemaneiformis(Rhodophyta)[J].European Journal of Phycology,2008,43(3):297-307.
[35]Yu J,Yang Y F.Physiological and biochemical response of seaweedGracilarialemaneiformisto concentration changes of N and P[J].Journal of Experimental Marine Biology and Ecology,2008,367(2):142-148.
[36]Juntian Xu,Kunshan Gao.Growth,pigments,UV-absorbing compounds and agar yield of the economic red seaweedGracilaria lemaneiformis(Rhodophyta)grown at different depths in the coastal waters of the South China Sea [J].Journal of Applied Phycology,2007,20(5):681-686.
[37]Han T J,Kang S H,Park J S,et al.Physiological responses ofUlvapertusaandU.armoricanato copper exposure[J].Aquatic Toxicology,2008,86(2):176-184.
[38]Wang Zhiyuan,Wang Guangce,Niu Jianfeng,et al.Optimization of conditions for tetraspore release and assessment of photosynthetic activities for different generation branches ofGracilaria lemaneiformisBory[J].Chinese Journal of Oceanology and Limnology,2010,28(4):738-748.
[39]余杰,王欣,陈美珍,等.潮汕沿海龙须菜的营养成分和多糖组成分析 [J].食品科学,2006,27(1):93-97.
[40]刘静雯,董双林.光照和温度对细基江蓠繁枝变型的生长及生化组成影响 [J].青岛海洋大学学报:自然科学版,2001,31(3):332-338.
[41]周峙苗,何清,马晓宇.东海红藻龙须菜的营养成分分析及评价[J].食品科学,2010,31(9):284-288.
[42]Dromgoole,F I.The effects of pH and inorganic carbon on photosynthesis and dark respiration ofCarpophyllum(Fucales,phaeophyceae)[J].Aquatic Botany,1978,4:11-22.
[43]Gao K,Aruga Y,Asada K,et al.Influence of enhanced CO2on growth and photosynthesis of the red algaeGracilariasp.andG.chilensis[J].Journal of Applied Phycology,1993,5(6):563-571.
[44]García-Sánchez M J,Fernández J A,Niell X.Effect of inorganic carbon supply on the photosynthetic physiology ofGracilariatenuistipitata[J].Planta,1994,194(1):55-61.
[45]Menéndez M,Martínez M,Comín F A.A comparative study of the effect of pH and inorganic carbon resources on the photosynthesis of three floating macroalgae species of a Mediterranean coastal lagoon[J].Journal of Experimental Marine Biology and Ecology,2001,256(1):123-136.
[46]Beer S,Levy I.Effects of photon fluence rate and light spectrum composition on growth,photosynthesis and pigment relations inGracilariasp.[J].Journal of Phycology,1983,19(4):516-522.
[47]García-Sánchez M J,Fernández J A,Niell F X.Biochemical and physiological responses ofGracilariatenuistipitatauuder two different nitrogen treatments[J].Physiologia Plantarum,1993,88(4):631-637.
[48]Dawes C J,Chen C P,Jewett-Smith J,et al.Effect of phosphate and ammonium levels on photosynthetic and respiratory responses of the red algaGracilariaverrucosa[J].Marine Biology,1984,78(3):325-328.
[49]李效尊,袁晓君,蒋苏,等.黄瓜序列特征性扩增区域标记(SCAR)的开发 [J].分子植物育种,2007,5(3):393-402.
[50]Paran I,Michelmore R W.Development of reliable PCR-based markers linked to downy mildew resistance genes in lettuce[J].Theoretical and Applied Genetics,1993,85(8):985-993.
[51]Horejsi T,Box J M,Staub J E.Efficiency of randomly amplified polymorphic DNA to sequence characterized amplified region marker conversion and their comparative polymerase chain reaction sensitivity in cucumber[J].Journal of the American Society for Horticultural Science,1999,124(2):128-135.
[52]Robbins M D.Molecular Marker Development,QTL Pyramiding,and Comparative Analysis of Phenotypic and Marker-Assisted Selection in Cucumber[M].Madison:University of Wisconsin,2006.
