自噬在心肌衰老中作用的研究进展
2014-11-28许金枝洪荣华谭玉珍
许金枝,洪荣华,谭玉珍
(复旦大学 上海医学院 1.临床医学系;2.基础医学院 人体解剖与组织胚胎学系,上海 200032)
短篇综述
自噬在心肌衰老中作用的研究进展
许金枝1,洪荣华1,谭玉珍2*
(复旦大学 上海医学院 1.临床医学系;2.基础医学院 人体解剖与组织胚胎学系,上海 200032)
在心肌衰老过程中,自噬对于维持心肌细胞存活起着关键性作用。通过调节心肌细胞自噬有助于细胞清除受损线粒体和有害代谢产物,从而缓解细胞的氧化应激,维持心肌细胞存活和减少细胞凋亡,故激活自噬可能成为延缓心肌衰老的有效途径。
心肌细胞;衰老;自噬
自噬与人类的疾病和健康关系密切,不仅参与细胞的增殖、分化、代谢及凋亡等正常生理过程,还参与人体诸多疾病,如肿瘤、神经系统退行性疾病、糖尿病和心血管疾病等的发生发展过程[1- 3]。近年来研究表明,自噬与心肌衰老同样有着密不可分的联系,通过干预自噬来延缓心肌衰老将成为一个诱人的研究方向。
1 心肌衰老的形态与功能变化及其影响因素
1.1 心肌衰老的形态结构及其功能改变
衰老的心脏呈现以胶原含量增多为特点的左心室纤维化以及心室壁的增厚,并伴有心肌细胞数目的减少。在小鼠心肌衰老模型[4]的研究中发现,衰老的心肌细胞内多数线粒体肿胀变圆,并伴有线粒体氧化蛋白积累和线粒体DNA突变增加。衰老可直接影响在心脏内起重要作用的多种离子通道、受体、酶和信号分子的表达和功能[5- 6]。例如,随着年龄增长,对ATP敏感的钾离子通道的表达和功能下降可影响心肌细胞的生物电活动,从而影响兴奋-收缩偶联,使衰老的心脏收缩力下降、博出量减少、心力储备下降及心肌顺应性降低。
1.2 心肌衰老的影响因素及其机制
目前的研究表明,心肌衰老可能与肌球蛋白重链同功酶改变、闰盘结构改变及线粒体损伤等有关,但其中最具说服力的是与线粒体损伤有关的机制。在心肌细胞中,线粒体约占心肌细胞总容积的30%,并提供心肌所需的90%以上的能量[7],不仅如此,线粒体还是活性氧(reactive oxygen species,ROS)和自由基的主要来源,而ROS和自由基是介导衰老相关细胞损伤的主要物质,因而线粒体被认为是介导心肌细胞衰老的关键细胞器[8]。ROS是线粒体氧化磷酸化过程中电子转移时的副产物,正常情况下可作为影响细胞内信号传导级联反应的第二信使分子,调控基因的表达。但随着ROS的不断产生,大量的ROS亦可直接氧化脂质、蛋白质和线粒体DNA等,造成线粒体氧化损伤。此外,ROS可使线粒体内外膜交接处的线粒体通透性转换孔(mitochondrial permeablity transition pore,mPTP)开放,mPTP开放可引起细胞色素C和凋亡诱导因子释放,引起caspase活化,触发细胞凋亡。再加上损伤的线粒体DNA其修复能力有限,随着时间进展,累积的线粒体DNA突变导致电子传递链的不正常表达,于是线粒体产生ATP的能力下降而产生大量的ROS,随后出现线粒体损伤加重与ROS产生增多的恶性循环,最终导致心肌细胞死亡[9- 10]。
2 自噬的发生过程及其调节途径
2.1 自噬的概述
自噬是以细胞质空泡为特征的溶酶体依赖性的降解过程,按照被降解物进入溶酶体方式的不同,可将自噬分为3类:巨自噬(macroautophagy)、微自噬(microautophagy)和分子伴侣介导的自噬(chaperon-mediated autophagy,CMA)[11- 12]。巨自噬是细胞最主要的自噬形式,以下所述的自噬均为巨自噬。
2.2 自噬的调节途径
哺乳动物的自噬调节途径可分为两类,即依赖mTOR途径和非依赖mTOR途径。在此,我们将重点叙述依赖mTOR的自噬调节途径[13- 14]。
mTOR(mammalian Target of Rapamycin)是一种丝氨酸/苏氨酸蛋白激酶,是自噬调节的关键中间物质,主要作用于自噬的诱导环节。mTOR复合物有两种功能类型,即mTORC1和mTORC2。
2.2.1 mTORC1对自噬的调节:mTORC1对雷帕霉素敏感,其组成包含mTOR催化亚单位、mTOR调节相关蛋白 (regulatory associated protein of mTOR,raptor)、GβL、分子质量为40 ku 的富含脯氨酸的Akt底物 (proline-rich Akt substrate of 40 ku,PRAS40)及含有DEP 结构域的mTOR 相关蛋白(DEP domain-containing mTOR-interacting protein,Deptor)。在营养充足、某些激素如胰岛素刺激和能量供应充足等条件下,mTORC1被激活并磷酸化ULK1/2复合物,ULK1/2复合物与Atg13、FIP2OO(focal adhesion kinase family interacting protein of 200 ku)和Atg101结合形成一个更大的复合物,定位于自噬前体膜上,从而抑制ULK1/2复合物的激酶活性,进而抑制自噬;而在饥饿、应激和雷帕霉素作用等条件下,mTORC1的激酶活性被抑制,故对ULK1/2复合物的磷酸化作用被解除,导致ULK1/2复合物的激酶活性增强,ULK1/2复合物发生自身磷酸化并磷酸化Atg13和FIP200,最终导致自噬增强 (图1)。
2.2.2 mTORC2对自噬的调节:mTORC2对雷帕霉素不敏感,它通过磷酸化Akt的第473位丝氨酸残基而调节自噬。磷酸化后的Akt下调转录因子FoxO3的转录功能,FoxO3对自噬相关基因的转录减少,导致自噬功能下调。
3 自噬对心肌衰老的调节作用
3.1 心肌衰老过程中的自噬功能变化
在心肌细胞衰老模型的研究中发现,心肌细胞自噬功能下调,这可能与承载脂褐素的次级溶酶体无法与自噬体融合形成自噬溶酶体有关[15]。脂褐素是脂质和蛋白质残基经过过氧化作用形成的不可降解的棕黄色色素,随衰老在心肌细胞中呈进行性堆积。交叉连接的多聚脂褐素无法被溶酶体酶降解而且可能导致溶酶体酶优先分配到承载脂褐素的溶酶体内,从而减少了自噬溶酶体的形成。此外,在衰老过程中伴随的激素水平和葡萄糖代谢的改变对自噬功能下调也有一定的作用。例如,衰老时内皮素-1(endothelin-1,ET-1)水平升高,ET-1可引起自噬下调,进而引起心肌肥大[16]。
3.2 通过激活自噬调节心肌衰老
大量研究表明,激活自噬可延缓心肌衰老而抑制自噬则促进心肌衰老, 如何通过激活自噬来延缓心肌衰老成为当前的研究热点。长期的热量限制可明显改善衰老心肌的舒张功能,热量限制的抗老化作用亦可能是通过上调自噬而实现的[17]。在哺乳动物细胞中,ATP水平的下降可被AMP依赖的蛋白激酶(AMP-dependent protein kinase,AMPK)感知,ATP/AMP比值的下降通过上游的LKB1激酶激活AMPK,激活的AMPK磷酸化并活化TSC1/2复合物,活化后的TSC1/2复合物通过Rheb抑制mTORC1的活性,增强自噬。激活的AMPK还可以独立于TSC2,通过磷酸化raptor的第863位丝氨酸残基抑制mTORC1活性,同样增强自噬。在糖尿病小鼠模型的研究中发现,将小鼠H9c2心肌母细胞株置于高葡萄糖环境可降低AMPK的活性,抑制JNK1与Bcl-2间的信号传导,促进Bcl-2与Beclin-1的结合,进而抑制与自噬体形成和成熟相关的Beclin-1:hVps34(PI3K):Atg14复合物的活性,从而下调自噬;反之,二甲双胍(metformin)可激活AMPK,激活的AMPK直接磷酸化JNK1,JNK1被激活并磷酸化Bcl-2,导致Bcl-2与Beclin-1分离,Bcl-2对Beclin-1:hVps34:Atg14复合物的抑制作用减弱,从而增强心肌细胞自噬,减少由高葡萄糖环境引起的心肌细胞凋亡[18- 19]。以上研究结果显示,AMPK至少通过3条不同的途径来调节心肌自噬。与心肌衰老中自噬调节相关的还有Insulin/IGF-1信号传导途径,生长激素缺陷的小鼠和IGF-1受体变异的小鼠两者都显示有寿命延长的现象[20]。
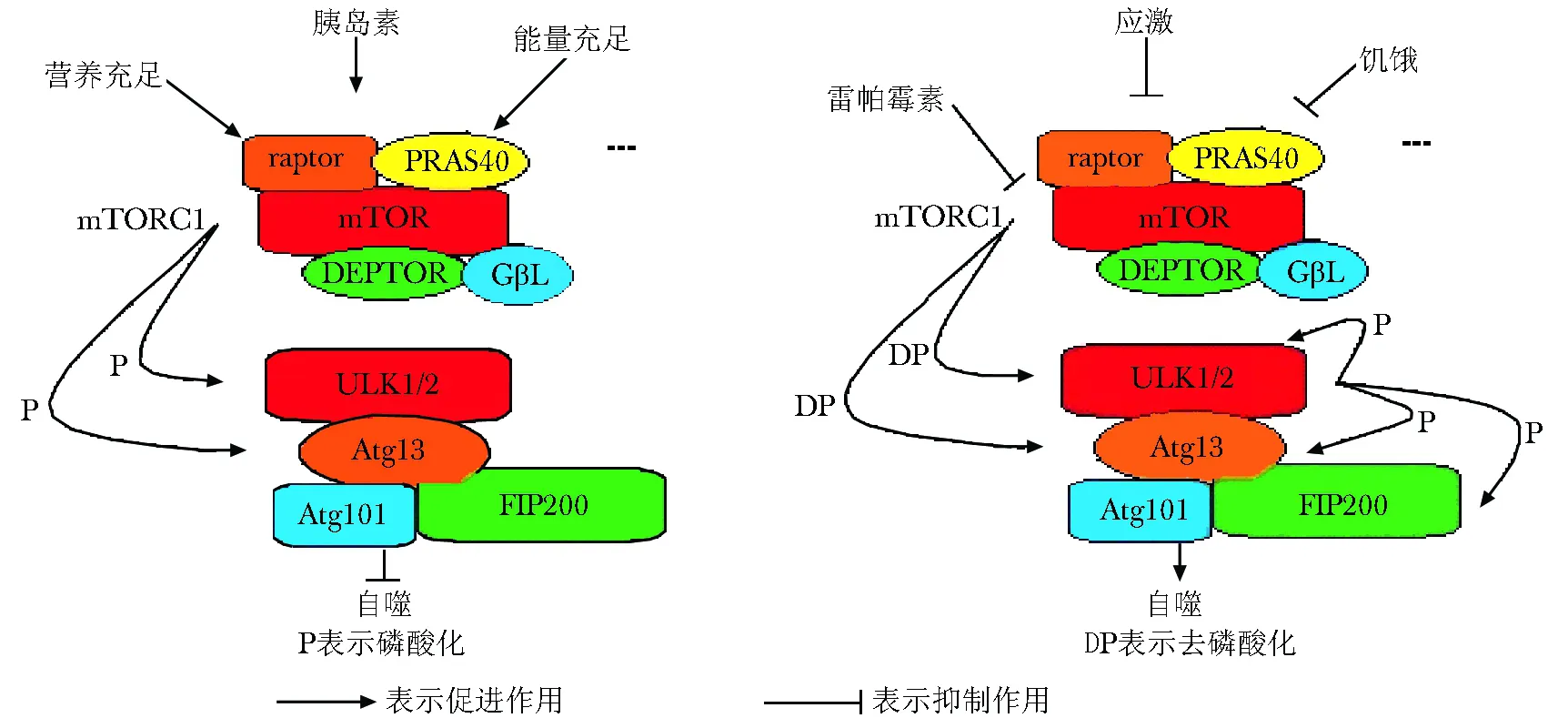
图1 mTORC1调节自噬的信号途径Fig 1 The signaling pathway of autophagy regulated by mTORC1
值得注意的是,激活自噬对心肌细胞的存活具有双重作用,既可通过清除受损细胞成分来维持细胞稳态,起到保护作用,也可能过度降解必需细胞成分导致细胞死亡[21]。
4 总结与展望
基于以上心肌衰老的主要机制和自噬对心肌衰老的影响,有两条基本思路来延缓心肌衰老:1) 使用线粒体抗氧化剂,以中和能量代谢产生的ROS和自由基,减少细胞成分的氧化损伤,延缓心肌衰老;2) 适当增强心肌细胞的自噬作用(如热量限制、内皮素受体基因敲除及自噬促进药物的使用等),以清除衰老受损线粒体及蓄积的有害代谢产物,缓解细胞的氧化应激,延缓心肌衰老。不过两条基本思路只是提供了可能的研究方向,在具体实施过程中,还应考虑实际的功效及可能产生的不良反应。安全、有效的延缓心肌衰老的临床治疗方案的实现,虽然还有待进一步的研究,但在将来有望成为广大心血管疾病患者的福音。
[1] Choi AMK, Ryter SW, Levine B. Autophagy in human health and disease[J]. New Engl J Med, 2013, 368:651- 662.
[2] Wen X, Wu J, Wang F,etal. Deconvoluting the role of reactive oxygen species and autophagy in human diseases[J]. Free Radi Biol Medi, 2013, 65: 402- 410.
[3] Wang HJ, Zhang D, Tan YZ,etal. Autophagy in endothelial progenitor cells is cytoprotective in hypoxic conditions[J]. Am J Physiol Cell Physiol, 2013, 304: c617- 626.
[4] Gottlieb RA, Gustafsson ÅB. Mitochondrial turnover in the heart[J]. Cell Res, 2011, 1813: 1295- 1301.
[5] Liu M, Zhang P, Chen M,etal. Aging might increase myocardial ischemia/reperfusion-induced apoptosis in humans and rats[J]. Age Aging, 2012, 34: 621- 632.
[6] Chaudhary KR, El-Sikhry H, Seubert JM. Mitochondria and the aging heart[J]. J Geriatr Cardiol, 2011, 8: 159- 167.
[7] Zhou TJ, Gao Y. Molecular mechanisms of cardiac aging[J]. J Geriatr Cardiol, 2010, 7: 184- 188.
[8] Ussher JR, Lopaschuk GD. The malonyl CoA axis as a potential target for treating ischaemic heart disease[J]. Cardiovasc Res, 2008, 79: 259- 268.
[9] Dutta D, Calvani R, Bernabei R,etal. Contribution of Impaired Mitochondrial Autophagy to Cardiac Aging Mechanisms and Therapeutic Opportunities[J]. Circ Res, 2012, 110: 1125- 1138.
[10] Scherz-Shouval R, Elazar Z. Regulation of autophagy by ROS: physiology and pathology[J]. Trends Biochem Sci, 2011, 36: 30- 38.
[11] Zhou J, Tan SH, Nicolas V,etal. Activation of lysosomal function in the course of autophagy via mTORC1 suppression and autophagosome-lysosome fusion[J]. Cell Res, 2013, 23: 508- 523.
[12]王海杰,谭玉珍.细胞自噬的形态学特征和功能意义[J].解剖学报,2009,40:844- 849.
[13] Fader CM .Colombo MI.Autophagy and multivesicular bodies:two closely related partners[J].Cell Death Differ, 2009,16:70- 78.
[14] Jung CH, Ro SH, Cao J,etal. mTOR regulation of autophagy[J]. FEBS Lett, 2010, 584: 1287- 1295.
[15] He C, Klionsky DJ. Regulation mechanisms and signaling pathways of autophagy[J]. Annu Rev Genet, 2009, 43: 67- 93.
[16] Ceylan-IsikAF, DongM, Zhang Y,etal. Cardiomyocyte-specific deletion of endothelin receptor A rescues aging-associated cardiac hypertrophy and contractile dysfunction: role of autophagy[J]. Basic Res Cardiol, 2013,108:335- 354.
[17] AhmetI, TaeHJ, deCabo R,etal. Effects of calorie restriction on cardioprotection and cardiovascular health[J] J Mol Cell Cardiol, 2011,51:263- 271.
[18] Shinmura K, Tamaki K, Sano M,etal. Impact of long-term caloric restriction on cardiac senescence: caloric restriction ameliorates cardiac diastolic dysfunction associated with aging[J]. J Mol Cell Cardiol, 2011, 50:117- 127.
[19] He CY, Zhu HP, Li HL,etal. Dissociation of Bcl-2-Beclin1 Complex by activated AMPK enhances cardiac autophagy and protects against cardiomyocyte apoptosis in diabetes[J]. Diabetes, 2013, 62:1270- 1281.
[20] Rodrigo T, Jose MV, Valentina P,etal.Energy-preserving effects of IGF-1 antagonize starvation-induced cardiac autophagy[J]. Cardiovasc Res, 2012, 93: 320- 329.
[21] Yonekawa T, Thorburn A. Autophagy and cell death[J]. Essays Biochem, 2013, 55: 105- 117.
Research progress of autophagy in cardiomyocyte aging
XU Jin-zhi1, HONG Rong-hua1, TAN Yu-zhen2*
(1.Dept. of Clinical Medicine; 2.Dept. of Anatomy, Histology and Embryology, Shanghai Medical College ofFudan University, Shanghai 200032, China)
Autophagy plays an important role in sustaining the survival of cardiomyocytes during aging process. Regulating autophagy contributes to the elimination of impaired mitochondria and other harmful metabolites within cardiomyocytes, which relieves oxidative stress,sustains the survival of cardiomyocytes and reduces cell apoptosis. Activation of autophagy may serve as an effective way for rescuring cardiomyocyte aging.
cardiomyocyte; aging; autophagy
2013- 10- 12
2013- 12- 23
国家自然科学基金(30971674,81270200);国家基础科学人才培养基金(J1210041);高等学校博士学科点专项科研基金(20130071110079)
*通信作者(correspondingauthor): yztan@shmu.edu.cn
1001-6325(2014)08-1121-04
R 322.1+1
A
