高海拔COPD大鼠血浆TNF-α、IL-6和IL-10水平升高
2014-11-28崔金霞张永东时莹庆冯喜英
崔金霞,张永东,时莹庆,冯喜英,王 晋,关 巍*
(1.青海大学 附属医院 呼吸科, 青海 西宁 810001;2.中国人民武装警察部队指挥学院 门诊部, 天津 230025;3.武警青海总队医院 军诊科, 青海 西宁 810000)
高海拔COPD大鼠血浆TNF-α、IL-6和IL-10水平升高
崔金霞1,张永东2,时莹庆1,冯喜英1,王 晋3,关 巍1*
(1.青海大学 附属医院 呼吸科, 青海 西宁 810001;2.中国人民武装警察部队指挥学院 门诊部, 天津 230025;3.武警青海总队医院 军诊科, 青海 西宁 810000)
I高原对慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)的影响目前研究较少且结果不一。海拔每升高95 m,COPD的病死率增加1/105[1],而另有报道海拔与COPD患病率之间呈负相关[2]。
高原对COPD的影响究竟如何?是保护作用还是损害作用,尚无定论。通过建立不同海拔COPD大鼠模型,测定血浆TNF-α、IL-6和IL-10的水平,希望了解不同海拔下COPD大鼠全身炎性反应的差异。
1 材料与方法
1.1 研究对象及分组:清洁级雄性SD大鼠40只,体质量143±7 g,鼠龄6周,[兰州大学动物实验室,合格证号:SCXK(甘)2011-0001],购买当日运回青海西宁。将40只大鼠随机分为中海拔对照组和COPD组(西宁,海拔2260 m)、高海拔对照组和COPD组(海拔5500 m),每组10只。高海拔组饲养于青海省高原医学研究中心低压氧舱(压力:398 mmHg,氧分压:42 mmHg,温度:17 ℃~24 ℃,湿度:37%~51%),每日开舱2 h打扫、清洁、喂食及注射药物。共饲养28 d。
1.2 COPD模型的建立:以文献[3]方法并进行改进制作香烟提取物(cigarette extract smoke,CSE)及制作COPD动物模型。
于第1、8、15和22天17∶00—19∶00对中海拔及高海拔对照组大鼠腹腔注射0.8 mL 0.9%氯化钠注射液,给中海拔及高海拔COPD组大鼠腹腔注射0.8 mL CSE溶液。
1.3 标本采集及储存:于实验第29天及第30天两次处理动物。腹腔注射25%乌拉坦(0.8 mL/kg)麻醉,腹腔注射肝素钠(150 U/100 g)肝素化。抽取腹主动脉血液置于乙二胺四乙酸管中,以3 000 r/min离心10 min,血浆置于-80 ℃冰箱保存。
左心房及右心房各开1 cm左右小口,自右房开口以20 cm H2O压力以10 mL/min的速度滴注0.9%氯化钠注射液,肺叶变白后停止冲洗,4%甲醛灌洗双肺组织,至肺叶变硬、肺缘锐利停止滴入,结扎左右气管开口,左肺组织置入4%甲醛溶液的避光盒中,用于苏木素-伊红(HE)染色。
1.4 制作大鼠肺组织病理切片及形态观察:将之前包埋于4%甲醛中已48 h的左肺组织经过取材、固定、脱水、浸蜡包埋、切片与摊片、脱蜡染色、脱水透明及封片,待树胶略干后,贴上编号,待读片。
1.5 测定血浆TNF-α、IL-6和IL-10的水平:用ELISA法,严格按说明书进行测定。试剂盒购自武汉优尔生科技股份有限公司。
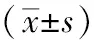
2 结果
2.1 大鼠肺组织的病理变化:28 d后2组COPD组均出现肺实质破坏、肺泡壁变薄、部分肺泡破裂和肺泡腔扩大,成功建立COPD模型(图1)。
2.2 各组之间血浆TNF-α、IL-6及IL-10水平变化:TNF-α和IL-6水平:高海拔对照组高于中海拔对照组(P<0.05),高海拔COPD组高于中海拔COPD组(P<0.05),中海拔COPD组高于中海拔对照组(P<0.05),高海拔COPD组高于高海拔对照组(P<0.05)(表1)。
IL-10水平:高海拔对照组IL-10高于中海拔对照组(P<0.01)。
3 讨论
高原环境低压、低氧,本研究显示,高海拔对照组血浆TNF-α和IL-6水平高于中海拔对照组,表明低氧促进了TNF-α和IL-6的分泌。低氧时增加NF-κB的活化程度,巨噬细胞内信号传导通路活性增加,导致TNF-α和IL-6分泌增加;低氧诱导因子-1α可调节低氧的肥大细胞产生TNF-α、IL-6和IL-8等炎性介质,并能使激活的巨噬细胞释放TNF-α。
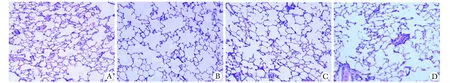
A.mild altitude control; B.mild altitude COPD; C.high altitude control; D.high altitude COPD图1 肺组织病理Fig 1 Pulmonary pathology(×40)

groupTNF⁃αIL⁃6 IL⁃10mildaltitudecontrols146±35400±248101±12mildaltitudeCOPD383±70∗1373±276∗104±12highaltitudecontrols395±53∗1215±320∗103±08∗highaltitudeCOPD449±44∗△▲1464±387∗△▲109±09∗
*P<0.05 compare with mild altitude controls;△P<0.05 compare with high altitude controls;▲P<0.05 compare with mild altitude COPD group.
IL-6、IL-10及TNF-α相互作用并参与肺部炎性反应及COPD病理变化[4]。本研究显示,中海拔COPD组血浆TNF-α和IL-6水平高于中海拔对照组,高海拔COPD组TNF-α和IL-6水平高于高海拔对照组,高海拔COPD组TNF-α和IL-6水平高于中海拔COPD组。说明COPD大鼠全身炎性反应随海拔的升高而增加,表明低氧加剧了COPD大鼠的全身炎性反应。
目前许多研究认为,COPD患者肺和血中IL-10绝对和相对分泌不足有可能是COPD发病的一个易感或易患因素。
本研究显示,高海拔对照组IL-10高于中海拔对照组,但高海拔COPD组与中海拔COPD组无显著差异。表明在健康大鼠IL-10随海拔增加分泌增加,可起到抑制炎性反应的作用,但在COPD各组却无增加,抑制炎性反应的作用可能受到影响。
综上所述,高原低氧加重了COPD大鼠全身炎性反应,海拔越高,COPD的全身炎性反应越重。
[1] Coté TR, Stroup DF, Dwyer DM,etalChronic obstructive pulmonary disease mortality. A role for altitude [J].Chest, 1993, 103:1194- 1197.
[2] Laniado-Laborin R, Rendón A, Batiz F,etalHigh altitude and chronic obstructive pulmonary disease prevalence: a casual or causal correlation? [J]. Arch Bronco neumol, 2012, 48:156- 160.
[3] Chen Yan, Hanaoka M, Chen Ping,etalProtective effect of beraprost sodium, a stable prostacyclin analog, in the development of cigarette smoke extract-induced emphysema [J]. Am J Physiol Lung Cell Mol Physiol, 2009, 296: 648- 656.
[4] Lee J, Taneja V, Vassallo R.Cigarette Smoking and Inflammation: Cellular and Molecular Mechanisms [J]. J Dent Res,2012, 91:142- 149.
2014- 01- 14
2014- 03- 24
*通信作者(correspondingauthor):weiguan110@163.com
1001-6325(2014)08-1108-02
R 563.3
A
