Ubc9对鸡胚神经嵴细胞发育的影响
2014-11-28李明洋刘乙蒙李淑玲栾治东
李明洋,刘乙蒙,刘 超,李淑玲,栾治东*
(辽宁医学院 基础医学院 1.发育生物学教研室;2.组胚教研室;3.生物化学教研室, 辽宁 锦州 121000)
研究论文
Ubc9对鸡胚神经嵴细胞发育的影响
李明洋1,刘乙蒙3,刘 超1,李淑玲2,栾治东1*
(辽宁医学院 基础医学院 1.发育生物学教研室;2.组胚教研室;3.生物化学教研室, 辽宁 锦州 121000)
目的探索Ubc9和SUMO通路对鸡胚神经嵴细胞发育的影响。方法1)采集鸡胚,通过免疫荧光实验和原位杂交实验来检测SUMO结合酶Ubc9及神经嵴细胞标志基因的表达情况。2)设置对照组(非特异性吗啉代处理)和Ubc9-吗啉代组来处理各组8期鸡胚,随后通过原位杂交实验检测Snail2,Sox9和FoxD3等神经嵴细胞晚期标志基因的表达情况。结果1)Ubc9与标志基因Pax7共表达于4、6和8期鸡胚神经嵴细胞前体。2)与对照组相比,Ubc9-吗啉代组鸡胚单侧上Snail2(P<0.05),Sox9(P<0.01)和FoxD3(P<0.05)的mRNA水平均有下降。结论Ubc9表达于4、6和8期鸡胚的神经脊细胞前体,鸡胚神经嵴细胞的形成需要SUMO通路参与。
鸡胚;神经嵴细胞;Ubc9;SUMO通路
神经嵴细胞(neural crest cell, NCC)起源于脊椎动物背部神经管,为多潜能的干细胞并具有高度迁移性,能够分化产生多种组织,包括头部的大部分骨骼和肌肉、 外周神经系统的神经元和胶质细胞及皮肤黑色素细胞等[1]。NCC发育异常会导致缺陷病。研究表明,许多蛋白参与NCC形成和迁移,如NCC早期标志基因Pax7[2]以及晚期调控因子如Snail2、Sox9和FoxD3[3]等。
小泛素相关修饰蛋白(small ubiquitin-related modifier,SUMO)化是一种广泛存在的蛋白质翻译后修饰形式[4],参与核质转运,细胞周期调控,信号传导和转录活性调控等[5]。本研究将观察SUMO化中唯一的E2结合酶-Ubc9[6]在早期鸡胚中的表达情况,随后检测Ubc9敲除后鸡胚的NCC晚期标志基因的表达水平,探索SUMO通路对鸡胚NCC发育的影响。
1 材料与方法
1.1 试剂
受精鸡蛋(辽宁医学院动物实验中心);吗啉代 (Gene Tools);抗体:anti-DIG, anti-rabbit alexa fluor 448(invtrogen)。
1.2 鸡胚的制备
受精鸡蛋于37 ℃孵育箱中孵育到4(18 h)、6(24 h)和8(28 h)期[7]。用无菌注射器抽取部分蛋清后敲开蛋壳,滤纸覆盖鸡胚,再沿滤纸边剪下鸡胚,于4%多聚甲醛中固定2 h。
1.3 原位杂交
鸡胚先经4%多聚甲醛固定,然后经过梯度浓度的甲醛处理,再用100%甲醇洗两次。65 ℃预杂交1 h,80 ℃预热探针5 min,再65 ℃孵育过夜,用含有2% 勃林格试剂(Boehringer)和灭活的胎牛血清的三羟甲基氨基甲烷-盐酸缓冲液室温封闭2 h,anti-DIG经1∶1 000稀释,4 ℃摇床过夜,碱性磷酸酶显色[8]。
1.4 免疫荧光及成像
免疫荧光实验按照标准步骤[9]。简要概括,将胚胎固定在4 %多聚甲醛中,用磷酸盐缓冲液 (含有2 g/L牛血清白蛋白,0.1% Tween)润洗(3×60 min)。一抗孵育,4 ℃过夜。特异性荧光二抗经1∶2 000稀释,显色。用Nikon体视显微镜(Spot SE镜头和Nikon Eclipse 80i显微镜的软件)成像。
1.5 电穿孔法敲除Ubc9
将吗啉代(Mo)置于3%蔗糖溶液使其浓度为0.48 μmol/L,添加1 μg DNA (pCIG)作为载体和提供绿荧光,单侧电穿孔法[10]转染入固定在滤纸环中的4期鸡胚。鸡胚孵育[11]过夜,随后用于原位杂交和免疫荧光分析。
1.6 统计学分析
所得实验数据采用四格表的Fisher确切概率法分析,统计学处理由SPSS 17.0统计软件完成。
2 结果
2.1 Ubc9在不同发育时期鸡胚的表达
4~6期鸡胚中Ubc9 mRNA广泛而分散地表达(图1A,B),有逐渐向神经褶汇聚的趋势,在8期可见Ubc9在神经褶表达明显增强(图1C),并且8期3个切片处的原位杂交检测也显示Ubc9在此处表达增强(图1D)。
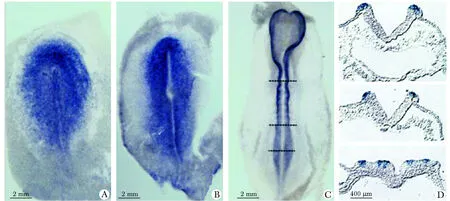
A~B.Ubc9 expression in chick embryos at st 4(18 hours)and 6(24 hours);C.Ubc9 expression in chick embryos at st 8(28 hours);D.sections at the indicated level of the st 8 embryo
图1原位杂交检测Ubc9在早期(4,6,8期)鸡胚中的表达
Fig1Ubc9expression(insituhybridization)inchickembryosatearlystages(4,6,8st)
2.2 Ubc9与 Pax7在鸡胚神经褶上的共定位情况
NCC早期标志基因Pax7(图2A) 与Ubc9(图2B)共表达于神经褶(图2C,D),即神经脊细胞前体。
2.3敲除8期鸡胚的Ubc9后,神经嵴细胞无法形成
对照组(图3A,B,C)经5碱基错配的对照-Mo(非特异性)处理后, 9个鸡胚出现了1个Snail2(A)的异常表达(1/9),Sox9(B,1/10),FoxD3(C,1/8),近似无影响。而实验组(图3 D,E,F)经Ubc9-Mo处理后,与对照组相比,Snail2(D,7/9),Sox9(E,5/6)和FoxD3(F,7/10)的mRNA表达明显减少(P<0.05,P<0.01和P<0.05) (表 1)。
3 讨论
本研究首先用原位杂交法检测了Ubc9的mRNA的表达情况,发现Ubc9在8期鸡胚的神经褶即NCC的前体表达,同时,免疫荧光实验发现NCC早期标志基因Pax7[2]与Ubc9共表达于8期鸡胚神经褶,即神经嵴前体细胞所在位置。这些结果提示,Ubc9可能在NCC形成过程中起作用。
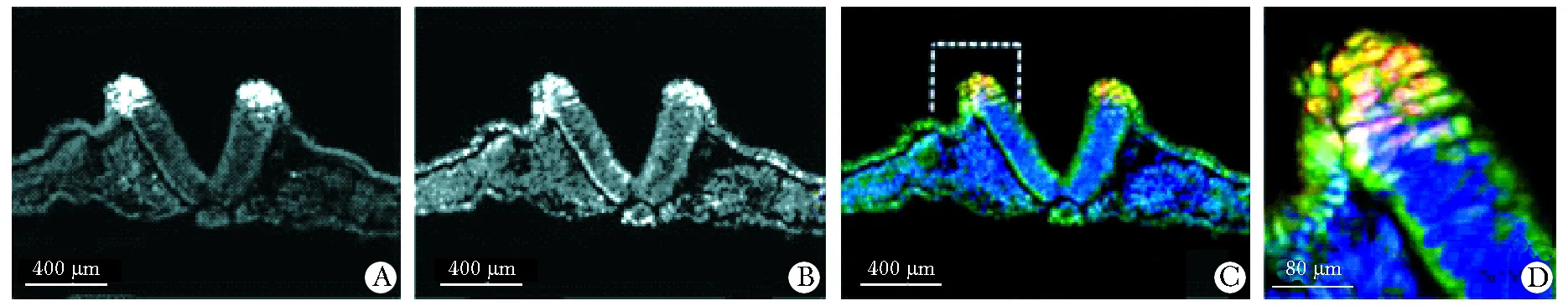
A.Pax7 expression at NC precursors of the neural fold;B.Ubc9 expression at NC precursors of the neural fold;C.Ubc9 are coexpressed with Pax7 in NC precursors of the neural fold of st 8 embryos;D.Framed regions of merged images at higher magnification;Ubc9(green) and Pax7(red) in C,D
图2免疫荧光显示Ubc9和Pax7共定位于鸡胚8期的神经嵴细胞前体(神经褶)
Fig2Ubc9proteinsarecoexpressed(Immunofluorescence)withPax7inNCprecursorsoftheneuralfoldofst8embryos
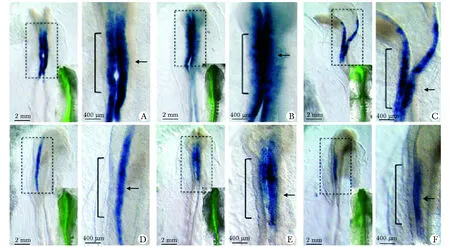
A~C.unilateral electroporation of 5 mismatch control morpholinos have no effect on the expression of NC markersSnail2,Sox9 andFoxD3; D~F.Ubc9-morpholino downregulates the expression ofSnail2,Sox9 andFoxD3; right panels show higher-magnification of framed regions, arrows point to untreated internal control signal and brackets demarcate treated areas; insets show the localization of morpholinos (green) beforeinsituhybridization
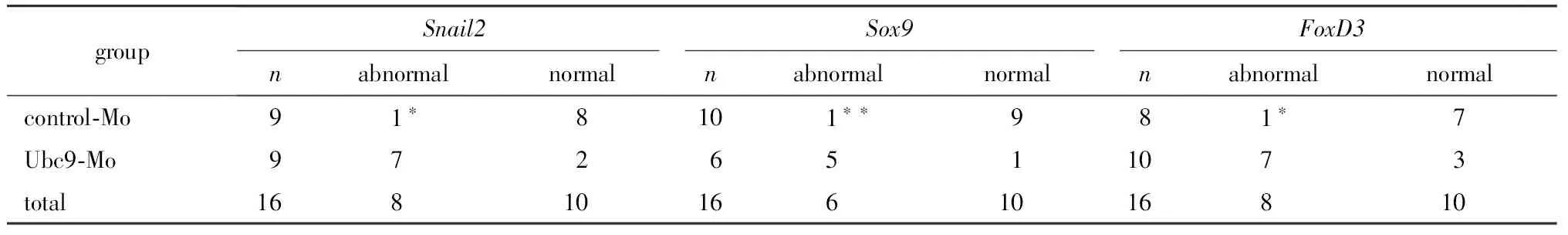
图3 吗啉代法敲除Ubc9导致了Snail2(D), Sox9(E),和FoxD3(F)表达的下降Fig 3 Unilateral Ubc9-morpholino downregulates the expression of Snail2(D), Sox9(E), and FoxD3(F)
*P<0.05,**P<0.01 compared with control group.
Ubc9是SUMO化唯一的E2结合酶。SUMO化反应包括3个步骤:活化,结合和连接,涉及多个酶的级联反应:E1活化酶、E2结合酶以及E3连接酶,其中Ubc9,参与SUMO化中结合和连接两步[12],阻断了Ubc9的表达,即阻断了SUMO通路[4]。
敲除小鼠SUMO1会导致唇裂等缺陷病[13]的发生,说明NCC形成或迁移需要SUMO通路的参与,并且,一些NCC相关转录因子如Sox9等可被SUMO化修饰[14- 15]。但是NCC形成和迁移是否需要Ubc9或需要SUMO通路的参与,目前没有直接证据。本研究通过吗啉代敲除法降低了鸡胚Ubc9的mRNA表达水平,发现NCC晚期标志基因Snail2,Sox9和FoxD3的表达明显下降或不表达,说明NCC形成需要Ubc9 和SUMO通路的参与。
综上所述,Ubc9表达于早期鸡胚神经嵴细胞前体,NCC形成需要SUMO通路的参与。本研究为神经嵴细胞的进一步探索提供了新的思路,而Ubc9和SUMO通路如何影响神经嵴细胞形成及机制仍有待研究。
[1] Achilleos A, Trainor PA. Neural crest stem cells: discovery, properties and potential for therapy[J]. Cell Res, 2012,22:288- 304.
[2] Basch ML, Bronner-Fraser M, García-Castro MI. Specification of the neural crest occurs during gastrulation and requires Pax7[J]. Nature, 2006,441: 218- 222.
[3] Stuhlmiller TJ, García- Castro MI. Current perspectives of the signaling pathways directingneural crest induction[J]. Cell Mol Life Sci, 2012,69:3715- 3737.
[4] Wadosky KM, Willis MS. The story so far: post-translational regulation of peroxisome proliferator-activated receptors by ubiquitination and SUMOylation[J]. Am J Physiol Heart Circ Physiol, 2012,302:H515- 526.
[5] 陈泉,施蕴渝.小泛素相关修饰物SUMO研究进展[J].生命科学, 2004,16:1- 6.
[6] Jentsch S, Psakhye I.Control of nuclear activities by substrate-selective and protein-group SUMOylation[J].Annu Rev Genet,2013,47:167- 186.
[7] Hamburger V, Hamilton HL.A series of normal stages in the development of the chick embryo[J]. J Morphol, 1951, 88:49- 92.
[8] Henrique D,Adam J, Myat A,etal.Expression of a Delta homologue inprospective neurons in the chick[J]. Nature, 1995,375:787- 790.
[9] Betters E, Liu Y, Kjaeldgaard A,etal.Analysis of early human neural crest development[J]. Dev Biol,2010,344:578- 592.
[10] Muramatsu T, Mizutani Y, Ohmori Y,etal.Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo[J]. Biochem Biophys Res Commun, 1997,230:376- 380.
[11]Chapman SC, Collignon J, Schoenwolf GC,etal.Improved method for chick whole-embryo culture using a filter paper carrier[J]. Dev Dyn, 2001,220:284- 289.
[12] 韦玮,张浩.蛋白质SUMO化修饰研究进展[J].中国生物工程杂志,2008,28:122- 126.
[13] Alkuraya FS, Saadi I, Lund JJ,etal. SUMO1 haploin sufficiency leads to cleft lip and palate[J]. Science, 2006, 313: 1751.
[14] Song T,Li G,Jing G,etal. SUMO1 polymorphisms are associated with non-syndromic cleft lip with or without cleft palate[J].Biochem Biophys Res Commun, 2008,377:1265- 1268.
[15] Taylor KM, Labonne C.SoxE factors function equivalently during neural crest and inner ear development and their activity is regulated by SUMOylation[J]. DevCell, 2005,9:593- 603.
The effect of Ubc9 on neural crest cell development of chicken embryo
LI Ming-yang1, LIU Yi-meng3, LIU Chao1, Li Shu-ling2, LUAN Zhi-dong1*
(1.Dept. of Developmental Biology; 2.Dept. of Histology and Embryology; 3.Dept. of Biochemical andMolecular Biology,Liaoning Medical College.Jinzhou 121001,China)
ObjectiveTo examine the effect of Ubc9 and SUMO pathway on neural crest cell development of chicken embryo.Methods1)Chicken embryos were collected,Insituhybridization and Immunofluorescence were used to observe the expression of SUMO-conjugating enzyme-Ubc9 and early markers of neural crest. 2)In the control group, 5-mismatch Ubc9-control morpholino (5MM-Mo) was used to treat chick embryos; In the Ubc9-Mo group, sequence-specific Morpholinos(Mo) was used to reduce Ubc9 level in chicken embryos, then the mRNA of neural crest markers(Snail2,Sox9andFoxD3) was examined.Results1)Ubc9 was coexpressed with Pax7 in neural crest precursors of the neural fold at 4,6 and 8 stage of early chicken embryos. 2)Compared to the control group,Ubc9-Mo treatment led to a reduce of mRNA level of neural crest markers,Snail2(P<0.05),Sox9 (P<0.01)andFoxD3(P<0.05).ConclusionsSUMO-conjugating enzyme, Ubc9 expression start at neural fold at 4,6 and 8 stage of early chicken embryo, Ubc9 and SUMO pathway are required for neural crest cell development of chicken embryo.
chicken embryo;neural crest cell; Ubc9;SUMO pathway
2014- 04- 10
2014- 06- 20
*通信作者(correspondingauthor):zhidongluan@lnmu.edu.cn
1001-6325(2014)08-1079-04
R 392.11
A
