神经病理性疼痛对大鼠脊髓背角蛋白磷酸酶1的表达调控作用
2014-11-28黄宇光
陈 思,申 乐,黄宇光
(中国医学科学院 北京协和医院 麻醉科, 北京 100730)
研究论文
神经病理性疼痛对大鼠脊髓背角蛋白磷酸酶1的表达调控作用
陈 思,申 乐,黄宇光*
(中国医学科学院 北京协和医院 麻醉科, 北京 100730)
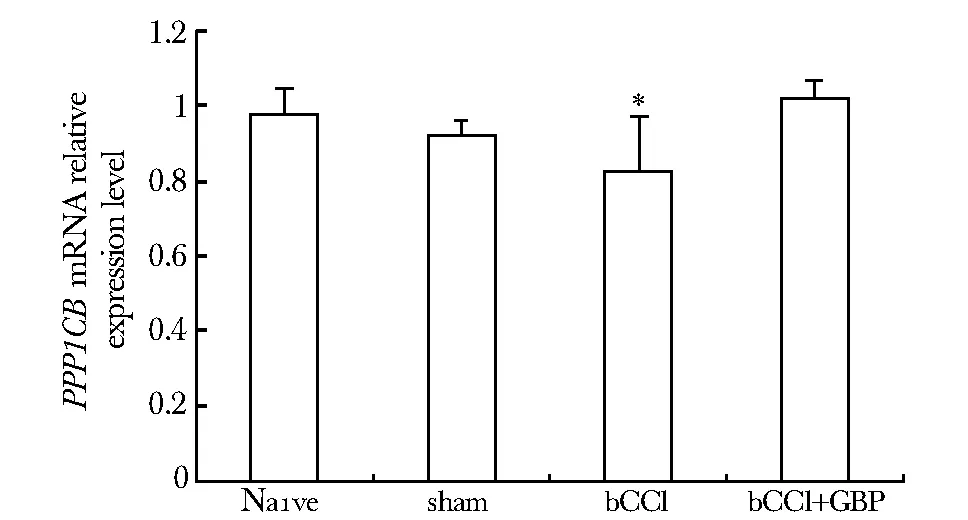
目的明确双侧坐骨神经松结扎(bCCI)大鼠脊髓背角蛋白磷酸酶1催化亚基β异构体(PPP1CB)的表达水平及其与miR-203之间的关系,以及加巴喷丁的干预效果。方法48只雌性大鼠,被随机分为Naive组、Sham组、bCCI组和bCCI+加巴喷丁组,建立bCCI模型。加巴喷丁干预组分别于术前15 min 1次、术后第7天起每日2次腹腔注射给予加巴喷丁100 mg/kg,连续7 d。术后第14天处死大鼠,留取脊髓背角(L4~L6)标本,分别利用real-time PCR与Western blot技术检测PPP1CBmRNA及蛋白质表达,并进行生物信息学分析。结果PPP1CBmRNA表达显著下降约80%,而大鼠脊髓背角PPP1CB蛋白表达水平则较对照组和假手术组上升约2倍;加巴喷丁干预组大鼠脊髓背角PPP1CB蛋白表达水平较未干预组显著回落(P<0.05),但未恢复到对照组和假手术组水平,而PPP1CBmRNA表达水平则较未干预组有显著回升(P<0.05),恢复到与正常对照组、假手术组相同水平;利用生物信息学验证了miR-203对PPP1CB的调控关系。结论bCCI大鼠脊髓背角PPP1CB蛋白的表达量上升可能受到了miR-203的调控作用,并可能通过多种途径参与了神经病理性疼痛的发生发展。
神经病理性疼痛;bCCI;蛋白磷酸酶1;miR-203;加巴喷丁
神经病理性疼痛是由于疾病或损伤累及体感神经系统而引起的慢性疼痛,给个人、家庭及社会造成了巨大的痛苦和负担。本实验的前期研究发现,双侧坐骨神经松结扎(bilateral chronic constriction injury, bCCI)大鼠术后第14天脊髓背角miR-203表达水平显著降低[1],而PPP1CB蛋白表达水平显著升高[2]。
蛋白磷酸酶1催化亚基β异构体(protein phosphatese1, catalytic subunit, beta isozyme,PPP1CB),是蛋白磷酸酶1(PP1)的催化亚基。PP1是真核细胞内重要的丝/苏氨酸磷酸酶,进化上高度保守的蛋白质之一。PP1脱磷酸作用的发挥主要依赖于其催化亚基[3],可参与调节多种重要的生理功能与细胞过程。近年来有研究显示,PP1在年龄相关的记忆减退、遗忘加速、学习力下降等现象中发挥着重要的作用[4]。
与传统单侧坐骨神经松结扎(unilateral chronic constriction injury, uCCI)不同,本研究采用bCCI建立神经病理性疼痛大鼠模型,并利用加巴喷丁(gabapenting,GBP)进行治疗,旨在探索miR-203与bCCI大鼠脊髓背角PPP1CB的表达调控关系以及加巴喷丁的治疗效果。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级健康Sprague-Dawley雌性大鼠,体质量180~200 g[中国医学科学院北京协和医院实验动物中心,SYXK(京)2010-0028],饲养于屏障环境,有良好的通风和空气过滤系统,室温22 ℃左右,相对湿度40%左右,明暗各12 h,自由摄水和食物,定时更换笼具和垫料。适应环境3~5 d。所有实验方法均经过北京协和医院实验动物伦理委员会的审查确认。
1.1.2 实验试剂:Trizol(Applied Biosystems公司,15596-018);PrimeScriptTMRT Master Mix试剂盒和SYBR Premix ExTaqTMII试剂盒(Takara公司); RIPA单去污剂蛋白裂解液(北京海诚远宏科技有限公司);BCA法蛋白含量测定试剂盒(北京索莱宝科技有限公司);加巴喷丁(恩华药业)GAPDH与PPP1CB的正向引物序列(上海生工生物工程公司合成)分别为5′-GACAACTTTGGCATCGTGGA-3′和5′-TGGTGG TATGATGAGTGTGGA-3′;反向引物序列分别为5′-A TGCAGGGATGATGTTCTGG-3′和5′-CCTTTTCTTCG GTGGATTAGC-3′。
1.2 方法
1.2.1 实验分组:48只大鼠随机分成4组(n=12):bCCI组、sham组、Naive组和bCCI+加巴喷丁组。加巴喷丁干预组分别于术前15 min 100 mg/kg腹腔注射1次、术后第7天起100 mg/kg每日两次腹腔注射加巴喷丁(原料药),连续7 d。
1.2.2 bCCI模型的建立:参照Bennet和Xie等[5]的方法,腹腔给药戊巴比妥钠(40~50 mg/kg)麻醉。侧卧位,手术侧在上,消毒,在股骨下方约1 cm平行于股骨切开皮肤,用小剥离子经股二头肌间隙钝性分离肌肉,暴露坐骨神经,用神经剥离子轻柔将坐骨神经与周围软组织分离;在坐骨神经分成3支前的主干部位游离神经7 mm左右,在距神经起始处上方2 mm用4.0含铬羊肠线结扎坐骨神经4道,每道间隔约1 mm,使被结扎的神经长约4~5 mm。松紧度以打结时可见肌肉轻微抽动为准;局部0.9%氯化钠注射液冲洗,间断缝合肌肉筋膜、皮下组织以及皮肤;另一侧采用相同手术方法。假手术组除仅暴露而不结扎坐骨神经外,其余同模型组。手术由同一人操作。
1.2.3 标本的制备:于疼痛行为学高峰期即模型术后第14天腹腔给药2.5%戊巴比妥钠40 mg/kg,深度麻醉后断头处死大鼠。俯卧位,迅速剪开背部皮肤, 沿棘突切开皮肤皮下组织,用咬骨钳分别咬去椎板及椎弓根,暴露脊髓,小心取出腰膨大(L4~L6),以脊髓中央管为界,切除脊髓前角,取脊髓背角立即放入干冰中,待取材完毕尽快放入超低温冰箱保存。
1.2.4 大鼠脊髓背角PPP1CBmRNA表达水平的测定:PPP1CBcDNA以GAPDH为内参,应用real-time PCR反应检测仪行荧光实时定量PCR扩增,测定PPP1CB以及内参基因GAPDH的相对表达量,反应过程中监测各样品孔的扩增曲线,各孔扩增反应均匀上升,加样差异<0.5。计算mRNA的相对表达水平。
1.2.5 大鼠脊髓背角PPP1CB蛋白质水平的测定:取标本,提取总蛋白,BCA法进行蛋白含量测定。配置工作液,进行SDS-PAGE电泳,堆积胶80 V,分离胶120 V,总电泳时间2 h左右。以300 mA恒流转膜90 min,加入封闭液室温封闭1 h左右后进行免疫反应。用ImageQuant LAS 4000mini进行仪器曝光。将仪器预冷至-25 ℃,将A和B两种试剂以等体积混合后滴于PVDF膜上,反应3 min后,用滤纸将PVDF膜表面液体吸干后置于托盘,放入仪器内,对焦清楚后进行化学发光。调整曝光时间,保存曝光图像。利用ImageJ软件分析系统,对Western blot曝光结果进行分析,并将吸光度值进行统计学分析。
1.2.6 miRNA靶基因预测:使用mirSVR和PhastCons两种软件计算得分,所用到的服务器地址如下: http://www.microrna.org/microrna/home.do/;http://compgen.bscb.cornell.edu/phast/phastCons-HOWTO.html/;计算结果若mirSVR score≤-0.1且PhastCons score>0.57,则视为结合位点有效。
1.3 统计学分析

2 结果
2.1bCCI大鼠脊髓背角PPP1CBmRNA相对表达水平
PCR产物呈现特异单峰,无引物二聚体及其他非特异产物(图1,2)。PPP1CB与GAPDHcDNA荧光实时定量PCR扩增结果(图3)示bCCI组与sham组或Naive组均有显著性差异(P<0.05)。
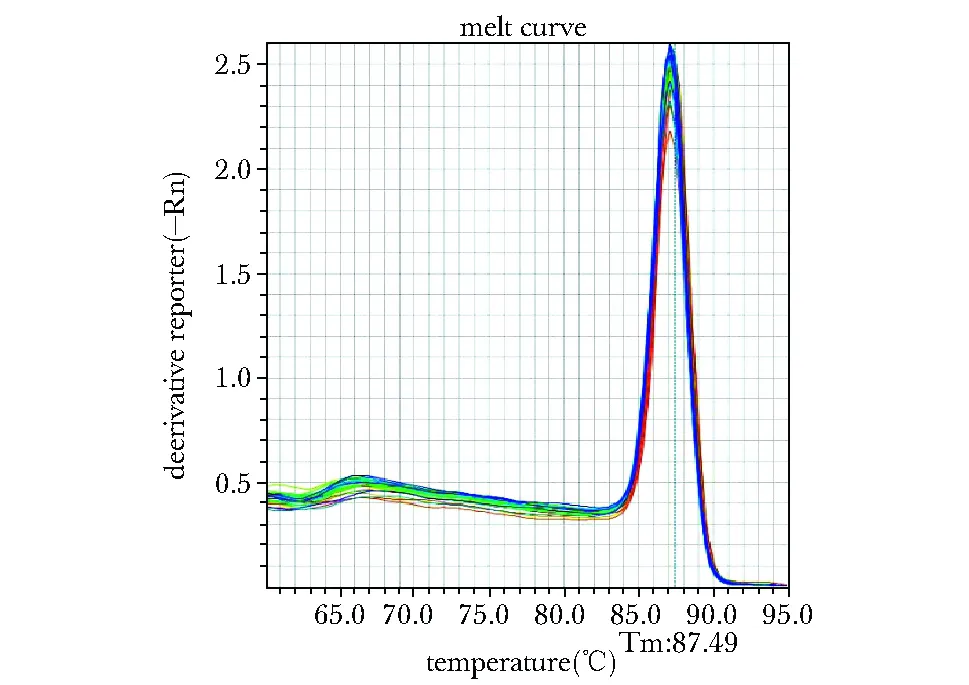
‘Temperature’ of the horizontal axis corresponds to the Tm value of the PCR product, while vertical axis means the speed of real-time fluorescence intensity; each peak of the curve indicates a PCR product图1 PPP1CB熔解曲线Fig 1 Dissociation curve of PPP1CB
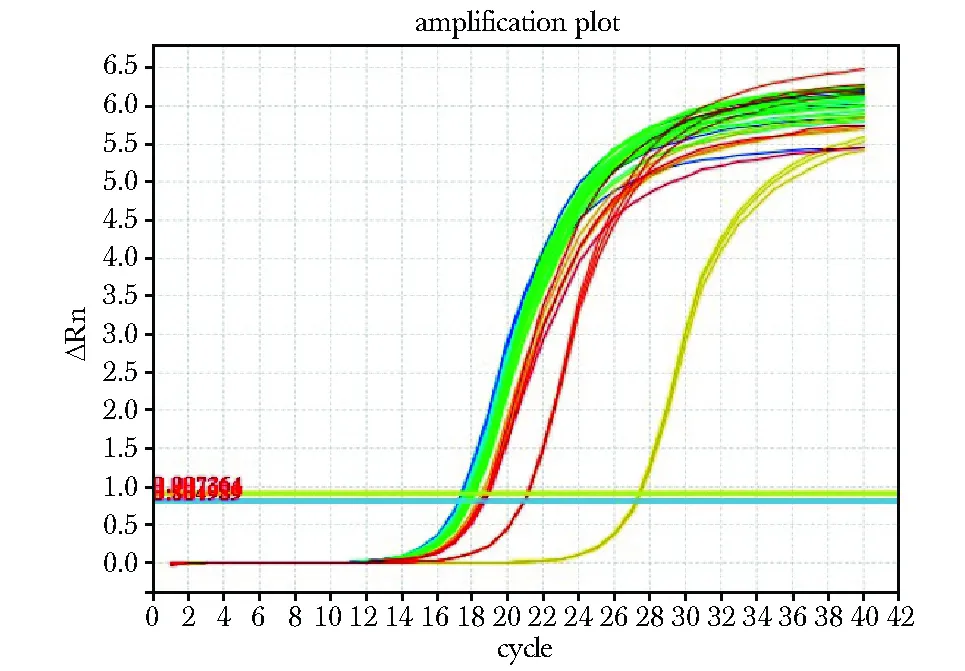
The horizontal axis represents the number of cycles in the PCR reaction, the vertical axis represents the real time fluorescence intensity of the cycles图2 PPP1CB扩增曲线Fig 2 Amplification curve of PPP1CB
Using ANOVA, the results show significant difference between bCCI group and Naive, sham, bCCI + GBP group; no significant difference among the other groups; *P<0.05 compared with bCCI+GBP, Naive and sham group图3 利用2-ΔΔCt法对PPP1CB基因表达差异的分析结果Fig 3 The differential gene expression analysis results by the use of 2-ΔΔCt method(±s, n=6)
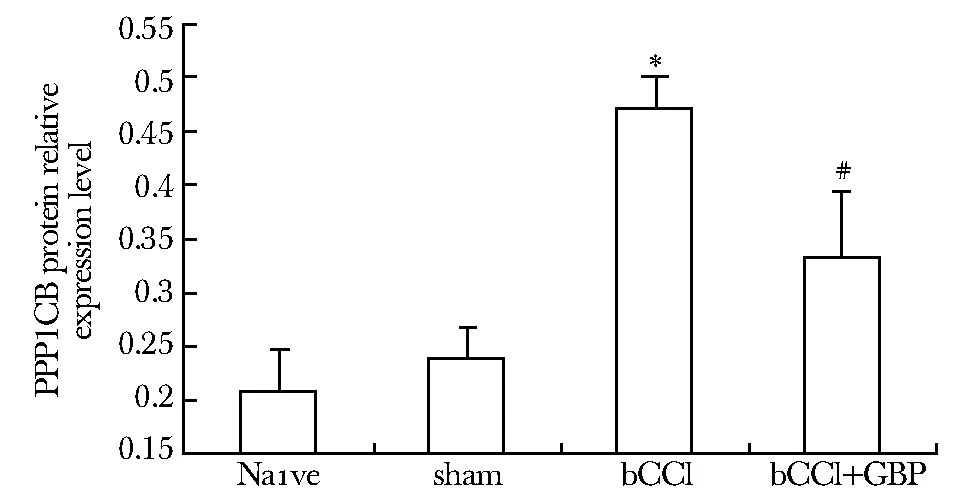
2.2bCCI大鼠脊髓背角PPP1CB蛋白质相对表达水平
蛋白浓度标准曲线图(图4),曝光结果(图5)。吸光度值分析结果(图6):bCCI组PPP1CB表达量上调,与sham组、Naive组相比有显著性差异(P<0.05),约为此二组的2倍。加巴喷丁干预后,干预组表达量下降,虽未下降到基础水平,但与sham组、Naive组和bCCI组比较均有显著性差异(P 图4 蛋白浓度测定标准曲线图Fig 4 Standard curve of protein concentration measured 图5 Western blot测PPP1CB蛋白表达水平的曝光结果Fig 5 Exposure results of Western blot measuring the expression level of PPP1CB protein The sham group showes no significant difference compared to Naive group, while there are significant differences between other groups; *P<0.05 compared with Naive and sham group; #P<0.05 compared with bCCI group图6 各组PPP1CB蛋白相对表达水平Fig 6 PPP1CB protein relative expression of 2.3 生物信息学结果(图7) There are three valid bonding sites between miR-203 and PPP1CB gene in rats, which mirSVR score ≤-0.1 and Phast Cones score> 0.57, considered valid图7 验证miR- 203与PPP1CB之间关系的生物信息学结果Fig 7 Bioinformatics results of the relationship between miR- 203 and PPP1CB 蛋白磷酸化和去磷酸化是生物界最重要的调节机制[6]。在真核细胞的丝氨酸/苏氨酸磷酸酶中,PP1和PP2A的作用占到了90%以上[7]。从分子结构上看,PP1由一个高度保守的催化亚基和几十种不同的调节亚基组成的异二聚体全酶[8],已经被证明参与糖原代谢、骨骼肌的收缩和舒张、细胞周期、DNA的复制、转录以及细胞凋亡等生理过程。 而PP1与疼痛的关系却鲜有报道。有文献指出,PP1参与了大鼠三叉神经抗河豚毒素(TTX-R)钠通道的调控作用[9]。TTX-R钠离子通道在人类DRG小直径感觉神经元中表达,因其与疼痛感受C纤维神经元的密切联系而被认为参与了疼痛感受途径[10]。传统研究认为,DRG神经元中蛋白激酶C、环腺苷酸单磷酸盐依赖的蛋白激酶和蛋白激酶G介导的通路可以使电压依赖的钙离子通道发生改变[10- 11],而根据本研究结果可以提出大胆假设,PP1也有可能在大鼠脊髓背角参与了钙离子通道的调控,从而介导疼痛的发生发展。 此外,研究显示PP1是一种具有抑制学习和记忆作用的分子[4]。当PP1基因受到抑制后,脑中CREB (cyclic AMP-dependent response element binding)蛋白、钙调节蛋白依赖激酶II (CaMKII)、AMPA受体的GluR1亚单位等磷酸化增强,大鼠的学习、记忆效果更为理想。PP1抑制剂可以延长大鼠的记忆时间,说明PP1同样能够促进遗忘。另有文献指出,PP1通过钙调神经磷酸酶和降低突触可塑性来影响学习,促进遗忘[12]。就本研究来说,PP1CB在大鼠中枢神经系统的蛋白表达量升高也许是由于疼痛造成的自我保护机制,促进大鼠对于疼痛等不适感觉的遗忘。 在miR-203对PPP1CB的调控方面,根据本研究结果以及本实验前期的研究结果[1- 2]推断,可能是miR-203本身对PPP1CB起到负向调控作用,因此bCCI大鼠脊髓背角miR-203的减少反而导致了PPP1CB蛋白表达量的上升。 目前,关于加巴喷丁治疗神经病理性疼痛具体的作用机制仍众说纷纭,主流思想认为,加巴喷丁作用于神经元表达的α2δ1钙离子通道亚基,从而调节GABA的活性[13],去甲肾上腺素激活的类胆碱通路被激活也参与了加巴喷丁的镇痛作用[14]。另有研究表明,加巴喷丁可增加杏仁核内源性阿片肽物质的释放,预先给药可减少阿片类药物的需求量[15]。本研究在加巴喷丁给药后,大鼠脊髓背角PPP1CB的蛋白表达虽有显著恢复,却未下降到与对照组、假手术组同样水平,推测可能由于参与的机制复杂多样,以及建立CCI模型时由铬制肠线性质决定的炎性疼痛参与其中,导致加巴喷丁并不能完全发挥作用。 [1] Li HX, Ma C, Huang YG,etal. Differential expression of miRNAs in the nervous system of a rat model of bilaterall sciatic nerve chronic constriction[J]. Int J Mol Med,2013,32:219- 226. [2] 申乐,李旭,黄宇光,等,神经病理性疼痛相关蛋白质在双侧慢性缩窄性损伤大鼠脊髓后角的表达[J],中国医学科学院学报, 2013, 35: 628- 633. [3] Shi YG. Serine/threonine phosphateses: mechanism through structure[J]. Cell, 2009,139:468- 484. [4] Genoux D, Haditsch U, Knobloch M,etal. Protein phosphatase 1 is a molecular constraint on learning and memory[J]. Nature,2002,418:970- 975. [5] Bennett GJ, Xie YK. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain, 1988, 33:87- 107. [6] Olsen JV, Blagoev B, Gnad F,etal. Global,invivo, and site-specific phosphorylateion dynamics in signaling networks[J]. Cell,2006,127:635- 648. [7] Moorhead GBG, Trinkle-Mulcahy L, Ulke-Lemee A. Emerging roles of nuclear protein phosphateses[J]. Nat Rev Mol Cell Biol,2007,8:234- 244. [8] Irving G, Jensen M, Cramor M,etal. Efficacy and tolerability of gastric-retentive gabapentin for the treatment of postherpetic neuralgia: results of a double-blind, randomized, placebo-controlled clinical trial[J]. Clin J Pain, 2009,25:185- 192. [9] Cao XH, Ming ZY. Effects of inhibitor of seine/threonine protein phosphateses1 and 2A on voltage-dependent sodium channels in rat trigeminal ganglion neurons[J]. Chin J Phamacol Toxicol,2005,19:248- 253. [10] Fitzgernald EM, Okuse K, Wood JN,etal. CAMP-dependent phosphorylateion of the tetrodotoxin-resistant voltage-dependent sodium channel SNS[J]. J Physiol,1999,516:433- 446. [11] Marban E, Yamagishi T,Tomaselli GF. Structure and function of voltage-gated sodium channels[J]. J Physiol,1998,508:647- 657. [12] Morishita, W. Regulation of synaptic strength by protein phosphatase 1[J]. Neuron, 2001, 32:1133- 1148. [13] Maneuf YP, Luo ZD, Lee K.Alpha2delta and the mechanism of action of gabapentin in the treatment of pain[J]. Semin Cell Dev Biol,2006,17:565- 570. [14] Hayashida K, DeGoes S, Curry R,etal. Gabapentin activates spinal noradrenergic activity in rats and humans and reduces hypersensitivity after surgery[J]. Anesthesiology,2007,106:557- 562. [15] Montazeri K, Kashefi P, Honarmand A. Pre-emptive habapentin signify reduces postoperative pain and morphine-demand following lower extremeity orthopaedic surgery[J]. Singapore Med J,2007,48:748- 751. Neuropathic pain regulates proteinphosphatase 1 expression in rat spinal cord dorsal horn CHEN Si, SHEN Le, HUANG Yu-guang* (Dept. of Anesthesiology,PUMC Hospital,CAMS, Beijing 100730, China) ObjectiveTo clarify the PPP1CB expression level in spinal cord dorsal horn of bCCI rats and its relationship with miR-203, as well as the intervention effect of gabapentin.MethodsForty-eight female rats were randomly divided into 4 groups(Naive,sham,bCCI,bCCI+gabapentin). The interfered group rats were injected 100 mg/kg gabapentin 15 min before, 7 days after operation for 7 consecutive days, bid, ip. All rats were sacrificed at POD14. Spinal dorsal horn(L4-L6) were assayed for real-time PCR, Western blot to detect mRNA and protein level change and bioinformatics analysis was also involved.ResultsThe PPP1CB protein expression level of spinal cord dorsal horn (L4-L6) significantly increased approximately 2-fold compared with control and sham group, whilePPP1CBmRNA expression level was significantly decreased by about 0.8 times. After gabapentin intervention, PPP1CB protein level was changed whilePPP1CBmRNA expression was back to normal compared to bCCI group. Meanwhile, bioinformatics tools verified PPP1CB is one of the target genes of miR-203.ConclusionsThe increase expression of PPP1CB protein in the spinal dorsal horn may play a role in the mechanism of neuropathic pain, and might be regulated by miR-203. neuropathic pain;bilateral chronic constriction injury(bCCI);protein phosphatase 1;miR-203;gabapentin 2013- 10- 08 2014- 01- 17 国家自然科学基金(31070930,81200869) *通信作者(correspondingauthor): garybeijing@163.com 1001-6325(2014)08-1027-05 R 614 A


3 讨论
