TiO2/Mg(OH)2复合材料对有机污水中甲基橙的光催化降解动力学的研究
2014-11-28邢鹏飞
李 婷,孟 波,邢鹏飞
(东北大学 材料与冶金学院,沈阳 110004)
快速的工业化发展给人们的生活带来各种各样便利,同时也造成了严重的环境污染,随着人类环保意识的觉醒以及环保标准的提高,控制环境污染问题已成为全球关注的焦点.自1972年Fuijisima和 Honda[1]报道了 TiO2电极光电解水现象后,半导体光催化的研究引起了广泛的关注.作为一种高效光催化剂,纳米TiO2具有催化活性高、稳定性好、能耗低以及无二次污染等优良性能,被广泛地应用于环境保护、污水处理等诸多领域.纳米TiO2在光照的条件下能够产生强氧化性的光生空穴,该光生空穴能彻底降解几乎所有的有机物,并最终生成H2O、CO2等无机小分子.由于其光催化活性高、自身化学稳定性好和清洁无毒,已成为最具潜力的半导体光催化材料[2,3].相关研究发现光催化剂表面吸附有机物的能力是影响降解效率的一个重要因素,将光催化剂负载于高效的吸附剂上,可以在催化剂表面聚集更多的有机物,使得光催化剂表面有机物溶度局部升高,提高界面电荷的传递速率,降低空穴与电子的复合率,从而提高光催化降解效率[4].染料废水是目前难降解的工业废水之一,其毒性大,色泽深,严重危害了生态环境.鉴于甲基橙这种较难降解的有机化合物在酸性和碱性条件下的偶氮和醌式结构是染料化合物的主体结构,选择偶氮染料作为降解目标,研究催化剂对甲基橙的吸附规律及光催化氧化动力学过程.Mg(OH)2对有机废水中的甲基橙具有高效的催化降解作用.目前尚未发现关于用TiO2/Mg(OH)2复合材料对有机废水进行降解催化的相关报道.本文研究 TiO2/Mg(OH)2复合材料对有机废水中甲基橙的光催化降解作用和光催化降解的动力学,不仅对深入了解光催化反应规律、提高光催化效率具有一定的意义,同时对开发廉价、高效的光催化剂降解材料、提高天然矿物的综合利用也具有一定的实际意义.
1 实验
1.1 实验仪器和试剂
实验所用的仪器主要有SGY-Ⅱ型多功能光化学反应仪(南京斯东柯电气设备有限公司);UV-9600型紫外可见分光光度计(北京瑞利分析仪器公司);赛多利斯电子天平ALC110.4:赛多利斯科学仪器(北京有限公司);80-2型电动离心机(金坛市富华仪器有限公司);KQ-250DB超声波振荡器(昆山市超声仪器有限公司);101型电热鼓风干燥箱(北京市永光明医疗仪器厂);DF101-S型集热式恒温磁力搅拌器(巩义市予华仪器有限责任公司);F-16型恒温水油浴锅(巩义市予华仪器有限责任公司);SHZ-D(Ⅲ)型循环水真空泵(巩义市英峪予华仪器厂).
实验使用的药品主要有钛酸正丁酯:CP,钨酸铵、乙酰丙酮:AR,(国药集团化学试剂有限公司);无水乙醇,冰乙酸:AR,(天津市百世化工有限公司);聚乙二醇:AR,(天津市博迪化工有限公司);硝酸铵:AR,(天津市科密欧化学试剂开发中心);硝酸:AR,(沈阳经济技术开发区试剂厂);氯化镁:AR,(天津大茂化学试剂厂);甲基橙,其结构式如图1所示:AR,(天津大茂化学试剂厂);去离子水:自制.
1.2 TiO2/Mg(OH)2复合材料的制备
采用低温溶胶-凝胶法制得钨、氮参杂纳米二氧化钛粉体[5],将一定量的纳米二氧化钛粉体与定量的镁盐溶液混合并超声处理,得纳米二氧化钛的镁盐溶胶,以镁盐溶胶作为前驱物,经氨气鼓泡法反应一定时间得白色沉淀、洗涤、过滤,干燥后即得纯净的TiO2/Mg(OH)2.实验装置反应装置如图2所示.
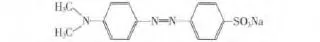
图1 甲基橙Fig.1 Methyl orange
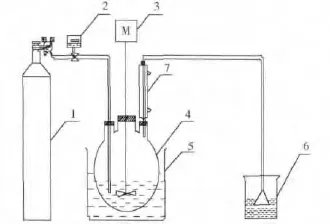
图2 复合材料制备装置Fig.2 Reaction equipment of composite preparation
1.2.1 TiO2/Mg(OH)2复合材料的SEM分析
将制得的TiO2/Mg(OH)2复合材料通过SEM进行分析,结果如图3所示,复合材料呈现出均匀分散的片状结构,且在分散良好的片体上面依稀可见微小的二氧化钛颗粒.

图3 复合材料的SEM图Fig.3 SEM of composite
1.2.2 TiO2/Mg(OH)2复合材料的XRD分析
将制得的TiO2/Mg(OH)2复合材料通过XRD分析,结果如图 4 所示 25.3、37.8、53.9、62.5(°)处的衍射峰分别对应 TiO2的(101),(004),(106)和(215)晶面,为锐钛型TiO2的特征衍射峰,而 18.5、37.9、50.8、58.1(°)为六方晶系氢氧化镁特征峰,并且产品的(001)面与(101)面衍射峰强度比值I001/I101=0.71,说明产品晶体表面极性较弱,微观内应力小,分散性较好,有利于与其他有机分子材料相融.
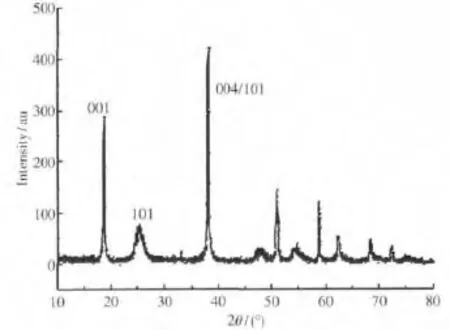
图4 复合材料的XRD图Fig.4 XRD of composite
1.3 光催化反应中复合粉体的量的选取
国内有吴子豹等人[6]和金德宽等人[7]采用分光光度法进行光降解动力学研究的例子.
复合粉体催化甲基橙降解反应可将原甲基橙降解为最终产物--二氧化碳和水,以及不彻底降解产物--其他小分子,反应如下:
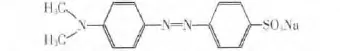
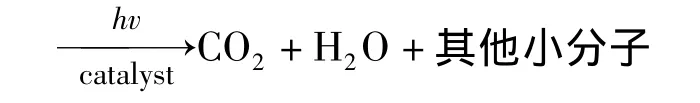
对降解反应进行到一定程度时(160 min)的被降解甲基橙溶液做红外分析可得图5,做核磁分析得图6.
由图5可知,被降解的甲基橙降解液的IR图中,在1 500~1 600左右未出现吸收峰,说明被测甲基橙降解液样品中的物质不含带有苯环的结构,从而表明大分子甲基橙经过复合材料光催化作用后分子中的苯环被降解掉.
同样由图6可知,被降解的甲基橙降解液的氢核磁图中,化学位移在7.4 ppm左右未出现吸收峰,说明被测甲基橙降解液样品中的物质不含带有苯环的结构,从而再次表明大分子甲基橙经过复合材料光催化作用后分子中的苯环被降解掉.
分别称取质量为 0.010、0.015、0.020、0.025和0.030 g的粉体复合材料,并将其依次加入盛有15 mL质量浓度为25 mg/L甲基橙溶液的石英玻璃管,按顺序编上编号,放入多功能光化学反应仪进行光化学反应,从0时刻开始每隔30 min取样一次(每种浓度各取一个样),经离心沉降后,用分光光度计测其吸光度.通过式(1)来计算甲基橙的降解率.
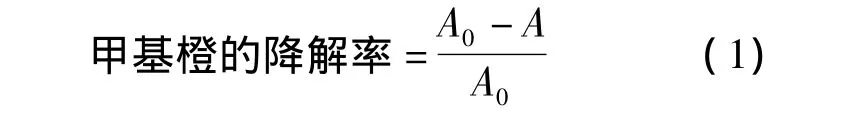
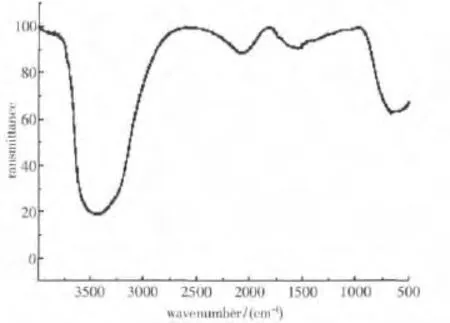
图5 被降解甲基橙的IR图Fig.5 IR of degradated methyl orange
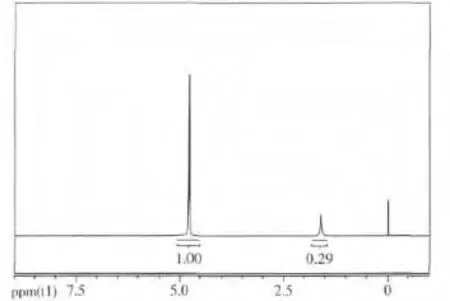
图6 被降解甲基橙的HNMR图Fig.6 HNMR of degradated methyl orange
式中,A为降解后的吸光度;A0为降解前的吸光度.
1.4 降解实验
向一定浓度的甲基橙(或亚甲基蓝)溶液里加入一定量的TiO2/Mg(OH)2复合材料粉体,使其在溶液里的含量为最佳.在氙灯模拟太阳光源的降解装置(如图7所示)中,保持25℃的反应温度,每30 min取样一次,并用分光光度计测定t时刻甲基橙溶液的浓度.考察甲基橙溶液浓度ρt随反应时间t的变化的情况.
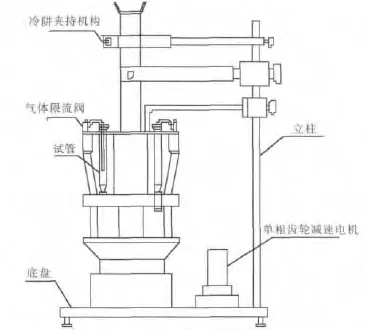
图7 SGY-‖型光催化反应装置Fig.7 SGY-‖multifunctional photochemical reaction instrument
1.5 Langmiur动力学模型
模型基于如下假设[8]:吸附剂表面均匀,被吸附分子机会均等,每个位置只吸附一个分子且无相互作用,吸附至单层为止,吸附平衡为动态平衡.TiO2/Mg(OH)2光催化剂的催化反应在催化剂表面发生,假设其反应动力学遵循Langmiur-Hinshelwood(L -H)动力学模型[9],即:
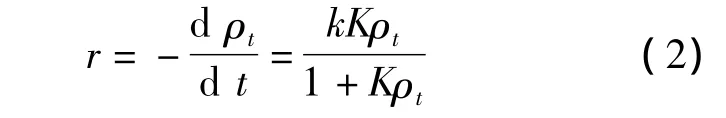
恒等变换得方程:
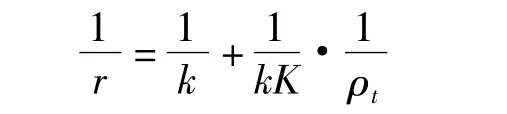
方程式中r为总反应速率,mg·(L·min)-1;ρt为 t时反应物的质量浓度,mg·L-1;k 为Langmiur速率常数,mg·(L·min)-1;K 为甲基橙在复合材料表面吸附平衡常数,L·mg-1.
2 结果讨论
2.1 TiO2/Mg(OH)2复合粉体的加入量对降解率的影响
如图8所示,在TiO2/Mg(OH)2的投入量在0.015 g之前随着TiO2/Mg(OH)2复合材料的投入量的增加,对甲基橙的降解速率逐渐增大.这说明当TiO2/Mg(OH)2复合材料的量较少时,光源产生的光子不能被完全用来产生光电效应,使得光子的能量没得到充分的利用,适当的增加其投入量能够形成更多的活性中心,在增大对光能的利用率时也增加了催化剂和反应物之间的接触面积,从而影响其对甲基橙溶液的光催化降解反应速率[10~12].在其投入量大于0.015 g左右的某一值之后,随着复合粉体的投入量的增加,其对甲基橙溶液的降解速率开始出现减小趋势.原因是,当TiO2/Mg(OH)2的量加入的太多时会导致可见光一部分被复合材料粉体颗粒所屏蔽,这样也造成光子的利用率减小,降低光催化降解的效率[13].因此TiO2/Mg(OH)2复合材料粉体的加入量应该在0.015左右为宜,本实验选择的该复合材料的加入量为0.015 g.同法,参照国家标准在相同条件下,可测得复合材料对mg/L的亚甲基蓝溶液的降解率达到99.20%.
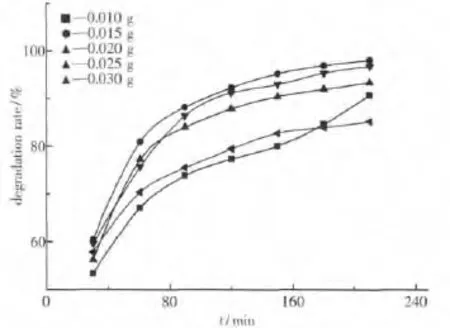
图8 不同量的复合材料粉体对甲基橙降解率的影响Fig.8 Curve of degradation rate with different content of composts material
2.2 动力学研究实验
配置初始质量浓度分别为10、15、20、25、30和35 mg/L的甲基橙溶液.进行光催化降解反应,得不同初始浓度的甲基橙溶液的浓度随时间变化情况.
对表1中的数据进行处理并线性拟合得ln(ρ/ρ0)-t的关系如图 10 所 示.同 时可得ln(ρ/ρ0)-t的线性回归方程如表2所示.
ln(ρ/ρ0)与反应时间t的拟合方程相关系数R2都大于0.98,呈良好的直线关系,符合一级反应动力学特征,说明TiO2/Mg(OH)2催化降解甲基橙溶液的反应为拟一级反应,符合Langmiur-Hinshelwood(L-H)动力学模型.
对图9中各曲线做过t为90min的点的切线,并得其斜率,依据反应速率的定义r=-dc/dt,知r=-slope,即各点的瞬时反应速率在数值上等于该点处切线的斜率,如图11.
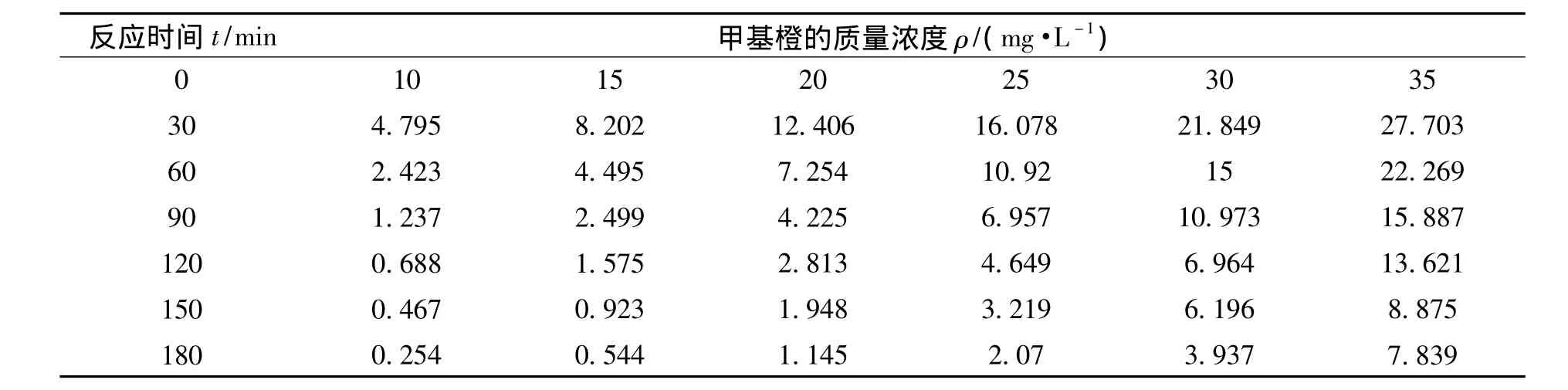
表1 不同初始浓度的甲基橙的浓度随反应时间的变化Table 1 Methyl orange changement with reaction time for different initial concentration
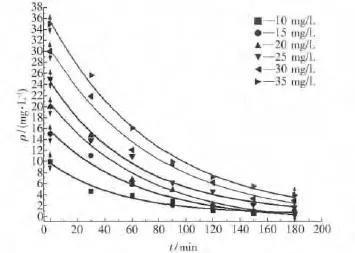
图9 不同浓度的甲基橙浓度随反应时间的变化Fig.9 Relationship between methyl orange changement and reaction time for different concentration
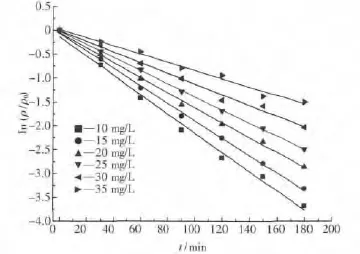
图10 ln(ρ/ρ0)-t曲线Fig.10 Curve of ln(ρ /ρ0)VS t

表2 ln(ρ/ρ0)-t的线性拟合方程Table 2 Linear regression equation of ln(ρ/ρ0)-t
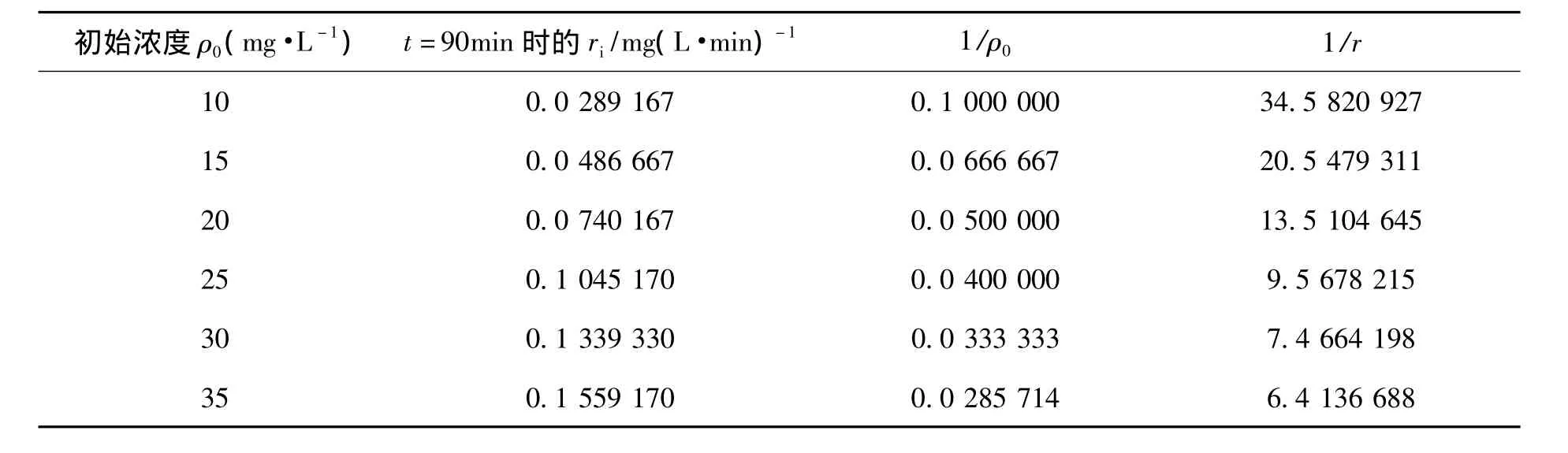
表3 TiO2/Mg(OH)2降解不同初始浓度甲基橙的1/ρ0和1/r的数据Table 3 Data of 1/ρ0and 1/r for different initial concentration of methyl orange
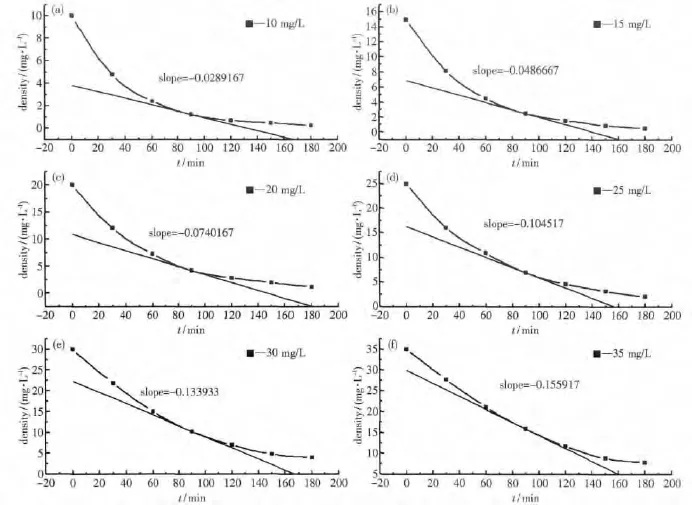
图11 不同初始浓度的甲基橙在90min时刻的瞬时反应速率riFig.11 Reaction rate of different concentration of methyl orange(t=90 min)
由表3可见甲基橙的降解速率随着初始浓度的增加而变大,将1/r对1/ρ0进行线性拟合,如图12所示.
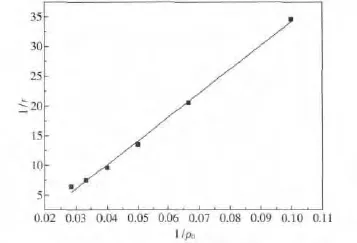
图12 1/r-1/ρ0关系曲线Fig.12 Curve of 1/ρ0VS 1/r
由图12得出1/r与1/ρ0的线性回归方程为:1/r= -5.98073+402.70836/ρ0,回 归系数 R2=0.99 634.1/r 对 1/ρ0线 性 关 系 显 著,故TiO2/Mg(OH)2催化降解有机污水中甲基橙溶液动力学关系较好地遵守L-H模型.在Langmiur-Hinshelwood(L-H)动力学模型中有
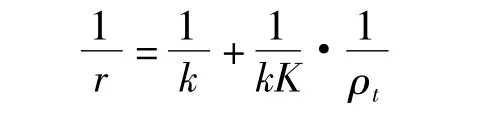
由此可求出反应速率常数k= -0.167 mg·(L·min)-1,表观吸附平衡常数K= -0.0149 L·mg-1.
光催化降解甲基橙的动力学方程为:
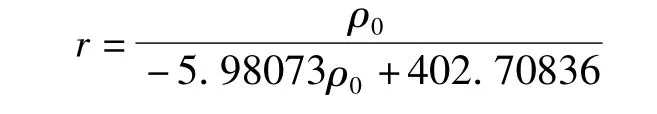
上述实验测定确定TiO2/Mg(OH)2催化降解有机污水中甲基橙溶液反应遵循一级反应动力学.在 Langmiur-Hinshelwood(L-H)动力学模型中,
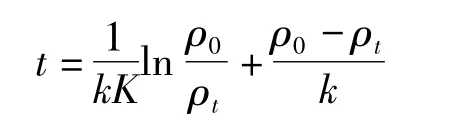
当 ρt/ρ0=0.5 的时候,可得到TiO2/Mg(OH)2催化降解甲基橙溶液反应的半衰期:
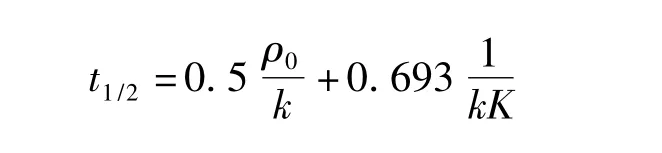
3 结论
(1)以氨气鼓泡法制得TiO2/Mg(OH)2复合材料光催化降解甲基橙反应速率随着甲基橙初始浓度的增加而增加.
(2)当有机污水中甲基橙溶液浓度为20 mg/L时,光催化效率随复合粉体的加入量先增加后减小,在复合粉体为0.015 g左右时达到最优,在可见光照射条件下180 min,TiO2/Mg(OH)2复合材料加入量为1 g/L时,有机污水中含20 mg/L的甲基橙的降解率达到98.00%,用同样方法在同等条件下测得该复合催化剂对30 mg/L的亚甲基蓝溶液的降解率达到99.20%.
(3)复合材料对甲基橙的吸附规律都符合Langmuir吸附等温模型,光催化反应符合一级动力学规律.
[1]Fuijishima A,Honda K.Electrochemical photolysis of water at a semiconductor electrode[J].Nature,1972,238(5358):37-38.
[2]Zheng H L,Pan Y X,Xiang X Y.Oxidation of acidic dye Eosin Y by the solar photofenton processes[J].Journal of Hazardous Materials,2007,141(3):457-464.
[3]Sakkas V A,Dimou A,Pitarakis K.TiO2photocatalyzed degradation of diazinon in an aqueous medium[J].Chem Lett,2005,3(2):57 -61.
[4] Que W X,Zhou Y,LamYL,etal Optical and microstructura1 properties of sol﹣gel derived titania/organically modified silane thin films[J].ThinSolidFilms,2000,358(1/2):16.
[5] Fujishima A,RaoT N,TryD A.Titanium dioxide photocatalysis[J].Photoch C,2002,1(1):1 -21.
[6]吴子豹,黄妙良,杨媛媛,等.负载型TiO2复合材料对甲基橙的吸附行为及光催化降解动力学[J].精细化工,2007,24(1):21-26.
(Wu Z B,Huang M L,Yang Y Y,et al.Adsorption behavior and photocatalytic discoloration kinetics of methyl orange on supported TiO2composite[J].Fine Chemicals,2007,24(1):21 -26.)
[7]金德宽,严群芳.TiO2凹土光催化降解活性深蓝K-R动力学[J].实验室研究与探索,2011,30(11):194-204.
(Jin D K, Yan Q F. Dynamics of TiO2/attapulgite photocatalyst decolorizing reactive deep blue K - R[J].Laboratory Research and Exploration,2011,30(11):194-204.)
[8] Chen Changlun,Li Xueliang,Zhao Dongbin.Adsorption kinetic,thermodynamic and desorption studies of Th(Ⅳ)on oxidized Multiwall carbon nanotubes[J].Colloid and Surfaces A:physicochem Eng Aspects,2007,302:449 -454.
[9] Lijina S H.Elicalm micro-tubes of graphitic carbon[J].Nature,1991,354:56.
[10] Kim SH, NgoH H, shonH K. Adsorptionand photocatalysis kinetics of herbicide onto titanium oxide and powdered activated carbon.Separation and Purification Technology,2008,58(3):335-342.
[11] Peng F,Cai L F,Huang L.Preparation of nitrogen- doped titanium dioxide with visible-light photocatalytic activity using a facile hydrothermal method[J].Journal of Physics and Chemistry of Solids,2008,69(7):1657 -1664.
[12] Para S,Stanca S E,Guasaquilb I.Photocatalytic degradation of atrazine using suspended and supported TiO2[J].Applied Catalysis is B:Environmental,2004,51:107-116.
