精神分裂症伴非酒精性脂肪肝患者血浆瘦素水平
2014-11-28吕文标周爱华鲍喜燕
吕文标 周爱华 鲍喜燕
非酒精性脂肪肝(NAFLD)是以弥漫性肝细胞大泡性脂肪变性为病理特征,排除过量饮酒及其他明确的肝损因素所致的临床病理综合征。NAFLD 的危害性不仅包括了肝病结局,可从单纯脂肪肝发展为脂肪性肝炎、肝硬化;也包括了代谢结局,NAFLD 具有代谢综合征(MS)的所有特征,目前大多数学者已经将NAFLD 作为MS 的组分之一。国内外多项前瞻性研究表明[1-2],NAFLD 患者可以预测MS、心脑血管疾病的发生,有“代谢性肝病”之称。因此对NAFLD 发病机制的认识对其早期干预具有重要意义。
NAFLD 在精神分裂症中高发,国内报道其发生率近30%、尤其是长期住院的慢性患者[3-4],而普通人群中NAFLD的发生率仅15%[5]。目前已认识到在精神分裂症患者中,肥胖、高血脂、血糖异常可能是NAFLD 发生的重要危险因素,而胰岛素抵抗(IR)则是其发生的重要病理过程之一,但其病因学的具体机制仍有待于进一步阐明。瘦素是肥胖基因编码的、主要由脂肪细胞分泌的一种脂肪因子,研究发现,瘦素不仅与肥胖、IR 有关,在一些特殊人群如糖尿病患者中,与NAFLD 的发生可能也存在一定的关系[6]。受此启发,本研究试图通过精神分裂症伴NAFLD 患者血清瘦素水平的对照研究,对精神分裂症这一特殊群体中瘦素与NAFLD 之间的关系进行初步的探讨。
1 对象与方法
1.1 对象 为2009年1月-2010年1月我院精神科住院患者,入组标准:①年龄20~55岁;②符合中国精神障碍分类与诊断标准第3 版精神分裂症诊断标准;③病程1~5年。根据是否伴有NAFLD 分为两组。NAFLD 组:为同时符合中华医学会肝脏病学分会NAFLD 诊断标准[7]:①无饮酒史或每周摄入乙醇量男性<140g,女性<70g;②除病毒性肝炎、药物性肝病、肝豆状核变性等致脂肪肝疾病外;③具备NAFLD 超声诊断标准3 项中的2 项以上者:a 肝脏近场回声弥漫性增强,回声强于肾脏;b 肝内管道结构显示不清;c 肝脏远场回声逐渐衰减。共35例,男19例,女16例,年龄(32±4)岁,病程(1.4±0.7)年,天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)分别为(48±16)U/L、(64±14)U/L。对照组:为与NAFLD 组年龄、性别匹配者,且①AST、ALT 均<40U/L;②不具备上述NAFLD 超声诊断标准3 项中的任何1 项。共35例,男19例,女性16例,年龄(29±5)岁,病程(1.0±0.6)年,AST、ALT 分别为(22±3)U/L、(19±4)U/L。经检验,两组年龄、性别构成、病程无显著差异;NAFLD 组AST、ALT 高于对照组,差异有统计学意义(t=8.379,18.284;P 均<0.000)。本研究获受试者或其监护人书面知情同意;并经所在医院的医学伦理委员会批准。
1.2 方法
1.2.1 体质量指数(BMI)检测 禁食12 h 以上,空腹状态下测量身高、体质量,BMI=体质量/身高2。
1.2.2 空腹血糖(FPG)、血脂测定 采集空腹静脉血测定FPG、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)。FPG 采用葡萄糖氧化酶法测定;TG、TC 采用氧化酶法测定;LDL-C、HDLC 采用直接法测定;所用仪器均为日立(HITACHI)7100 自动生化分析仪;试剂由上海科华生物有限公司提供。
1.2.3 瘦素测定 抽取空腹静脉血4 ml,分离血浆,-20℃低温冰箱保存备测。采用放射免疫法(RIA)测定血浆瘦素的含量。试剂盒由北京福瑞生物技术研究所提供,批内和批间变异系数分别为5.0%和4.5%。
1.2.4 IR 的评定 采用甘油三酯和血糖所得简易指数(Index derived from triglycerides and blood glucose,TyG index)评定IR。TyG 指数由TG、FPG 计算所得,与稳态模型评估的胰岛素抵抗指数(HOMA-IR)之间有较好的相关性,其对IR 评价的可靠性已为国内、外的多数研究所证实[8-9]。TyG 指数=ln[FPG(mg/dl)×TG(mg/dl)]/2[9]。
1.2.5 超声检查 由固定的1名高年资超声诊断医师、使用Aloak Prosound 5500 彩色超声诊断仪(探头频率3.0 MHz)进行超声检查。采用直方图技术对肝脏脂肪浸润程度定量分析,测量同一切面不同深度的肝组织回声,计算其衰减系数以评价脂肪肝严重程度,衰减系数越大者脂肪肝程度越重[10]。
1.3 统计处理 应用SPSS 17.0 处理数据。组间正态分布的定量资料比较采用t 检验、需调整影响因素时采用协方差分析;变量间相关性采用Pearson 相关分析、偏相关分析。
2 结果
由表1 可见,NAFLD 组患者BMI、TG、TC、TyG 指数显著高于对照组(t=2.074~8.482,P=0.044~0.000),而HDLC 则显著低于对照组(t=2.367,P=0.024)。两组FPG、LDL-C 的差异无统计学意义。NAFLD 组患者瘦素显著高于对照组(t=7.112,P=0.000)。采用协方差分析调整BMI、TG、TC、HDL-C、TyG 指数的影响后,NAFLD 组患者瘦素水平与对照组的差异仍有统计学意义(F=5.099,P=0.026)。NAFLD 组患者肝脏超声衰减系数值显著高于对照组(t=9.953,P=0.000)。
相关性分析:NAFLD 组肝脏超声衰减系数值与血浆瘦素水平正相关(r=0.419,P=0.017),偏相关分析调整BMI、FPG、TG、TC、LDL-C、HDL-C 的影响后,二者仍正相关(r=0.379,P=0.038)。
表1 两组患者BMI、FPG、血脂、TyG 指数、瘦素、超声衰减系数的比较(±s)
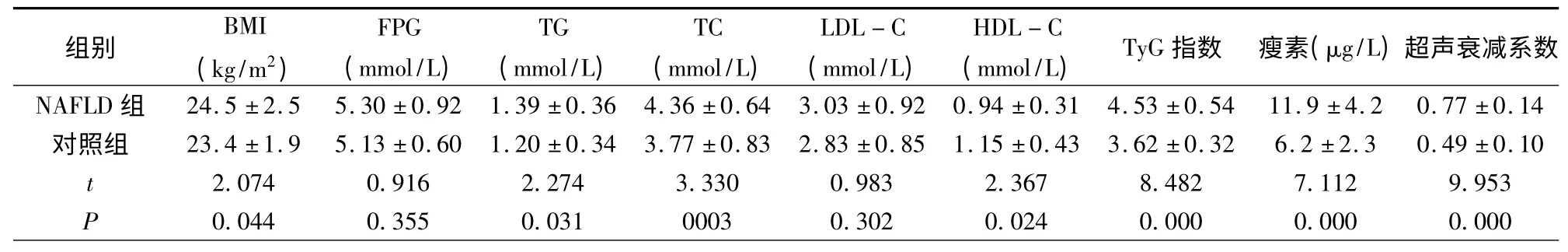
表1 两组患者BMI、FPG、血脂、TyG 指数、瘦素、超声衰减系数的比较(±s)
3 讨论
NAFLD与代谢紊乱关系密切,一方面NAFLD 可作为MS在肝脏的表现之一,另一方面NAFLD 又可对MS 的发生产生影响[11-12]。一般认为,NAFLD 的发生与肥胖、糖尿病、高血脂等多项代谢紊乱有关,本研究也发现,伴NAFLD 的精神分裂症患者其MBI、TG、TC 显著高于不伴者,而具有降解脂质、起保护性作用的HDL-C 则显著低于正常水平,与既往研究结果一致。随着BMI 的增高,大量的体脂、特别是腹内脂肪分解产生所产生的游离脂肪酸,可通过门静脉系统进入肝脏,增加TG 合成而形成NAFLD[13]。高TC、TG 血症也是NALFD 的危险因素,脂质代谢紊乱状态下,肝内脂肪的动态平衡受到破坏,当进入肝脏的脂肪酸和肝脏自身合成的脂肪酸超过肝脏的氧化能力时,肝脏合成的内源性TG 不能以脂蛋白的形式运出肝脏,均可导致脂质在肝细胞内的蓄积[14]。本研究中NAFLD 组患者FPG 水平与对照组差异不显著,我们推测可能与较早期NAFLD 患者中、由于胰岛素水平代偿性增高使FPG水平的变化不显著有关。
以高胰岛素血症为特征的IR 是脂肪肝NAFLD 发生的重要机制。增高的胰岛素水平可通过激活肝脏内源性脂质合成系统的胆固醇调节元件结合蛋白1,继而引起下游一系列的脂质合成酶类(如乙酰辅酶羧化酶等)的合成增加,进而促使内源性脂质的合成[15]。本研究发现,NAFLD 患者TyG 指数显著高于对照组,支持IR 在NAFLD 起重要作用的观点。有研究观察到精神分裂症患者在接受抗精神病药治疗后,稳态模型评估的胰岛素抵抗指数(HOMA-IR)呈显著增高[16];结合本研究结果,有助于从IR 的角度解释了精神分裂症中NAFLD 的高发原因。
瘦素主要由脂肪细胞分泌进入血循环,与下丘脑的瘦素受体结合后,通过调节食欲、抑制脂肪合成,进而调节机体脂肪沉积及能量平衡.在机体的代谢稳态维持中起重要的控制作用[17]。本研究结果发现NAFLD 组患者瘦素水平增高,与既往非分裂症人群中的研究结果相近[18]。由于BMI、血脂等代谢指标都可能影响瘦素水平,通过协方差分析对上述因素进行了调整后发现这一差异仍具有显著性,表明我们观察到的NAFLD 组患者瘦素水平的增高是独立于其他代谢紊乱组的、与NAFLD 直接有关。有证据支持瘦素在NAFLD 发生中的重要性:①高水平瘦素在肝脏可抑制肝细胞的磷酸烯醇丙酮酸羧酶(PEPCK)的基因表达,使TG 合成增加而脂肪酸的β 氧化受到抑制,终至脂质在肝脏的沉积增加[19];②高水平的内源性瘦素可使单核细胞和活化的淋巴细胞聚集,增强肝脏损伤的炎性反应,刺激肿瘤坏死因子α、白细胞介素-6 等炎性因子的分泌[20],炎性机制在解释NAFLD 形成的“二次打击”学说中具有重要地位;③在普通人群中发现瘦素水平与IR 正相关,在分裂症中也有类似发现[16,21],而IR 是NAFLD的重要病理机制,我们认为瘦素水平的增高、乃至瘦素抵抗的形成,可能参与了精神分裂症患者NALFD 的发生机制。
超声直方图所定量测定的肝脏回声衰减系数,与肝脏的脂肪浸润程度有关[22],是一种相对简便的NALFD 严重程度评价方式。本研究相关分析结果提示,血浆瘦素水平与分裂症患者NALFD 的严重程度相关,与既往研究结果吻合[23];而偏相关分析结果则进一步表明,这种联系具有相对的独立性。这些结果进一步支持了血浆瘦素水平在精神分裂症患者NALFD 发生机制中的重要性。
既往研究发现,精神分裂症患者在接受抗精神病药后出现瘦素水平的显著增高,推测可能是作为抗精神病药引起的药源性体质量增加、能量代谢正平衡的一种代偿性机制,是一种适应性调节的结果[16,22]。我们认为,瘦素水平增高作为精神分裂症患者治疗过程中一种较为普遍的内分泌改变,其在解释精神分裂症患者NALFD 高发机制中的意义值得进一步重视及研究。
本研究采用超声诊断及评估NALFD 严重程度,该技术手段还存在较多的局限性:①在一些肥胖患者中,由于腹部皮下、内脏脂肪的增加可使肝脏成像模糊,导致诊断的敏感性、特异性分别降低;②在早期NALFD 患者、特别是肝脏脂肪含量低于20%者,超声诊断的敏感性仅有55%,这在一定程度上削弱了研究结论的说服力,在今后研究中可考虑采用CT等更为敏感的诊断手段以进一步验证本研究结果。
[1]Pascale A,Pais R,Ratziu V.An overview of nonalcoholic steatohepatitis:Past,present and future directions[J].J Gastrointestin Liver Dis,2010,19(3):415-423
[2]范建高,李锋,蔡晓波,等.非酒精性脂肪性肝病导致代谢紊乱患病率增高的队列研究[J].中华内分泌代谢杂志,2007,23(1):28-29
[3]陈剑华,周敏,陆燕华,等.住院精神分裂症患者非酒精性脂肪肝的患病研究[J].精神医学杂志,2010,23(6):446-449
[4]焦玉梅,王金和,陈剑华,等.住院精神分裂症患者伴发非酒精性脂肪肝情况[J].中国心理卫生杂志,2006,20(12):807-810
[5]Fan J G.Farrell G C.Epidemiology of non-alcoholic fatty liver disease in China[J].J Hepatol,2009,50(2):204-210
[6]Angulo P,Alba L M,Petrovic L M,et a1.Leptin,insulin resisance,and liver fibrosis in human nonalcoholic fatty liver disease[J].J Hepatology,2004,41(6):743-748
[7]中华医学会肝脏病学会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南(2010年1月修订)[J].中华内科杂志,2010,49:275-278
[8]Guerrero-Romero F,Simental-Mendia L E,Gonzalez-Ortiz M,et al.The product of triglycerides and glucose,a simple measure of insulin sensitivity comparison with the euglycemic-hyperinsulinemic clamp[J].J Clin Endocrinol Metab,2010,95(6):3347-3351
[9]张翼飞,顾卫琼,晏群,等.由血清甘油三酯和血糖所得简易指数用于评估胰岛素抵抗的临床研究[J].中华内分泌代谢杂志,2012,28(5):392-396
[10]姚惠香,陈维雄,陈玮,等.益生菌治疗非酒精性脂肪性肝病的临床研究[J].胃肠病学和肝病学杂志,2013,22(3):221-223
[11]Adams L A,Waters O R,Knuiman M W,et a1.NAFLD as a risk factor for the development of diabetes and the metabolic syndrome:An eleven-year follow-up study[J].Am J Gastroentero1.2009,104(6):861-867
[12]中华医学会内分泌学分会肝病与代谢学组(筹).中华医学会内分泌学分会“非酒精性脂肪性肝病与相关代谢紊乱诊疗共识”[J].中华内分泌代谢杂志,2010,26(7):531-534
[13]Moscatiello S,Di Luzio R,Sasdelli A S,et al.Managing the combination of nonalcoholic fatty liver disease and metabolic syndrome[J].Expert Opin Pharmacother,2011,12(12):2657-2672
[14]Sozio M S,Liangpunsakul S,Crabb D,et al.The role of metabolism in the pathogenesis of alcoholic and nonalcoholic hepatic steatosis[J].Semin Liver Dis,2010,30(2):378-390
[15]Byrne C D,Olufadi R,Brace K D,Metabolic disturbances in non-alcoholic fattylivetr disease[J].Clin Sci(Lond),2009,116(7):539-564
[16]Zhang Z J,Yao Z J,Liu W,et a1.Effects of antipsychoties on fat deposition and changes in leptin and insulin levels.Magnetic resonance imaging study of previously untreated people with schizophrenia[J].Br J Psychiatry,2004,184(1):58-62
[17]Farooqi I S,O 'rahilly S.Leptin:A pivotal regulator of human energy homeoatasis[J].Am J Clin Nutr,2009,89(3):980-984
[18]Uygun A,Kadayifci A,Yesilova Z,et a1.Serum leptin levels in patients with nonalcoholic steatohepatitis[J].Am J Gastroentrol,2000,95(12):3584-3589
[19]Feldstein A E,Nobili V.Biomarkers in nonalcoholic fatty liver disease a new era in diagnosis and staging of disease in children[J].J Pediat Gastroenterol Nutr,2010,51(2):378-379
[20]Aleffi S,Petrai I,Bertolani C,et a1.Upregulation of proinflammatory and proangiogenic cytokines by leptin in human hepatic stellate cells[J].Hepatology,2005,42(6):1339-1348
[21]Brandl E J,Frydryehowicz C,Tiwari A K,et a1.Association study of polymorphisms in leptin and leptin receptor genes with antipsychotic-induced body weight gain[J].Prog Neuropsychopharmacol Biol Psychiatry,2012,38(2):134-141
[22]夏明锋,高鑫.无创性诊断非酒精性脂肪肝的方法学进展[J].中华内分泌代谢杂志,2010,26(7):623-526
[23]Chitturi S,Farrell G,Frost L,et a1.Serum leptin in NASH correlates with hepatic steatosis but not firbrosis:A manifestation of lipotoxieity?[J].Hepatology,2002,36(2):403-409
