二甲双胍对奥氮平致体重增加的精神分裂症患者血清瘦素水平的影响
2014-11-28陈方斌欧阳晖
潘 奇 陈方斌 欧阳晖 张 艳
奥氮平是目前临床使用较为广泛的非典型抗精神病药物之一,但往往引起体重显著增加乃至发生肥胖。研究发现,奥氮平治疗6个月后,出现有临床意义体重增加的患者高达47.2%,有29.6%的患者在治疗后2月内即可发生,从而严重制约了奥氮平的临床应用[1-2]。近年发现,以二甲双胍作为药物干预手段可有效减轻奥氮平导致的体重增加,并对干预过程中一些与肥胖相关的内分泌机制如胰岛素抵抗(IR)进行了观察[3],但对与肥胖、代谢性疾病密切关联的重要脂肪因子-瘦素的变化情况则所知甚少。众所周知,瘦素在能量平衡的神经内分泌调节机制中起着重要的作用,与脂肪分布、体重控制、糖脂代谢等密切相关[4]。本研究对二甲双胍干预奥氮平所致体重显著增加过程中瘦素的变化情况及其与BMI、IR 的相互关系进行探讨。
1 对象与方法
1.1 对象 均为2011年12月-2012年12月我院精神科长期住院患者。入组标准:①年龄18~55岁;②符合中国精神障碍分类与诊断标准第3 版(CCMD-3)精神分裂症诊断标准;③精神症状相对稳定,阳性与阴性症状评定量表(PANSS)评分≤60 分;④首次、单一接受奥氮平治疗,且疗程≥3月;⑤奥氮平治疗后出现有临床意义的体重增加(≥7%)。排除标准:①内分泌疾病、脑器质性疾病、妊娠;②合并使用其他抗精神病药者;③糖尿病患者、使用降脂药物的高血脂患者。共70例,男、女各35例,采用随机数字表法分为两组。二甲双胍组:男性16例,女性19例;平均年龄(36±8)岁;平均病程(11±6)月;PANSS 评分(47±12)分;奥氮平用量(15.9±3.3)mg/d。对照组:男性19例,女性16例;平均年龄(38±6)岁;病程平均(9±7)月;PANSS 评分(51±13)分;奥氮平用量(15.4±2.9)mg/d。经检验,两组以上各项均无显著性差异。本研究获所在医疗机构医学伦理学委员会的批准,均获受试者监护人签署知情同意书。
1.2 方法 为随机对照研究设计。
1.2.1 药物治疗 两组患者在研究期间均维持原奥氮平治疗剂量不变;二甲双胍组于入组当日晚餐后即服二甲双胍250 mg;第5 天加至750 mg/d(随三餐服用各250mg);对照组不加用二甲双胍、直接随访。如出现睡眠障碍或锥体外系不良反应,可合用小剂量苯二氮卓类药物或盐酸苯海索,有显著病情波动者可临时加用氟哌啶醇肌注。
1.2.2 体质量指数(BMI)测定 于治疗前、治疗后4、8 周末,测量受试者的身高、空腹状态下(禁食8 小时以上)体重,BMI=体重(kg)/身高(m2)。
1.2.3 实验室检查 所有受试者于治疗前及治疗后4、8 周末,抽取空腹肘静脉血6 ml,2 ml 用于空腹血糖检测,所用方法为葡萄糖氧化酶法;另4 ml 在3000r/min 条件下离心20 min,分离血清后置于-80℃低温冰箱保存待测,采用放射免疫法测定瘦素、胰岛素,试剂盒分别由北京福瑞生物技术研究所、北京科美东雅生物技术有限公司提供。
1.2.4 IR 评定 采用稳态模型评估的胰岛素抵抗指数(HOMA-IR)评定IR。HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素浓度(mU/L)/22.5。
1.2.5 量表评定 入组后由1名高年资精神科主治医生负责评定PANSS。
1.2.6 其它 两组均采用医院营养食堂制订的普通饮食,总热量控制在6903kJ/d 以下;允许家属每周探视时给予少量点心零食;日常活动安排为每天低强度的全身性运动(散步)时间约30 分钟;睡眠时间控制在每天8 小时左右;白天一般不允许卧床休息;参加常规性体重控制健康教育。
1.3 统计处理 数据录入后,采用SPSS 16.0 进行统计学分析。组间计数、计量资料的比较,分别采用χ2检验、独立样本t 检验;组内计量资料治疗前、后的比较,采用配对t 检验;相关分析采用简单相关分析(Pearson 相关系数)。
2 结果
2.1 两组治疗前后BMI、瘦素、HOMA-IR 的比较 见表1。两组治疗前BMI、瘦素、HOMA-IR 无显著差异,提示组间均衡性良好。二甲双胍组治疗后4、8 周时的瘦素、HOMA-IR均较治疗前显著下降(P<0.05~0.01);治疗后8 周时BMI较治疗前显著下降(P<0.05)。对照组治疗4、8 周时,BMI、瘦素、HOMA-IR与治疗前比较无显著差异。
2.2 相关性分析 两组治疗前及治疗后4、8 周时,瘦素水平与BMI、HOMA-IR 均有显著的相关(r=0.356~0.463,P=0.036~0.004);二甲双胍组治疗后4、8 周时,瘦素治疗前后变化值与BMI、HOMA-IR 治疗前后变化值均有显著的相关(r=0.341~0.404,P=0.042~0.015)。
表1 两组治疗前后BMI、瘦素、HOMA-IR 的比较(±s)
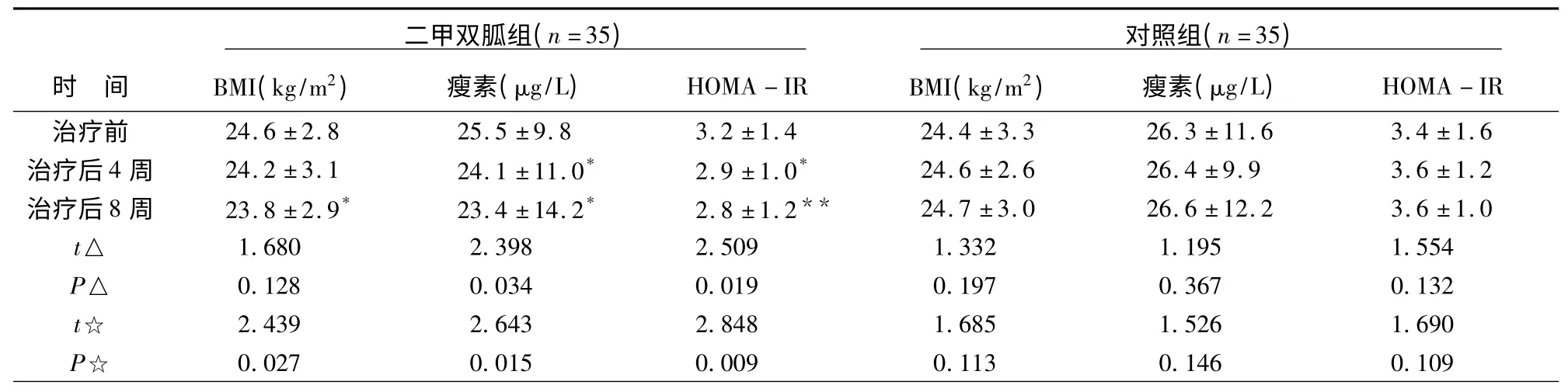
表1 两组治疗前后BMI、瘦素、HOMA-IR 的比较(±s)
注:BMI、HOMA-IR 分别为体质量指数、稳态模型评估的胰岛素抵抗指数;△、☆分别为治疗后4 周、8 周与治疗前比较的统计值;*、**为治疗后与治疗前比较,经配对t 检验,分别P<0.05、0.01。
3 讨论
肥胖是长期能量的摄入与消耗不平衡导致的一种代谢紊乱疾病。与其他抗精神病药相比,奥氮平、氯氮平导致患者肥胖的可能性显著增加[5]。瘦素是一种与肥胖发生密切相关的脂肪因子,由肥胖基因(ob 基因)编码、白色脂肪组织合成并分泌的一种蛋白质激素,瘦素可与下丘脑食欲中枢的瘦素受体结合,而发挥抑制摄食、增加能量消耗、抑制脂肪合成作用。瘦素调节系统被认为是在体重、体脂分布及代谢性疾病发生发展中起至关重要作用的神经内分泌机制之一[6]。既往有发现肥胖患者存在高瘦素血症、瘦素抵抗[7];瘦素在抗精神病药导致的药源性肥胖的形成机制中也具有重要的意义,研究发现,在奥氮平等导致体重显著增加的同时,患者外周循环的瘦素水平也有显著的增高[8],并与抗精神病药治疗后腹内脂肪沉积的发生密切相关[9]。因此,对二甲双胍干预奥氮平所致肥胖过程中瘦素的变化,有助于了解其治疗作用的形成机制,并进一步推进对二甲双胍干预价值、特别是对代谢性疾病防治作用的认识。
本研究结果显示,二甲双胍治疗后4 周IR 水平即有显著的改善,8 周时患者BMI 有显著下降,与既往的研究结果相近[3,10]。虽然在肥胖的病因学机制方面可能存有差异,在二甲双胍对单纯肥胖人群、糖尿病肥胖人群干预作用的研究中也有类似的发现[11],与本研究结果一样,均支持二甲双胍有益于降低肥胖患者体重、改善其IR。目前已发现二甲双胍可通过肝细胞膜G 蛋白而恢复胰岛素对腺苷酸环化酶活性的抑制作用,进而抑制糖异生和促进葡萄糖的转运;可增强肝脏低亲和性、高结合能的胰岛素受体数量;也可通过激活AMPK通路、增加脂肪酸的β-氧化[12],上述机制均可增强对胰岛素的敏感性、减轻IR。同时,二甲双胍可促进外周组织对葡萄糖的摄取和无氧酵解;抑制肠道对葡萄糖的吸收;也可直接降低患者的食欲,最终对奥氮平引起的体重增加起到控制作用[3]。
本研究的主要发现是二甲双胍在有效降低BMI、改善IR的同时,也显著地降低奥氮平所致体重增加患者的外周瘦素水平。国内外研究均显示,奥氮平治疗后血清瘦素水平显著增高[9,13];而长期瘦素水平的增高,可使机体瘦素受体敏感性下调、降低瘦素的生物学效应,导致瘦素抵抗的发生[8-9,13]。既往在动物模型研究中发现,肥胖大鼠血清瘦素含量明显增加、瘦素信号转导能力下调、存在瘦素抵抗,而二甲双胍可能通过直接抑制瘦素分泌、增强机体对瘦素的敏感性而有效降低瘦素水平[14];临床研究也发现,二甲双胍可显著降低糖尿病、脂肪肝患者瘦素水平[15],与本研究结果相符。此外,正常情况下瘦素由外周通过血脑屏障、作用于下丘脑而发挥其生物效应,而在瘦素抵抗患者中该转运通路有所削弱;有研究发现,二甲双胍可显著增加脑脊液中瘦素浓度,有利于提高瘦素的作用效能[16],从另一角度解释了本研究结果。
相关分析进一步发现,不仅瘦素与BMI、HOMA-IR 之间,更为重要的是在二甲双胍干预前后瘦素的变化值与BMI、HOMA-IR 的变化值之间也存在正性相关。既往曾观察到单纯肥胖患者的BMI、脂肪含量、IR与瘦素水平均存在显著相关性[17],认为瘦素、肥胖、胰岛素抵抗三者间存在内在的相互联系。就本研究而言,瘦素与BMI 间的关系可能甚为复杂。一方面发现体重有所增减时、瘦素基因(ob 基因)mRNA 表达也相应增减,即瘦素水平的改变可能是BMI 改变的结果[18];另一方面,二甲双胍对瘦素的影响也可独立于BMI 的改变,这是因为有研究观察到二甲双胍可直接影响ob 基因的mRNA 表达[19]。对此有提示性意义的是,本研究发现干预组在4 周时瘦素水平即有显著下降,而BMI 的显著改变则开始于8 周时,这一结果一定程度上提示二甲双胍对瘦素水平的影响可能具有相对独立性,也就是说二甲双胍降低瘦素水平的作用至少有一部分可能并非继发于BMI 的下降,但这一推测有待于进一步证实。同样,现有的研究结果发现,胰岛素、瘦素之间也存在着复杂的相互作用关系。正常情况下,瘦素可以抑制胰岛β 细胞分泌胰岛素,而胰岛素又可刺激瘦素的分泌,形成一个双相的反馈环,使瘦素和胰岛素分泌保持动态平衡。但当瘦素或胰岛素任一出现抵抗状态、其抑制或刺激性作用降低,则可导致脂肪组织(瘦素)一胰岛(胰岛素)内分泌轴的功能失调,促使另一种激素(因子)显著增高、产生抵抗状态[20]。有研究发现[21],胰岛素水平与瘦素水平呈正相关,而在二甲双胍治疗后瘦素、胰岛素水平均有下降,并互有关联,也支持本研究结果。
[1]Gavin P Reynolds,Shona L Kirk.Metabolic side effects of antipsychotic drug treatment-pharmacological mechanisms[J].Pharmacol Therapeutics,2010,125(1):169-179
[2]昂秋青,唐济生,赵靖平,等.中国大陆地区精神分裂症患者奥氮平治疗引起体质量增加的相关因素分析[J].中华精神科杂志,2011,44(3):145-150
[3]吴仁容,赵靖平,邵平,等.二甲双胍对奥氮平所致精神分裂症患者体质量增加的影响[J].中华精神科杂志,2008,41(1):1-4
[4]Shimizu H,Oh-I S,Okada S,et a1.Leptin resistance and obesity[J].Endocr J,2007,54(1):17-26
[5]丁婷,刘玉兰.奥氮平与氟哌啶醇治疗难治性精神分裂症的对照研究[J].中国健康心理学杂志,2013,21(1):23-24
[6]Jia Y,Yue Y,Lei J,et a1.Signaling through Tyr985 of leptin receptor as an age/diet-dependent switch in the regulation of energy balance[J].Molec Cellular Biol,2010,30(7):1650-1659
[7]顾卫琼,洪洁,张翼飞,等.肥胖人群中血清瘦素、游离脂肪酸和脂联素水平的相互关系[J].中华内分泌代谢杂志,2003,19(3):169-171
[8]Baptism T,Beaulieu S.Are leptin and cytokines involved in body weight during treatment with antipsychotic drugs?[J].Can J Psychiatry,2002,47(8):742-749
[9]Zhang Z J,Yao Z J,Liu W,et a1.Effects of antipsychotics on fat deposition and changes in leptin and insulin levels.Magnetic resonance imaging study of previously untreated people with schizophrenia[J].Br J Psychiatry,2004,184(1):58-62
[10]Klein D J,Cottingham E M,Sorter M,et a1.A randomized doubleblind,placebo-controlled trial of metformin treatment of weight gain associated with initiation of atypical antipsychotic therapy in children and adolescents[J].Am J Psychiatry,2006,163(12):2072-2079
[11]Kowalska I,Kinalski M,Straczkowski M,et a1.Insulin,leptin,IGF-I and insulin-dependent protein concentrations after insulin-sensitizing therapy in obese women with polycstic ovary syndrome[J].Eur J Endocrin,2001,144(5):509-515
[12]Gaocbao Z,Robert M,Ying I,et a1.Role of AMP-activated protein kinasc in mechanism of metformin action[J].J Clin 1nvest,2001,108(8):1167-1174
[13]陈琪,宋梓祥,徐乐平,等.丙戊酸钠与碳酸锂对躁狂发作患者体质量、神经肽Y、瘦素影响的研究[J].中国健康心理学杂志,2012,20(11):1601-1603
[14]Aubert G,Mansuy V,VoiroI M J,et a1.The anorexigenic effeets of metformin involve increases in hypothalamic 1eptin receptor expression[J].Metabolism,2010,17(2):105-112
[15]Nair S,Diehl A M,Wiseman M,et a1.Metformin in the treatment of non-alcoholic steatohepatitis:A pilot open label trial[J].Aliment Pharmacol Ther,2004,20(1):23-28
[16]Park S,Jang J S,Jun D W,et a1.Exercise enhances insulin and leptin signaling in the cerebral cortex and hypothalamus during dexamethasone-induced stress in diabetic rats[J].Neuroendocrinology,2005,82(3):282-293
[17]Mannucci E,Ognibene A,Crcmasco F,et a1.Effect of metformin on glucagon-like peptide 1 and leptin levels in obese nondiabetic subjects[J].Diabetes Care,2001,24(3):489-494
[18]Hausman G J,Barb C R,Dean R G.Gene expression profiling in developing pig adipose tissue:Non-secreted regulatory proteins[J].Animal,2011,5(7):1071-1081
[19]Oswal A,Yeo G Leptin and the control of body weight:A review of its diverse central targets,signaling mechanisms,and role in the pathogenesis of obesity[J].Obesity(Silver Spring),2010,18(2):221-229
[20]Ceddia R B,Koistinen H A,Zierath J R,et a1.Analysis of paradoxical observations on the association between leptin and insulin resistence[J].FASEB J,2002,16(10):1163-1176
[21]叶建红,黎锋,刘天,等.二甲双胍对代谢综合征患者葡萄糖代谢率及脂肪因子水平的影响[J].华中科技大学学报:医学版,2011,40(2):173-177
