Roux-en-Y胃旁路术对2型糖尿病大鼠肾脏糖异生的影响
2014-11-27张少华陈振宇闫洪涛汤礼军
文 艺,冯 犁,张少华,陈振宇,闫洪涛,陈 涛,汤礼军*
(1.第三军医大学 研究生管理大队,重庆 400038;2.成都军区总医院 全军普通外科中心,四川 成都 610083)
研究论文
Roux-en-Y胃旁路术对2型糖尿病大鼠肾脏糖异生的影响
文 艺1,冯 犁2,张少华2,陈振宇2,闫洪涛2,陈 涛2,汤礼军2*
(1.第三军医大学 研究生管理大队,重庆 400038;2.成都军区总医院 全军普通外科中心,四川 成都 610083)
目的研究胃旁路术对2型糖尿病大鼠肾脏糖异生的影响,探讨其可能的降糖机制。方法建立2 型糖尿病大鼠模型,将大鼠随机分为:对照组,糖尿病模型组,假手术组和手术组。分别于术前及术后4周检测各组大鼠总胆固醇(TC)、三酰甘油(TG)和游离脂肪酸(FAA);术前及术后1、2和4周,检测各组大鼠空腹胰岛素,行口服糖耐量实验(OGTT),计算血糖浓度-时间曲线下面积(AUC)和胰岛素敏感指数(ISI)。术后4周,采用实时荧光定量聚合酶链反应(RT-PCR)和Western blot杂交技术检测肾脏组织中糖异生关键酶:葡萄糖6磷酸酶(G-6-P)和磷酸烯醇式丙酮酸激酶(PEPCK)的mRNA表达及蛋白含量。结果术后4周,手术组大鼠较糖尿病模型和假手术组血脂相关指标降低(Plt;0.05),空腹血糖及OGTT 2 h血糖值明显下降(Plt;0.05),AUC明显减小(Plt;0.05),ISI明显升高(Plt;0.05),手术组G-6-P和PEPCKmRNA的表达及蛋白含量较糖尿病模型组和假手术组均有降低(Plt;0.05)。结论胃旁路术能显著降低糖尿病大鼠血糖,改善异常的糖耐量,其降糖机制可能与肾脏糖异生关键酶表达降低,肾脏糖异生减弱有关。
胃旁路术;Roux-en-Y;糖尿病;肾脏;糖异生
糖尿病已成为威胁人类健康的主要慢性疾病之一,其中90%以上为2型糖尿病。目前以饮食控制和口服降糖药物的治疗方式对血糖的长期控制并不理想,胰岛素的替代治疗也只能解决暂时的问题。相较于传统治疗,以Roux-en-Y胃旁路术为代表的减重手术对2型糖尿病的治疗取得意想不到效果,手术不仅能明显的改善2型糖尿病患者的血糖、胰岛素和糖化血红蛋白,同时也可纠正糖耐量异常和胰岛素抵抗[1],近期报道[2]手术对2型糖尿病的治疗效果明显优于单纯的药物治疗。然而目前对其确切的降糖机制尚不清楚,有待进一步的实验研究。本研究采用高脂高糖饮食加腹腔注射小剂量链脲佐菌素建立大鼠2 型糖尿病模型,观察胃旁路术对肾脏糖异生的影响,对胃旁路术的降糖作用及其可能机制进行初步探讨。
1 材料与方法
1.1 动物及饲料
SPF级8周龄SD大鼠40只,雄性,体质量170~190 g[简阳达硕动物科技有限公司,许可证号:SCXK(川)2004)]。高脂饲料由基础鼠饲料(72%)、炼猪油(15%)、蔗糖(10%)和蛋黄(3%)按比例搭配制成高脂高糖饲料。
1.2 试剂
链脲佐菌素(STZ,Sigma公司),柠檬酸缓冲液(0.1 mol/L、pH 7.4),胰岛素放免试剂盒(海博研生物科技有限公司),Trizol(碧云天生物技术研究所),反转录荧光定量PCR试剂盒(TAKARA R0086A),全蛋白提取试剂盒(南京凯基生物科技发展有限公司),山羊抗兔IgG (武汉博士德生物工程有限公司),兔抗PEPCK多克隆抗体(Santa Cruz sc-32879)和兔抗G-6-P多克隆抗体(Santa Cruz sc-25840)(圣克鲁斯生物技术公司)
1.3 糖尿病动物模型复制、分组及处理
将大鼠分为对照组(8只)和糖尿病模型动物(32只),对照组动物给予基础饲料,建模动物给予高脂饲料。喂养4周后,禁食12 h,左下腹腔一次性注射STZ 35 mg/kg[3]。模型稳定1周后,将糖尿病大鼠30只随机分为糖尿病模型组8只,假手术组8只和手术组14只。假手术组行胃窦十二指肠离断原位吻合术,手术组行胃旁路术,大鼠术前禁食12 h,不限饮水,0.5%戊巴比妥钠(50 mg/kg)腹腔内注射麻醉后固定于手术台,无菌条件下,上腹部正中切口长3 cm切开进腹,闭合胃远端,距Treitz韧带10 cm切断空肠,远端肠襻行胃空肠吻合,距胃肠吻合口远端10 cm行空肠侧侧吻合,完成吻合后用甲硝唑溶液5 mL冲洗腹腔后关腹,手术14只,存活4周8只,存活率57.1%。
1.4 检测方法
1.4.1 大鼠血清总胆固醇(TC)、三酰甘油(TG)和游离脂肪酸(FFA)测定:分别于术前及术后4周,采用全自动生化分析仪测定各组大鼠总胆固醇和甘油三酯,ELISA法测定游离脂肪酸。
1.4.2 口服糖耐量实验(OGTT):术前及术后1、2和4周,禁食12 h后,50%葡萄糖灌胃1.5 g/kg,取大鼠尾尖血分别测定给葡萄糖后0、0.5、1和2 h的血糖值,用梯形法按式AUC=0.25×(0 h血糖浓度+4×0.5 h血糖浓度+3×2 h血糖浓度)计算血糖浓度-时间曲线下面积(area under the curve,AUC)。
1.4.3 大鼠血清Insulin测定:术前及术后1、2和4周,采用放射免疫法测定各组大鼠各时间点空腹血清胰岛素水平。
1.4.4 计算胰岛素敏感指数(Insulin sensitivity index,ISI):ISI=1/(空腹血糖×空腹胰岛素),分析时取其自然对数值,即ISI=In(空腹血糖×空腹胰岛素)-1
1.4.5 实时荧光定量-聚合酶链反应(RT-PCR)法检测肾脏皮质PEPCK和G-6-P mRNA的表达水平:采用Trizol法提取肾脏皮质总RNA,严格按照试剂操作说明书进行。用Thermo NanoDrop2000分光光度仪检测RNA 的含量和纯度,取A260/A280在1.8~2.1 之间的RNA进行实验。引物由上海生工合成,为相对定量检测mRNA 表达量,用β-actin作为内参(表1)。采用一步法反转录荧光定量PCR试剂盒配制25 μL体系, BIO-RAD C1000进行目标序列扩增,用2-△△Ct法分析磷酸烯醇式丙酮酸激酶(PEPCK)和葡萄糖6磷酸酶(G-6-P)mRNA 的水平变化。
1.4.6 Western blot检测肾脏皮质PEPCK和G-6-P的蛋白表达:采用BCA法定量总蛋白,取40 μg总蛋白经SDS-PAGE 电泳分离蛋白, 将蛋白转印至PVDF膜上,用含5%脱脂奶粉/TBST室温封闭1 h,封闭后分别加入兔抗PEPCK多克隆抗体(1∶1 000)和兔抗G-6-P多克隆抗体(1∶800),4 ℃杂交过夜。洗膜后用辣根过氧化物酶酶标记的山羊抗兔IgG(1∶1 000)室温下二抗杂交1 h, 洗膜后用ECL化学发光试剂显色, 暗室曝光成像,应用UVP BioSpectrum 410 Imaging System分析密度并计算。
1.5 统计学分析

2 结果
2.1 各组大鼠Tch、TG、FFA的检测结果
术前与对照组相比,糖尿病模型组Tch、TG和FFA均有明显升高(Plt;0.05);术后4周,手术组大鼠较糖尿病模型组和假手术组,Tch、TG和FFA均有降低(Plt;0.05)(表2)。
2.2 各组大鼠OGTT实验的检测结果
术前糖尿病模型组空腹血糖及OGTT 2 h血糖均显著高于对照组(Plt; 0.05);术后,手术组空腹血糖及OGTT 2 h血糖呈明显下降趋势,术后4周其血糖值显著低于糖尿病对照和假手术组(Plt;0.05)(表3)。
2.3各组血糖浓度-时间曲线下面积(AUC)的检测结果
术前糖尿病模型组AUC显著高于对照组(Plt;0.05);术后,手术组AUC较糖尿病模型组和假手术组显著降低(Plt;0.05)(表4)。
2.4各组大鼠空腹胰岛素和胰岛素敏感指数的检测结果
术前,糖尿病模型组胰岛素敏感指数较对照组明显降低(Plt;0.05);术后1周,手术组较糖尿病模型组和假手术组胰岛素敏感指数即明显升高,空腹胰岛素水平降低(Plt;0.05),手术效果一直维持到术后4周(表5)。
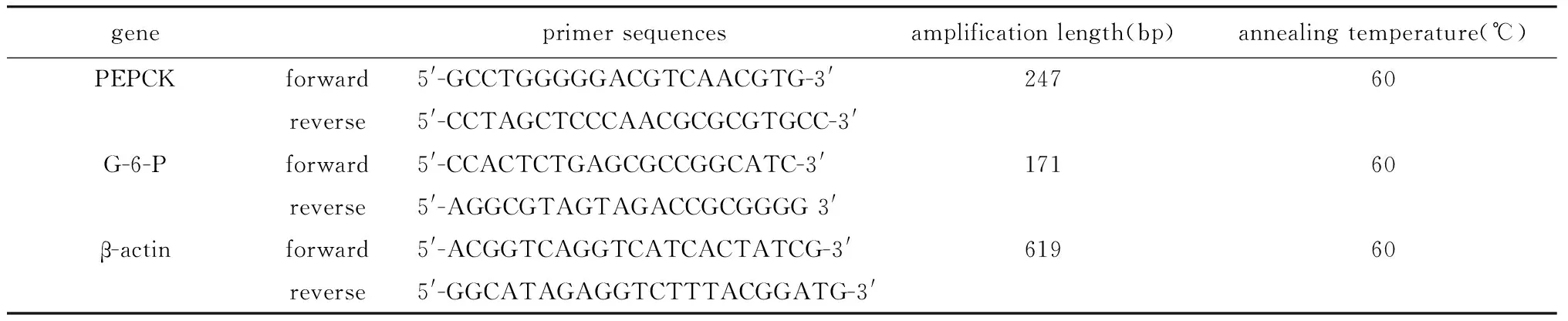
表1 PCR引物序列及反应条件Table 1 Sequences and conditions of primers in used in PCR
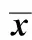
表2 各组大鼠血脂相关指标的检测结果Table 2 The results of blood-lipoid indexes in each group(±s, mmol/L,n=8)
*Plt;0.05 compared with control group;#Plt;0.05 compared with DM group;△Plt;0.05 compared with SRYGB group.
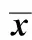
表3 各组大鼠血糖的检测结果Table 3 The results of blood glucose in each group (±s, mmol/L,n=8)
*Plt;0.05 compared with control group;#Plt;0.05 compared with DM group;△Plt;0.05 compared with SRYGB group.
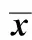
表4 各组大鼠AUC的检测结果Table 4 The results of AUC in each group (±s, mmol/h·L,n=8)
*Plt;0.05 compared with control group;#Plt;0.05 compared with DM group;△Plt;0.05 compared with SRYGB group.
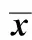
表5 各组大鼠空腹胰岛素和胰岛素敏感性的检测结果Table 5 The results of insulin (mIU/L) and ISI in each group(±s,n=8)
*Plt;0.05 compared with control group;#Plt;0.05 compared with DM group;△Plt;0.05 compared with SRYGB group.
2.5各组大鼠肾脏皮质PEPCK、G-6-PmRNA相对表达的检测结果
术后4周,糖尿病模型组及假手术组大鼠肾脏皮质PEPCK、G-6-PmRNA的表达明显高于对照组大鼠(Plt;0.05),分别升高了近6倍和4倍;手术组大鼠肾脏皮质PEPCK、G-6-PmRNA的表达较糖尿病模型组及假手术组均有降低,尤以G-6-P降低明显(Plt;0.05)(表6)。
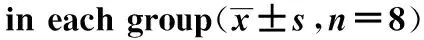
表6 各组大鼠肾脏皮质PEPCK和G-6-P mRNA表达的比较
*Plt;0.05 compared with control group;#Plt;0.05 compared with DM group;△Plt;0.05 compared with SRYGB group.
2.6各组大鼠肾脏皮质PEPCK、G-6-P蛋白表达的检测结果
术后4周,糖尿病模型组及假手术组PEPCK和G-6-P的蛋白表达均明显高于对照组大鼠(Plt;0.05),手术组大鼠PEPCK和G-6-P的蛋白表达较糖尿病模型组和假手术组均有降低(Plt;0.05)(表7,图1)。
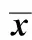
表7 各组大鼠肾脏皮质PEPCK和G-6-P蛋白表达的比较
*Plt;0.05 compared with control group;#Plt;0.05 compared with DM group;△Plt;0.05 compared with SRYGB group.

图1 各组大鼠肾脏皮质PEPCK和G-6-P蛋白表达的比较Fig 1 The expressions of PEPCK and G-6-P protein in each group(±s,n=8)
3 讨论
Roux-en-Y胃旁路术是目前治疗2型糖尿病的新手段和主要手术方法,其临床治疗有效率达80%以上[4]。长期随访调查显示胃旁路术后患者血糖控制稳定,胰岛素抵抗改善明显,患者血脂、血压等也有一定程度改善,降低了糖尿病并发症的危险因素及发病率,是一种有效的治疗方式[5]。
2型糖尿病主要是以胰岛素抵抗为主,使人体器官和组织对胰岛素敏感性降低,致人体对糖的利用减少,内源性糖生成增多。而内源性糖的来源主要有两条途径:一是糖原的分解,二是糖异生。2型糖尿病患者上述两条生糖途径都有不同程度的增强,进而导致餐后和空腹的高血糖。近年研究发现,肾脏具有在各种生理和病理条件下产生和释放糖的能力,肾脏对血糖稳态的重要作用已经得到公认[6]。除了肝脏,肾脏皮质也含有大量糖异生相关的酶,且肾脏是唯一能够通过糖异生产生足够多的糖并释放进入血液循环的器官[6]。研究显示肾糖产量占人体内源性糖产量近20%,约占糖异生途径的40%[7]。而2型糖尿病患者内源性糖的产量增加了近300%,肝糖和肾糖的释放各占50%,糖尿病患者与非糖尿病患者相比,其肾糖的释放增加了近3倍,然而肝糖的释放只增加了30%[8]。此外动物实验显示,糖尿病大鼠肾脏糖异生关键酶基因的表达、酶的活性都是增加的,且肾脏与肝脏G-6-P基因的表达和酶的活性增加几乎相同[9]。本实验也证实,与对照组大鼠相比,模型组大鼠肾脏皮质PEPCK和G-6-P的基因和蛋白表达均明显升高,肾脏糖异生增强。
本研究建立的2型糖尿病大鼠模型,与对照组大鼠相比,该模型大鼠血脂偏高,血糖中度升高,胰岛素敏感性指数降低,糖耐量严重受损,与2型糖尿病的病理生理特点基本一致。对糖尿病大鼠实施胃旁路术后1周,其空腹血糖即明显降低,胰岛素敏感性增加,受损的糖耐量得到改善,表明手术具有快速且显著的降糖效果,这也与前期的研究结果一致[10]。术后4周,手术组大鼠血糖水平趋于稳定,肾脏糖异生关键酶PEPCK和G-6-P的基因及蛋白表达较糖尿病大鼠均有一定程度降低,肾脏糖异生减弱。手术组大鼠肾脏糖异生的减弱可能跟其术后胰岛素敏感性增加有关,有研究报道胰岛素可以通过下调糖异生关键酶基因的表达而对糖异生起到负性调节作用[11],抑制肝脏和肾脏内源性糖的产生[12],因此推测肾糖输出的减少可能主要和胰岛素的作用有关。其次,胃旁路术后诸多胃肠道激素及脂肪因子的分泌会发生改变[13],是否有其他的因素在其中产生作用都仍需进一步研究证实。
综上,Roux-en-Y胃旁路术能迅速降低糖尿病大鼠血糖,改善受损糖耐量,其机制可能跟术后降低肾脏糖异生关键酶的表达,抑制肾脏糖异生有关。
[1] 汤礼军,陈涛,崔建峰,等. 胃旁路术治疗非肥胖型2型糖尿病的近期疗效[J]. 中华消化外科杂志,2011,10:214-216.
[2] Mingrone G, Panunzi S, De Gaetano A,etal. Bariatric surgery versus conventional medicaltherapy for type 2 diabetes[J]. N Engl J Med,2012,366:1577-1585.
[3] K. Srinivasan, B. Viswanad, Lydia Asrat,etal.Combination of high-fat diet-fed and low-dose streptozotocin-treatedrat: A model for type 2 diabetes and pharmacological screening[J]. Pharmacol Res,2005,52:313-320.
[4] Yan HT, Tang LJ, Chen T,etal. Defining and predicting complete remission of type 2 diabetes: a short-term efficacy study of open gastric bypass[J].Obes Facts, 2013,6:176-184.
[5] Rubino F, Schauer PR, Kaplan LM,etal. Metabolic surgery to treat type 2 diabetes: clinical outcomes and mechanisms of action[J]. Annual Rev Med, 2010,61:393-411.
[6] Triplitt CL.Understanding the kidneys’ role in blood glucose regulation[J].Am J Manag Care,2012,18:11-16.
[7] Meyer C, Stumvoll M, Dostou J,etal. Renal substrate exchange and gluconeogenesis in normal postabsorptive humans[J]. Am J Physiol,2002,282: 428-434.
[8] Meyer C,Woerle HJ,Dostou JM,etal.Abnormal renal,hepatic,and muscle glucose metabolism following glucose ingestion in type 2 diabetes[J].Am J Physiol Endocrinol Metab,2004,287:1049-1056.
[9] Asimina Mitrakou.Kidney: Its impact on glucose homeostasis and hormonal regulation[J].Diabetes Res Clinical Practi,2011, 93:66-72.
[10] 伍松,唐均成,邹洪,等.Roux-en-Y胃旁路术对2型糖尿病大鼠肝脏糖异生的影响[J].中华消化外科杂志,2012,15:1142-1145.
[11] DeFronzo RA, Davidson JA, Del Prato S. The role of the kidneys in glucose homeostasis: a new path towards normalizing glycaemia[J].Diabetes Obes Metab,2012,14:5-14.
[12] Pillot B, Soty M, Gautier-Stein A,etal.Protein feeding promotes redistribution of endogenous glucose production to the kidney and potentiates its suppression by insulin[J]. Endocrinology, 2009,150:616-624.
[13] 冯苏,贾高磊,王小凯,等. 胆胰转流术改善2型糖尿病的研究进展[J].基础医学与临床,2014,34: 278-281.
Effect of Roux-en-Y gastric bypass surgeryon renal gluconeogenesis in type 2 diabetes mellitus rats
WEN Yi1, FENG Li2, ZHANG Shao-hua2, CHEN Zhen-yu2, YAN Hong-tao2, CHEN Tao2, TANG Li-jun2*
(1.Administration Office of Graduate Students,Third Military Medical University,Chongqing 400038;2.Center of General Surgery,General Hospital of Chengdu Military Command,Chengdu 610083,China)
ObjectiveTo investigate the effect of Roux-en-Y gastric bypass surgery on renal gluconeogenesis in type 2 diabetes mellitus rats, and explore its possible hypoglycemic mechanism.MethodsTo build diabetes mellitus animal models. Diabetic rats were divided into four groups randomly: control group, diabetes model group (DM group),sham Roux-en-Y gastric bypass group (SRYGB group), Roux-en-Y gastric bypass group (RYGB group). Plasma TG,TC and FFA were measured respectively before and 4th week after the operation in each group rats; the fasting insulin was measured and OGTT was taken before and 1st,2nd and 4th week after the operation, calculate the AUC of blood glucose concentration-time and ISI. The key enzymes of renal gluconeogenesis: G-6-P and PEPCK were detected using RT-PCR and Western blot respectively 4th week after the operation in each group rats.Results4 weeks after surgery,RYGB group rats were compared with DM and SRYGB group rats,Roux-en-Y gastric
bypass surgery can reduce the level of blood lipid (Plt;0.05) and decrease the fasting blood glucose of as well as 2 h after OGTT significantly (Plt;0.05), reduce the AUC (Plt;0.05), increase insulin sensitivity(Plt;0.05),decrease expression ofG-6-PandPEPCKmRNA and protein in some degree.ConclusionsRoux-en-Y gastric bypass surgery can reduce blood glucose in diabetic rats significantly and improve the glucose tolerance, its mechanism may be related to decrease of G-6-P and PEPCK mRNA and protein levels in renal tissue,weaken renal gluconeogenesis.
gastric bypass surgery;Roux-en-Y;diabetes mellitus;kidney;gluconeogenesis
2013-12-20
2014-03-12
全军临床高新技术重大项目(2010gxjs040)
*通信作者(correspondingauthor):whjtlj1251@163.com
1001-6325(2014)05-0661-06
R 656.6;R 587.1
A
