1,25(OH)2D3抑制嘌呤霉素氨基核苷诱导的肾病大鼠TRPC6的表达
2014-11-27肖厚勤陈新河胡兆雄刘双信
肖厚勤, 费 沛, 陈新河, 胡兆雄,张 永,刘双信,史 伟*
(1.湖北医药学院 附属太和医院 肾内科,湖北 十堰 442000;2.广东省人民医院 肾内科, 广东 广州 510080)
研究论文
1,25(OH)2D3抑制嘌呤霉素氨基核苷诱导的肾病大鼠TRPC6的表达
肖厚勤1,2*, 费 沛1, 陈新河1, 胡兆雄1,张 永1,刘双信2,史 伟2*
(1.湖北医药学院 附属太和医院 肾内科,湖北 十堰 442000;2.广东省人民医院 肾内科, 广东 广州 510080)
目的观察1,25-二羟维生素D3[1,25(OH)2D3]对嘌呤霉素氨基核苷(PAN)肾病大鼠肾脏TRPC6表达的影响。方法大鼠随机分为对照组(Con)、模型组(Mod)和1,25(OH)2D3治疗组(Vit D),每组n=10。Mod组和Vit D组每10天尾静脉注射PAN 100 mg/kg建立PAN肾病模型。Vit D组每天给予1,25(OH)2D30.2 μg/kg灌胃。在1和3月时分两批处死动物,检测24 h尿蛋白、肾功能、血脂和血浆蛋白;PAS染色和透射电镜观察肾组织学改变;RT-PCR、激光共聚焦检测TRPC6、synaptopodin及nephrin的表达和分布。结果PAN肾病大鼠逐渐出现大量蛋白尿、大量腹水、高脂血症和低蛋白血症肾病综合征的表现。病理呈现肾间质水肿、炎性细胞浸润、大量的蛋白管型及局灶节段性肾小球硬化、肾小管萎缩和纤维化。与Mod组大鼠比较Vit D组大鼠24 h尿蛋白显著减少[1月时,(338±120)mgvs(669 ±142)mg,3月时(432±83)mgvs(601±95)mg,Plt;0.01],肾小球硬化指数显著减轻[(2.3+0.6)vs(3.4+0.4),Plt;0.01],肾功能改善[Cr(40.2±3.4)μmol/Lvs(53.4±6.3)μmol/L,BNU(9.4±3.0)mmol/Lvs(17.3±2.9)mmol/L,Plt;0.01];激光共聚焦显示PAN大鼠TRPC6 表达显著升高并与synaptopodin高度融合, Nephrin mRNA的表达显著降低;与Mod组大鼠比Vit D组大鼠TRPC6 mRNA显著降低,nephrin的表达显著升高[在1月时,(0.42±0.10) vs(0.75±0.14);在3月时(0.35±0.07)vs(0.68±0.10),Plt;0.01],Nephrin mRNA[在1月时(0.81±0.19)vs(0.33±0.09);在3月时(0.77±0.10)vs(0.44±0.10),Plt;0.01]。结论1,25(OH)2D3通过抑制PAN肾病大鼠TRPC6的表达来发挥肾脏保护作用。
足细胞;1,25-二羟维生素D3,嘌呤霉素氨基核苷; TRPC6
早期补充活性维生素D(VitD)具有独立钙磷代谢之外的肾脏保护作用,然而其作用机制并不清楚[1-2]。瞬时受体电位离子通道6(transient recep tor potential cation channel 6, TRPC6)属于TRP大家族成员之一,其突变或活化主要引起瞬时钙离子内流增加。最近的实验表明[3-4],抑制足细胞TRPC6的活化可能是治疗蛋白尿性肾脏疾病的新靶点,VitD的肾脏保护作用是否与TRPC6离子通道有关尚不清楚。本实验建立了嘌呤霉素氨基核苷肾病(puromycin aminonucleoside nephropathy, PAN)大鼠模型,观察了TRPC6在PNA大鼠肾组织中的表达、定位及VitD对其表达的影响。
1 材料与方法
1.1 主要试剂
兔抗鼠nephrin多克隆抗体 (Santa Cruza公司),兔抗 TRPC6多克隆抗体(ABCAM公司),cy3-标记的羊抗兔IgG(Sigma公司);DEPC、Trizol试剂(invitrogen公司);RNA酶抑制剂、一步法 RT-PCR试剂盒(南京凯基公司)。引物由上海生物工程公司合成。
1.2 PAN肾病大鼠模型的制备及实验分组
30只雄性SD大鼠(SPF级,南方医科大学动物实验中心,合格证号0025926),随机分为正常对照组(Con)、模型组(Mod)和1,25(OH)2D3治疗组(Vit D),每组10只。PAN溶入0.9%氯化钠注射液中配制成50 mg/mL 4 ℃保存。Mod组和Vit D组每隔10 d尾静脉注射PAN 100 mg/kg,连续3次建立足细胞损伤的PAN动物模型,Con组给予等量的0.9%氯化钠注射液。Vit D组于造模前两天每天给予1,25(OH)2D30.2 μg/kg灌胃,正常对照和模型组每天给予等量的0.9%氯化钠注射液灌胃。于1月和3月时分两批处死动物,每次5只,分别检测不同时间点24 h尿蛋白、肾功能、血脂和血浆蛋白; 大鼠以10%水合氯醛麻醉后无菌手术打开腹腔,心脏取血留血标本进行生化检测,留取双侧肾脏,肾组织分四部分,分别经4%的多聚甲醛缓冲液固定、2.5%戊二醛固定、送冰冻切片及皮及髓质分离后置于液氮中冻存。
1.3 血及尿样本的检测
24 h尿蛋白采用紫外分光光度法(贝克曼库尔特公司),采用BT-224型自动生化分析仪检测各组大鼠电解质和肾功能。
1.4 肾组织形态学观察
肾组织标本经常规固定、包埋及切片行HE、PAS染色。另一部分用2.5%戊二醛固定制成超薄切片透射电镜观察。肾小球硬化指数的判定为:每例标本在高倍视野下随机选取25个肾小球,根据每个肾小球硬化的程度和范围计算积分,0分:无硬化;1分:局灶节段性硬化lt;25%;2分:25%≤硬化范围lt;50%;3分:50%≤硬化范围lt;75%;4分:75%≤硬化范围。由3人盲法同时进行,得出每例标本的平均积分。
1.5 激光共聚焦
取新鲜大鼠肾组织立即冰冻切片,厚度3 μm,丙酮-20 ℃固定,PBS水洗, 0.5% Triton X-100透化20 min, 5%小牛血清室温封闭20 min,加一抗(用1%小牛血清稀释)放在湿盒里,4 ℃过夜或室温度2 h,1×PBS洗3次,每次5 min,如做双重免疫荧光,再加第二种一抗(注意和第1个一抗种属须不同),加荧光二抗(用1% BSA稀释)37 ℃ 60 min,闭光,1×PBS洗3次,每次5 min,荧光显微镜或共聚焦显微镜观察。
1.6 总RNA的提取及RT-PCR
取液氮中冻存的肾皮质约100 mg,在碾钵中碾成粉末,用Trizol1试剂标准程序提取肾皮质总RAN。取50~100 ng总RNA按南京凯基一步法试剂盒说明配制反转录反应体系。各目的基因引物序列分别为:nephrin:上游:5′-AGCCTCTTGACCATCG CTAA-3′;下游:5′-CCCAGTCAGCGTGAAGGTAG-3′;产物302 bp;TRPC6,上游: 5′-GATATCTTCAAATT CATGGTCATA-3′,下游5′-:TCCGCATCATCCTCAAT TTC-3′;内参β-actin:上游:5′-CACCCGCGAGTACA ACCTTC-3′;下游:5′-CCCATACCCACCATCACACC-3′;产物206 bp;PCR产物经2%琼脂糖凝胶电泳分离。应用凝胶成像系统分析成像,以目的基因片断 /β-actin片断的条带吸光度比值进行比较。
1.7 统计分析
2 结果
2.1 各组大鼠24 h尿蛋白及血生化的改变
与正常大鼠(Con)相比,PAN肾病大鼠精神状态差,出现大量腹水,大量蛋白尿、低蛋白血症、高脂血症等典型的肾病综合征的表现。与PAN模型组相比VitD组尿蛋白的分泌显著减少,血浆蛋白显著升高,血肌酐水平显著下降(Plt;0.05)(表1)。
2.2 大鼠肾脏的病理改变
PAN诱导的模型组大鼠在1月时出现肾间质水肿,并出现大量的蛋白管型、炎性细胞浸润并伴有小管间质的坏死和萎缩,肾小球硬化尚不明显;在3月时明显的出现典型肾小球的节段局灶性硬化伴有肾间质的纤维化,肾小管蛋白管型。VitD组大鼠上述改变明显减轻,炎性细胞减少,在3月时的肾小球硬化指数和间质纤维化指数明显减轻(Plt;0.01)(图1)。电镜结果显示嘌呤霉素氨基核苷肾病大鼠出现足突广泛融合、溶酶体坏死,肾间质水肿,在3月时足突融合进一步加重,局部出现足突吸收,肾小球硬化。活性维生素D治疗大鼠上述改变明显减轻(图2)。
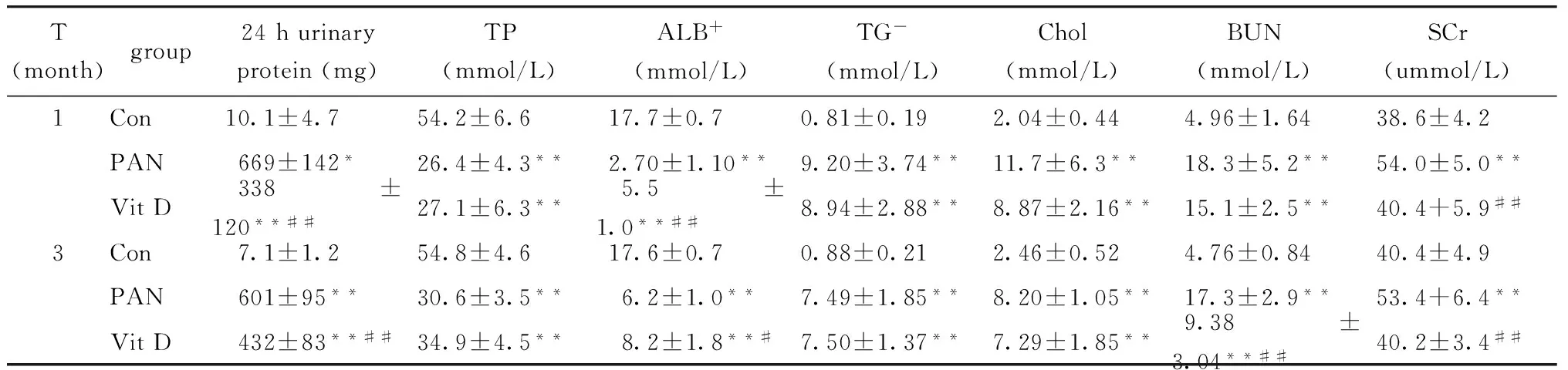
表1 不同组大鼠24 h尿蛋白和血生化水平Table 1 24-Hour urinary protein excretion and biochemical parameter levels (n=5)
*Plt;0.05,**Plt;0.01 compared with control;#Plt;0.05,##Plt;0.01 compared with PAN,n=5; Con.control;PAN.PAN model;Vit D.1,25(OH)2D3.
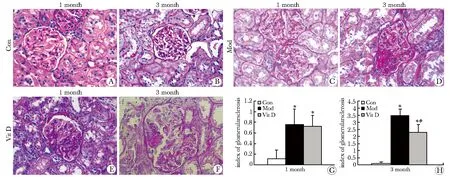
A,B.control; C.PAN model in one month; D.PAN model in three month; E.Vit D rat in one month; F.Vit D rat in three month;*Plt;0.01 compared with control,#Plt;0.01 compared with model; Con,control;Mod,PAN model;Vit D,1,25(OH)2D3
图1不同组大鼠肾小球硬化指数的改变
Fig1Indexofglomerularsclerosisamongdifferentgroup(×400)
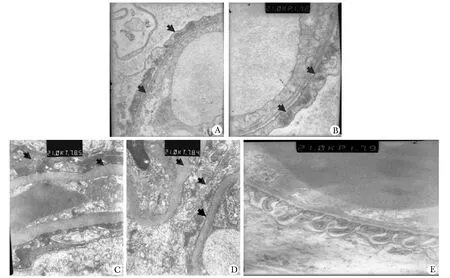
A.rat of PNA mode in one month; B.rat of 1,25(OH)2D3group in one month; C.rat of PNA mode in three month; D.rat of 1,25(OH)2D3group in three montsh; E.control rat
图2不同组大鼠肾小球足突超微结构的改变
Fig2FootprocessUltrastructuralofglomcrulusamongdifferentgroupsbytransmissionelectronmicroscope(×6700)
2.3 Nephrin mRNA和免疫荧光的改变
在正常大鼠nephrin mRNA处在较高水平,PAN后显著降低,VitD组显著促进了nephrin mRNA的表达(图3)。免疫荧光显示正常肾脏大鼠nephrin沿肾小球基底膜线状排列,PAN后荧光强度明显减弱,不连续分布,VitD组处理后nephrin的改变得到部分恢复。
2.4 TRPC6 mRNA表达的改变
TRPC6在正常大鼠表达微弱,PAN模型在1月时表达最强,分布最广,而且与足细胞标志蛋白synaptopodin高度融合;PAN模型组在3月时成局灶节段性改变,与synaptopodin部分融合(图4)。同样发现在正常组大鼠TRPC6 mRNA处在较低水平,PAN注射后显著升高,VitD组TRPC6mRNA表达显著降低(图5)。
3 讨论
VitD特别是活性的1α,25(OH)2D3及其类似物在调节钙磷代谢、降低蛋白尿、延缓慢性肾脏病进展等方面具有重要作用。笔者前期的研究也发现:活性的1α,25(OH)2D3可以抑制嘌呤霉素氨基核苷肾病大鼠足细胞凋亡[5-6]、调控TGF-β1/BMP-7信号的平衡而发挥肾脏的保护作用[7],但1α,25(OH)2D3对肾脏保护的精确机制并不清楚。

*Plt;0.05,**Plt;0.01 compared with Control;#Plt;0.01 compared with Model; Con.control;Mod.PNA model;Mod+Vit D.1,25(OH)2D3group
图31,25(OH)2D3抑制nephrinmRNA表达的下调
Fig31,25(OH)2D3preventsdownregulationofnephrinexpression
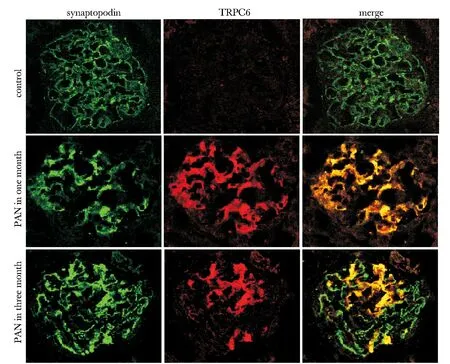
The picture indicated Co-localization of TRPC6(red)and synatopodin (green) in glomerular podocyte in Control rat(top), PNA model one month rat(middle) and PNA model three month rat (bottom)
图4TRPC6在PAN模型中的表达与定位
Fig4TRPC6expressionandlocationinPANratmodel(×400)
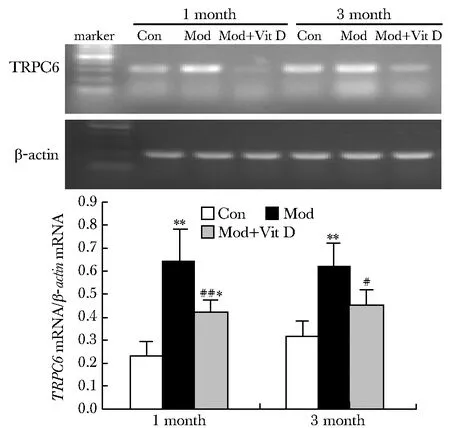
*Plt;0.05,**Plt;0.01 compared with control; #Plt;0.05, ##Plt;0.01 compared with PAN model;Con.control;Mod.PNA model;Mod+Vit D.1,25(OH)2D3 group图5 不同组大鼠TRPC6 mRNA表达的改变Fig 5 TRPC6 mRNA expression and the quantitative results of the band densities in different groups
TRPC6属于瞬时受体电位通道蛋白TRP大家族,是一个含有931个氨基酸的阳离子通道蛋白,尤其对Ca2+有高度选择性。Winn等在家族性局灶节段性肾小球硬化(focal segmental glomerulous sclerosis, FSGS) 的家系中确定存在TRPC6的基因突变[8-9]。随后,在人类非遗传性蛋白尿性肾脏疾病如FSGS、微小病变性肾病(minimal-change disease,MCD)和膜性肾病(memberanous glomerulornephritis,MN)患者中证实TRPC6表达也显著增加[10],说明在获得性蛋白尿的肾脏疾病中也存在TRPC6的活化。TRPC6属于受体介导的钙通道, 其活化主要引起瞬间的Ca2+内流增加。细胞内Ca2+增加既可以起到第2信史、发挥必须的细胞生物学功能,也可以导致足细胞骨架蛋白的过度收缩和细胞凋亡,从而引起足细胞损伤,抑制TRPC6的活化可能是控制蛋白尿性肾脏疾病治疗的新靶点[11-13]。
本实验首次用PAN诱导足细胞损伤大鼠模型观察到TRPC6在PAN大鼠早期表达显著升高,且与足细胞标志蛋白synatopodin高度融合,提示TRPC6主要在足细胞上表达。但在PAN大鼠晚期TRPC6的表达呈局灶节段性改变,说明TRPC6的活化参与了足细胞损伤的过程。但经过1,25(OH)2D3处理的PAN大鼠蛋白尿程度显著降低,肾小球硬化指数和肾小管间质纤维化的指数显著改善,足细胞裂孔隔膜分子nephrin的表达增强,同时TRPC6的表达显著降低,提示1,25(OH)2D3肾脏保护作用与抑制TRPC6的活化有关。
VitD主要与维生素D受体(vitamin D receptor, VDR)结合后发挥功能。VitD抑制TRPC6的确切机制并不十分清楚。笔者推测:在正常的肾脏中VDR处于较高水平,TRPC6处于较低水平,足细胞VDR和TRPC6相互影响共同调节细胞内Ca2+平衡。在病理情况下,由于肾脏1α羟化酶不足,活性维生素D合成减少,VDR处于抑制状态,对TRPC6的抑制作用减弱,导致TRPC6的过度活化导致足细胞损伤。
活性维生素D还可抑制肾素-血管紧张素系统(RAS)[14-15],而后者的激活与TRPC6的表达密切相关。因此,1,25(OH)2D3对TRPC6的抑制作用可能与抑制了RAS系统间接有关。
本实验发现PAN肾病大鼠足细胞TRPC6的表达显著升高,VitD可以显著抑制TRPC6的表达,降低蛋白尿。
[1] Cheng J, Zhang W, Zhang X,etal. Efficacy and safety of paricalcitol therapy for chronic kidney disease: a meta-analysis[J]. Clin J Am Soc Nephrol, 2012, 7:391-400.
[2] Wang Y, Deb DK, Zhang Z,etal. Vitamin D receptor signaling in podocytes protects against diabetic nephropathy[J]. J Am Soc Nephrol, 2012,23:1977-1986.
[3] Woudenberg-Vrenken TE, Bindels RJ, Hoenderop JG. The role of transient receptor potential channels in kidney disease[J]. Nat Rev Nephrol, 2009,5: 441-449.
[4] Sonneveld R, Ferrè S, Hoenderop JG,etal. Vitamin D down-regulates TRPC6 expression in podocyte injury and proteinuric glomerular disease[J]. Am J Pathol, 2013,182:1196-1204
[5] Xiao H, Shi W, Liu S,etal. 1,25-Dihydroxyvitamin D(3) prevents puromycin aminonucleoside-induced apoptosis of glomerular podocytes by activating the phosphatidylinositol 3-Kinase/Akt-signaling pathway[J]. Am J Nephrol, 2009, 30:34-43.
[6] 肖厚勤,史伟,刘双信,等.1,25(OH)2D3抑制嘌呤霉素氨基核苷酸肾病大鼠足细胞凋亡[J].中华肾脏病杂志,2008,24:890-896.
[7] Xiao H, Shi W, Liu S,etal. Podocyte injury was suppressed by 1,25-dihydroxyvitamin D3via modulating TGFβ1/ BMP-7-signaling in puromycin aminonucleoside nephropathy (PAN) rats[J]. Clin Exp Pharmacol Physiol, 2009,36: 682-689.
[8] Winn MP, Conlon PJ, Lynn KL,etal. A mutation in the TRPC6 cation channel causes familial focal segmental glomerulosclerosis[J]. Science, 2005, 308:1801-1804.
[9] Reiser J, Polu KR, Moller CC,etal. TRPC6 is a glomerular slit diaphragm-associated channel required for normal renal function[J]. Nat Genet, 2005, 37:739-744.
[10] Moller CC, Wei C, Altintas MM,etal. Induction of TRPC6 channel in acquired forms of proteinuric kidney disease[J]. J Am Soc Nephrol, 2007, 18:29-36.
[11] Menè P, Punzo G, Pirozzi N. TRP channels as therapeutic targets in kidney disease and hypertension[J]. Curr Top Med Chem, 2013,13:386-397.
[12] Li Z, Xu J, Xu P,etal. Wnt/β-catenin signalling pathway mediates high glucose induced cell injury through activation of TRPC6 in podocytes[J]. Cell Prolif, 2013, 46:76-85.
[13] Liu Y, Ji Z. FK506 alleviates proteinuria in rats with adriamycin-induced nephropathy by down-regulating TRPC6 and CaN expression[J]. J Nephrol, 2012, 25:918-925.
[14] Zhang Y, Kong J, Deb DK,etal. Vitamin D receptor attenuates renal fibrosis by suppressing the renin-angiotensin system[J]. J Am Soc Nephrol, 2010,21:966-973.
[15] Kim MJ, Frankel AH, Donaldson M,etal. Oral cholecalciferol decreases albuminuria and urinary TGF-β1 in patients with type 2 diabetic nephropathy on established renin-angiotensin-aldosterone system inhibition[J]. Kidney Int,2011,80:851-860.
1,25-dihydroxyvitamin D3inhibits TRPC6expression in kidney of nephrosis rat induced by puromycin aminonucleoside
XIAO Hou-qin1,2*, FEI Pei1, CHEN Xin-he1, HU Zhao-xiong1, ZHANG Yong1, LIU Shuang-xin2, SHI Wei2*
(1.Dept. of Nephrology, Taihe Hospital, Hubei University of Medicine, Shiyan 442000;2.Dept. of Nephrology, Guangdong Provincial Peoples’s Hospital, Guangzhou 510080,China)
ObjectiveTo evaluate Effect 1,25-dihydroxyvitamin D3[1,25(OH)2D3]on TRPC6 expression in kidney of rat model in puromycin aminonucleoside nephropathy(PAN).MethodsThirty male Sprague-Dawley rats were randomly divided into three groups: PAN model group (Mon), 1,25(OH)2D3treated group(Vit D) and normal control group (Con). Con and Vit D rat medols were constructed by consecutive three time intravenous injection PAN of 100 mg.kg-1 body weight every ten days and Vit D rats were gavaged 1,25(OH)2D3(0.2 μ g/kg·d). The rats were sacrificed at one and three months respectively after PAN injection. 24-hour urinary protein excretion was determined. Renal Function and blood lipid were determined by an autoanalyzer. The renal tissue morphology was observed with PAS staining by light and electron microscope. The expression of nephrin, TRPC6 mRNA were evaluated by RT-PCR. The protein expression and location of nephrin and TRPC6 were decided by confocal microscope.ResultsPAN administration caused heavy proteinuria, hydroperitoneum, hyperlipoidemia, hypoproteinemia and as well as loss of renal function. Inflammatory cell infiltration, renal interstitial edema, partly renal tubule atrophy, fibrosis and focal segmental gloumerular sclerosis were recorded. 24 h urinary protein[one month, (338±120)mgvs(669±142)mg, three months (432±83)mgvs(601±95) mg,Plt;0.01]; index of gloumeruslocis in three months[(2.3±0.6)vs(3.4±0.4),Plt;0.01]and renal function[Cr(40.2±3.4)μmol/Lvs(53.4±6.3)μmol/L, BUN(9.4±3.0)mmol/Lvs(17.3±2.9)mmol/L,Plt;0.01]were significant lower in Vit D group compared with Mod group, but was not significant difference in blood fat. TRPC6 mRNA expression was increased and nephrin mRNA expression was decreased in PAN rats model. TRPC6 mRNA expression[1 month, (0.42±0.10)vs(0.75±0.14), three months (0.35±0.07)vs(0.68±0.10),Plt;0.01]were significant lower, and nephrin mRNA[one month, (0.81±0.19)vs(0.33±0.09), three months(0.77±0.10)vs(0.44±0.10),Plt;0.01]was significantly higher.ConclusionsTRPC6 mRNA expression increased and Nephrin mRNA expression decreased in PAN rats model. The renoprotective of 1,25(OH)2D3may be partly attributable to TRPC6 suppress.
podocyte; 1,25-dihydroxyvitamin D3; puromycin aminonucleoside; transient recep tor potential cation channel 6
2013-09-17
2013-11-25
湖北省自然科学基金重大项目(2010CDA037);湖北省教育厅重点项目(D20102105); 十堰市太和医院博士启动项目(2010QD02)
*通信作者(correspondingauthor): xiaohq7301@126.com
1001-6325(2014)05-0667-07
R 334+.1
A
