A1AR在低盐刺激小鼠肾素分泌中的可能作用
2014-11-27郝锦玲蒋兰萍施潇潇文煜冰李荣山陈丽萌
郝锦玲,刘 琳,蒋兰萍,施潇潇,文煜冰,李荣山,陈丽萌*
(1.中国医学科学院 北京协和医院 肾内科,北京 100730; 2.山西医科大学 第二医院 肾内科,山西 太原 030000)
#对本文有相同贡献
研究论文
A1AR在低盐刺激小鼠肾素分泌中的可能作用
郝锦玲1,2 #,刘 琳1#,蒋兰萍1,施潇潇1,文煜冰1,李荣山2,陈丽萌1*
(1.中国医学科学院 北京协和医院 肾内科,北京 100730; 2.山西医科大学 第二医院 肾内科,山西 太原 030000)
目的观察腺苷A1型受体(A1AR)基因敲除小鼠的病理生理特点及A1AR在慢性低盐刺激肾素分泌中的作用。方法C57BL/6J品系A1AR基因敲除杂合子(A1AR+/-)小鼠,经繁殖及基因鉴定后,杂合子子代小鼠用于扩大繁殖,A1AR+/+小鼠(n=13)及A1AR-/-小鼠(n=14)用于实验。观察两组小鼠生长发育、基本生理情况(血压、心率、肾功能和血尿电解质)、肾脏病理和免疫组化观察肾脏局部肾素表达和检测血浆醛固酮水平(A1AR+/+组n=5,A1AR-/-组n=5)。结果低盐饮食后,A1AR-/-小鼠肾皮质肾素表达明显增加(Plt;0.05),全身醛固酮水平和24 h尿钾排泄量显著高于A1AR+/+小鼠(Plt;0.05)。结论A1AR可能参与了低盐刺激小鼠肾素分泌的过程。
低盐饮食;A1AR;肾素
肾素血管紧张素系统(renin angiotensin system, RAS)是机体调节水盐平衡和血压最重要的激素,其中肾素作为第1个限速酶起到关键作用,90%的肾素由肾脏肾小球旁器 (juxtaglomerular apparatus, JGA)
颗粒细胞分泌。低盐是调节肾素分泌的三大经典机制之一,它主要通过肾脏肾小球旁器致密斑途径刺激肾素分泌。低盐还降低致密斑分泌ATP代谢的最终产物腺苷(adenosine,A),减少肾小球入球动脉其A1型腺苷受体(A1 adenosine receptor,A1AR)的活化,舒张入球动脉,通过管球反馈(tubuloglomerular feedback, TGF)调节水盐平衡[1-2]。然而腺苷及其受体通过TGF和肾素旁分泌两大途径调节血压的机制尚不清楚,国内因为缺乏研究平台,鲜有相关的研究,本研究引进A1AR-/-小鼠,观察低盐饮食下,该基因敲除小鼠的病理生理特点及A1AR在慢性低盐刺激肾素分泌中的可能作用机制。
1 材料与方法
1.1 A1AR基因敲除动物的引进与育种
C57BL/6J品系A1AR基因敲除杂合子(A1AR+/-)小鼠经繁殖及鉴定后的子代小鼠用于扩大繁殖及实验。根据《中华人民共和国进出境动植物检疫法》及《进出境动物临时隔离检疫场管理办法》要求,对引进小鼠进行为期30d的隔离检疫,检疫结果合格,微生物控制级别符合中国SPF级小鼠要求。按照SPF级实验动物操作规程将小鼠置于动物房独立送风隔离笼具内,室内温度18~22 ℃,湿度50%左右,日光照明。采用1只雄性A1AR+/-小鼠与2只雌性A1AR+/-小鼠同居的方式进行繁殖。记录种鼠产仔率,在仔鼠7~14 d 龄期间对其进行剪指法编号,同时留取剪掉的指端标本用于基因鉴定。
1.2 A1AR基因敲除小鼠的基因鉴定

表1 用于基因鉴定的A1AR和NeoR基因引物序列Table 1 Primer sequence of A1AR and NeoR for genotyping

图1 小鼠DNA鉴定部分结果Fig 1 Results of partial DNA identification
1.3 动物饲养和分组
A1AR+/+小鼠(n=13)和A1AR-/-小鼠(n=14)小鼠置于北京协和医院SPF级实验动物中心,饲养条件同前,饲料由北京科奥协利饲料有限公司提供,正常盐饲料(含NaCl 0.3%,K 0.6%)饲养4周后更换为低盐饮食(含NaCl 0.03%, K 0.6%)。实验第8周处死小鼠。
1.4 血清生化和血浆醛固酮水平的检测
使用内眦静脉丛采血法取得全血,静置2 h后以室温8 000r/min离心10 min,使用全自动生化仪器检测肌酐、尿素氮、尿酸、钠、钾、氯、血糖及三酰甘油等生化指标,其中常规用酶法检测血肌酐,脲酶法检测血尿素氮,尿酸酶法检测血尿酸。部分肝素抗凝血,分离血浆后,放射性免疫的方法测定血浆醛固酮含量[碘(125I)醛固酮放射免疫分析药盒]。
1.5 小鼠尾动脉血压及脉搏的检测
在小鼠清醒状态下,使用小鼠无创血压分析系统BP2000(visitech公司)测定其尾动脉收缩压、舒张压及脉搏。该系统采用光电容积脉搏波描记法(photoplethysmography)通过感受尾部血管扩张和收缩时吸收的光的变化记录血管压力的改变,同时计数脉搏,连续3d每日相同时间测量小鼠血压10次,计算每只小鼠有效收缩压、舒张压及脉搏数据的平均值作为该小鼠该次测量结果。
1.6 24 h尿离子排泄量的检测
实验过程持续约1个月,设计师定期提交作品并集中展示,管理者根据提交作品的评价和引用情况画出协作网络图张贴在展示区供参考。对设计师提交作品的数量无强制要求。
小鼠特制代谢笼(MMC100 metabolic cage, hatteras instruments inc.USA)中饲养小鼠,不限食和饮水。24 h后收集所有尿液,常温下7 000r/min离心10 min,-80 ℃保存用于后续检测,检测方法同血标本。
1.7 肾脏病理标本的处理及观察
腹腔注射1%水合氯醛(300~400 mg/kg)麻醉处死小鼠,低温解剖快速分离单侧肾脏皮质,液氮快速冻存后,-80 ℃冻存备用。另一侧肾脏使用4%甲醛固定肾组织标本48 h以上,常规进行脱水、浸蜡、包埋、切片,行HE、PAS染色。使用Olympus光学显微镜分别在100、200及400倍镜下观察,并用Nikon Digital Sight图像采集系统在相同条件下拍照,收集图像信息。
1.8 肾素免疫组化的染色
石蜡切片(厚度3 μm)脱蜡水化后,枸橼酸盐pH 6.0缓冲液高压修复3 min。用10%正常兔血清封闭非特异性染色60 min。加1∶200稀释的绵阳抗肾素抗体(AF4090,Ramp;D Systems公司)4 ℃孵育过夜,TBS洗3次。再用3% H2O2封闭内源性过氧化物酶15 min,TBS洗3次。滴加1∶500稀释的辣根酶标记兔抗绵羊二抗(E030150,EarthOx公司)。用DAB显色,苏木素复染核,中性树胶封片,具体方法见本实验室常规[3],置显微镜下观察,利用Olympus光学显微镜和Nikon Digital Sight图像采集系统进行拍照。使用Image Pro Plus软件6.0版本进行图片分析,计算平均每个肾小球肾素阳性肾小球旁器区域面积和肾素阳性肾小球旁器与肾小球个数的比值。
1.9 统计学分析

2 结果
2.1 小鼠繁殖及生长情况
雌A1AR+/-小鼠孕期3~4周,每窝产仔6~10只,哺乳期3周。仔鼠雌雄比例约为1∶1。A1AR+/-、A1AR-/-与A1AR+/+C57BL/6J小鼠相比,生长发育及生活习性无明显差异。不同基因型雄鼠与杂合子雌鼠交配繁育后代的基因情况经过Hardy-Weinberg平衡检验,基本符合孟德尔定律(χ2=0.17,P=0.68)(表2)。仔鼠出生2周龄进行标号,标号后至2月龄之内,A1AR+/+仔鼠死亡3只(4.91%),A1AR-/-仔鼠死亡2只(4.65%),二者无显著差异。选用基因型为A1AR+/+和A1AR-/-的小鼠进行后续实验。
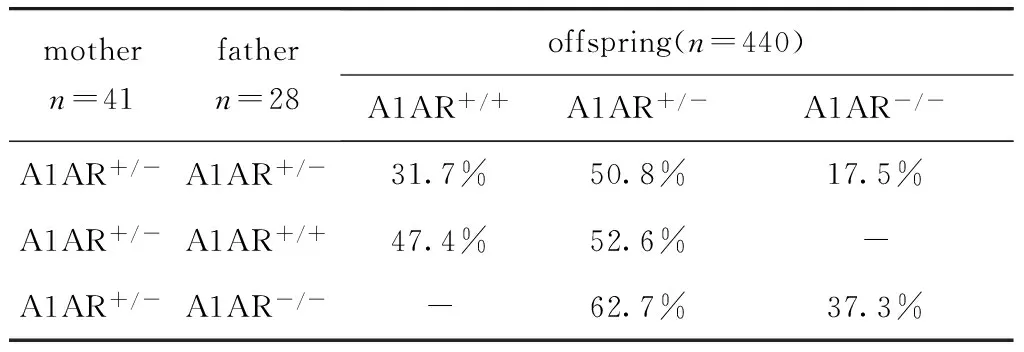
表2 不同基因型小鼠交配后子代的比例
2.2 一般情况和血生化指标
自然生长过程中,各个周龄A1AR-/-与A1AR+/+小鼠质量之间无差异,在2~6周质量处于快速增长期,15周以后,质量变化不大(图2)。其中2周龄A1AR+/+小鼠n=18,A1AR-/-小鼠n=11;6周龄A1AR+/+小鼠n=12,A1AR-/-小鼠n=8;10周龄A1AR+/+小鼠n=25,A1AR-/-小鼠n=10;15周龄A1AR+/+小鼠n=6,A1AR-/-小鼠n=5;20周龄A1AR+/+小鼠n=5,A1AR-/-小鼠n=5。
正常盐饮食和低盐饮食2周后,A1AR-/-小鼠基础收缩压、舒张压及心率与周龄匹配的A1AR+/+小鼠无显著差异。同组小鼠,低盐饮食两周后收缩压和舒张压也无明显差异(表3)。
2.3 肾脏病理的特点
20周时肾脏HE染色和PAS染色,A1AR+/+和A1AR-/-小鼠的肾小球、肾小管间质和血管等无明显差异(图3)。
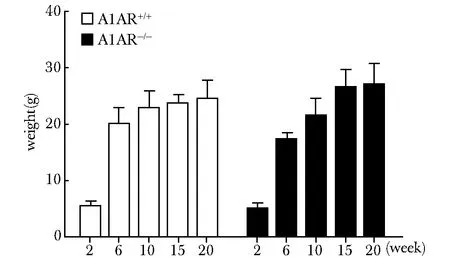
图2 A1AR+/+和A1AR-/-小鼠在各周龄的体质量Fig 2 Body weight of A1AR+/+ and A1AR-/- mice at different ages
低盐饮食下,A1AR-/-小鼠基础状态的肾功能、血清尿酸、电解质、血糖、血脂水平与A1AR+/+小鼠无显著差异(表4)。
2.4 低盐饮食小鼠肾脏肾素表达的差异
A1AR-/-与A1AR+/+小鼠低盐饮食4周,免疫组化染色可见A1AR-/-小鼠肾皮质肾素表达增加(图4)。半定量分析显示,A1AR-/-小鼠肾皮质平均肾素阳性肾小球旁器区域面积和比例显著高于A1AR+/+小鼠(Plt;0.05)(图5)。
2.5 两组小鼠血浆醛固酮及尿电解质排泄量
正常盐饮食组,A1AR+/+与A1AR-/-两组小鼠的血浆醛固酮水平接近;低盐饮食组,A1AR-/-小鼠的血浆醛固酮水平显著高于A1AR+/+小鼠(Plt;0.01)(图6A)。低盐饮食对24 h尿Na+和Cl-的排泄量无明显影响,但A1AR-/-小鼠的K+排泄量明显高于A1AR+/+小鼠(Plt;0.05)(图6B)。
3 讨论
本研究观察到A1AR-/-小鼠在低盐状态下RAS的进一步活化,提示A1AR可能参与了低盐刺激肾素分泌过程中的反馈机制。低盐促使肾素分泌的机制首先是容量降低通过压力感受器直接刺激肾素分泌,上调血管紧张素和醛固酮水平,从而促使远端小管和集合管重吸收钠增加,促进容量的恢复;其次,低容量使到达远端肾小管致密斑的Na+和Cl-浓度降低,通过激动COX2和抑制nNOS的旁分泌途径,促使入球小动脉壁的肾小球旁器颗粒细胞分泌肾素,相关机制分别在体外实验、COX2和nNOS基因敲除小鼠中得到证实[4-5]。在致密斑途径中,因为NaCl主动转运减少,消耗的ATP降低,腺苷产生减少,TGF反应降低,扩张入球小动脉,而主要受血管紧张素Ⅱ调节的出球动脉收缩,单个肾小球的滤过率(glomerular filtration rate, GFR)增加,改善远端小管内的低钠和低氯状态;A1AR基因缺失,低盐对入球动脉的调节作用消失[6-8],肾小球的灌注和远端小管钠和氯离子浓度不能恢复,促使致密斑刺激肾素分泌的机制持续存在,故肾小球旁器肾素及其下游醛固酮增加,尿钾排出增加。此外,有研究表明,分泌肾素的肾小球旁器颗粒细胞上有A1AR受体表达,其活化会直接抑制肾素分泌,A1AR基因敲除,其抑制作用消失,肾素表达也会增加。本研究还在低盐的A1AR基因敲除小鼠中观察到JGA细胞之外的球外系膜细胞和小动脉平滑肌细胞均有肾素表达, 笔者在遗传性失盐性肾病Gitelman综合征也观察到类似情况,从而证实了低盐促使肾素上调的结构基础。

表3 不同饮食时两组小鼠的血压和心率Table 3 The blood pressure and heart rate between A1AR+/+ and A1AR-/-mice with different diets

表4 A1AR+/+及A1AR-/-小鼠血清电解质及肾功能Table 4 The serum electrolytes, renal function in A1AR+/+ and A1AR-/- mice
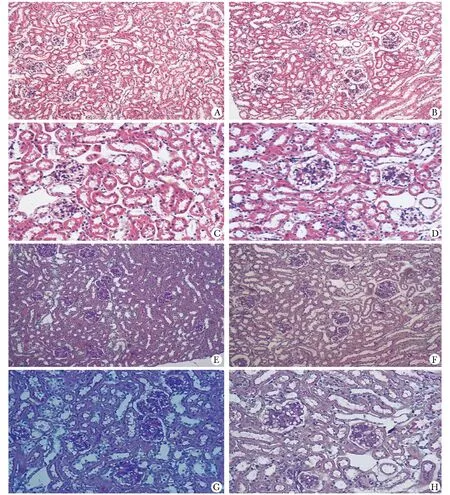
A.A1AR+/+mice(HE×100);B.A1AR-/-mice(HE×100);C.A1AR+/+mice(HE×200);D.A1AR-/-mice(HE×200);E.A1AR+/+mice(PAS×100);F.A1AR-/-mice(PAS×100);G.A1AR+/+mice(PAS×200);H.A1AR-/-mice(PAS×200)
图320周时两组小鼠的肾脏病理
Fig3Kidneypathologypictureat20weeksoldintwogroupsofmice

A.A1AR+/+ mice(×100);B.A1AR-/- mice(×100);C A1AR+/+ mice(×400);D A1AR-/- mice(×400)图4 免疫组化分析肾脏皮质肾素表达Fig 4 Immunohistochemical localization of renin in nephron cortex
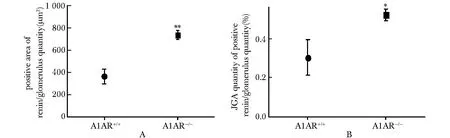
A.the ratio of positive area of renin and glomerulus quantity;B.the percentage of JGA quantity of positive renin and glomerulus quantity;*Plt;0.05,**Plt;0.01 compared with A1AR+/+group
图5免疫组化肾素表达半定量分析
Fig5ThesemiquantitativeanalysisofImmunohistochemicallocalizationofreninexpression(n=4)
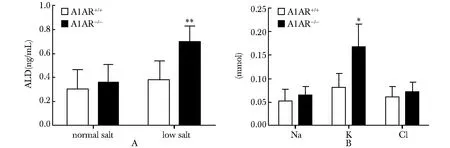
A.plasma aldosterone of two group mice in different diets; B.urine electrolyte excretion during 24 hours of two group mice in low salt diet;*Plt;0.05,**Plt;0.01 compared with A1AR+/+group
图6两组小鼠的血浆醛固酮及尿电解质排泄
Fig6Plasmaaldosteroneandurineelectrolyteexcretionduring24hoursinA1AR+/+andA1AR-/-mice(n=5)
与文献报告相似,尽管RAS活化,A1AR-/-小鼠肾脏血压并没有显著的变化[5,9],影响血压的因素很多,肾素活化并不是决定血压的唯一因素,相对容量的变化可能更为重要,低盐本身是WHO推荐饮食控制血压的重要措施。事实上长期低盐饮食,会下调激活RAS的钠和氯调定点,达成新的平衡。遗憾的是这方面的研究并不多,需要更多的证据来阐明其机制,而利用A1AR-/-小鼠对于更深入研究管球反馈对肾素调控,及其下游血压和水盐的调节作用有重要帮助。
[1] Osswald H, Vallon V, Muhlbauer B. Role of adenosine in tubuloglomerular feedback and acute renal failure[J]. J Auton Pharmacol, 1996, 16: 377-380.
[2] Schnermann J. Juxtaglomerular cell complex in the regulation of renal salt excretion[J]. Am J Physiol,1998, 274: 263-279.
[3] Chen L, Faulhaber-Walter R, Wen Y,etal. Renal failure in mice with Gsalpha deletion in juxtaglomerular cells[J]. Am J Nephrol, 2010, 32: 83-94.
[4] Kim SM, Chen L, Mizel D,etal. Low plasma renin and reduced renin secretory responses to acute stimuli in conscious COX-2-deficient mice[J]. Am J Physiol Renal Physiol, 2007, 292: 415-422.
[5] 陈丽萌,黄宇宁,秦岩,等. 前列腺素E2在肾脏球旁器调节肾素分泌中的作用[J]. 中华肾脏病杂志,2009, 25:217-221.
[6] Nishiyama A, Inscho EW, Navar LG. Interactions of adenosine A1 and A2a receptors on renal microvascular reactivity[J]. Am J Physiol Renal Physiol, 2001, 280: 406-414.
[7] Ren Y, Arima S, Carretero OA,etal. Possible role of adenosine in macula densa control of glomerular hemodynamics[J]. Kidney Int,2002, 61: 169-176.
[8] Hashimoto S, Huang Y, Briggs J,etal. Reduced autoregulatory effectiveness in adenosine 1 receptor-deficient mice[J]. Am J Physiol Renal Physiol, 2006, 290: 888-891.
[9] Lai EY, Martinka P, Fahling M,etal. Adenosine restores angiotensin Ⅱ-induced contractions by receptor-independent enhancement of calcium sensitivity in renal arterioles[J]. Circ Res, 2006, 99: 1117-1124.
Potential role of A1AR in renin secretion stimulated by low salt diet in mice
HAO Jin-ling1,2#, LIU Lin1#, JIANG Lan-ping1, SHI Xiao-xiao1, WEN Yu-bing1,LI Rong-shan2, CHEN Li-meng1*
(1.Dept. of Nephrology, CAMS amp; PUMC, Beijing 100730;2.Dept. of Nephrology, Second Hospital of Shanxi Medical University, Taiyuan 030000,China)
ObjectiveTo observe the pathogenesis of adenosine A1 receptor (A1AR) gene knockout mice and to investigate the role of A1AR in renin secretion stimulated by low salt diet.MethodsAfter A1AR+/-mice of C57BL/6J mating, multiplication and gene identification, offspring mice were sampled. The differences of following items between A1AR+/+(n=13)and A1AR-/-(n=14)mice were recorded: body weight, blood pressure, heart rate, renal function and electrolyte profile of serum and urine; Pathology features were microscopied after regular staining on kidney tissue samples. Renin expression at the kidney was stained by Immunohistochemistry. Plasma aldosterone level was also examined(A1AR+/+group,n=5,A1AR-/-groupn=5).ResultsAfter low salt diet, much higher renin expression of the kidney cortex and plasma aldosterone level was observed in A1AR-/-mice, accompanied with increasing of 24-hour urine potassium excretion (Plt;0.05).ConclusionsA1AR may mediate the renin secretion stimulated by low salt diet in mice.
low salt diet; A1AR; renin
2014-01-09
2014-03-12
科技部973项目(2012CB517803),国家自然科学基金(81170674,30971369)
*通信作者(correspondingauthor):chenlpumch@163.com
1001-6325(2014)05-0615-07
R 322.6
A
