罗格列酮减轻小鼠胆总管梗阻致小肠屏障损伤
2014-11-27彭大颖高志安
宁 强,彭大颖,高志安,3*
(1.辽宁医学院 病理学教研室, 辽宁 锦州 121001; 2.辽河油田总医院 病理科, 辽宁 盘锦 124000;3.辽宁医学院 附属第一医院 病理科, 辽宁 锦州 121001)
罗格列酮减轻小鼠胆总管梗阻致小肠屏障损伤
宁 强1,彭大颖2,高志安1,3*
(1.辽宁医学院 病理学教研室, 辽宁 锦州 121001; 2.辽河油田总医院 病理科, 辽宁 盘锦 124000;3.辽宁医学院 附属第一医院 病理科, 辽宁 锦州 121001)
目的研究胆总管梗阻对小鼠小肠屏障的损伤作用及罗格列酮激活PPARγ对胆总管梗阻小鼠小肠屏障功能的保护作用。方法将小鼠随机分为假手术组、假手术+罗格列酮(PPARγ激动剂)组、模型组、模型+罗格列酮组及模型+罗格列酮+GW9662(PPARγ抑制剂)组。各模型组构建小鼠胆总管结扎(BDL)术致继发性小肠屏障损伤模型。于术前2 d至术后5 d给相应药物。第5天末处死小鼠,检测小肠形态学、生化分析法检测小肠PPARγ通路相关氧化应激和凋亡指标及全身炎症指标;Western blot法检测小肠PPARγ、Occludin、Bcl-2和Bcl-xL蛋白表达。结果模型组小鼠较对照组发生显著肠道屏障损伤和全身炎症损伤,同时肠道PPARγ、Occludin、Bcl-2和Bcl-xL蛋白表达降低(Plt;0.05);模型+罗格列酮组较模型组损伤程度较低,同时上述蛋白表达升高(Plt;0.05);模型+罗格列酮+GW9662组较模型+罗格列酮组损伤程度加重,上述蛋白表达降低(Plt;0.05)。结论罗格列酮激活PPARγ可减轻胆总管梗阻小鼠小肠屏障损伤,表现为减轻形态学损伤、PPARγ通路相关氧化应激及细胞凋亡。
PPARγ;胆总管梗阻;罗格列酮;小肠屏障损伤
胆总管梗阻(common bile duct obstruction,CBDO)是围手术期患者高并发症率和高死亡率的重要原因[1]。若CBDO未引起足够重视,肠道胆汁缺失,可导致小肠菌群失调和肠黏膜屏障破坏,甚至发生肠源性脓毒血症[2]。研究认为,CBDO可引起显著的小肠细菌增殖和小肠屏障功能障碍(intestinal barrier dysfunction, IBD)[2];而口服胆盐可抑制以上损害的发生[3- 4]。早期研究认为胆汁缺失后细菌增殖引起肠道炎性反应,从而破坏肠黏膜屏障[5]。而新近的观点认为,此过程受氧化应激与细胞凋亡的调节[6- 7]。
PPARγ(peroxisome proliferators-activated receptor gamma)是一种配体活化的转录因子,在对抗氧化应激、减轻细胞凋亡和调节肠道炎性反应过程中发挥关键作用[8]。新近研究表明,激活PPARγ可减轻肠道缺血再灌注引起的肠黏膜屏障损伤,增加紧密连接蛋白的表达[9]。提示PPARγ可能在CBDO致IBD的发病过程中发挥重要作用。本研究旨在探讨特异性激活PPARγ可否在CBDO致IBD过程中发挥保护作用。
1 材料与方法
1.1 实验材料
SPF级雄性昆明小鼠,体质量18~22g,[大连医科大学实验动物中心,合格证号SCXK(辽)20080002];PPARγ特异性激动剂罗格列酮(rosiglitazone,RGZ)(Sigma公司,纯度≥98%);PPARγ特异性抑制剂GW9662(百灵威科技,纯度≥98%);小鼠白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)酶联免疫吸附试验(ELISA)试剂盒(武汉博士德公司);超氧化物歧化酶(SOD)、丙二醛(MDA)、还原型谷胱甘肽(GSH)和谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒(南京建成生物工程研究所);原位凋亡(TUNEL)检测试剂(罗氏公司);PPARγ、紧密连接蛋白(occludin)一抗(Abcam公司);Bcl-2一抗(碧云天生物技术研究所);Bcl-xL一抗(武汉三鹰生物技术有限公司);β-actin一抗和辣根过氧化物酶二抗(北京中杉金桥生物技术有限公司)。
1.2 动物分组、模型构建及标本留存
将小鼠50只随机分为:1)假手术组(sham group);2)假手术+罗格列酮组(sham+RGZ group);3)模型组(BDL group);4)模型+罗格列酮组(BDL+RGZ group);5)模型+罗格列酮+GW9662组(BDL+RGZ+GW9662 group)。各模型组按文献报道[4]构建小鼠胆总管结扎(bile duct ligation,BDL)致IBD模型;各假手术组行假手术处理。参照文献报道[10- 11]术前2 d至术后5 d每天腹腔注射给予罗格列酮(10 mg/kg)或GW9662(1 mg/kg);假手术组和模型组给予药物溶媒(DMSO 10%,10 mL/kg)。术后第5天腹主动脉取血处死,提取血清后存放于-80 ℃的环境。同时留末端回肠标本:形态学检测标本保存于10%中性甲醛,生化指标检测标本和Western blot实验标本保存于-80 ℃的环境。
1.3 病理学检测
小鼠小肠组织固定完成后,常规HE染色,100倍光学显微镜下观察并Zhang氏小肠黏膜屏障双盲评分[12]。
1.4 血清TNF-α、IL-6、TB的检测
使用ELISA法,按照试剂盒说明书检测血清TNF-α、IL-6,单位为ng/L。使用生化分析法检测血清TB,单位为μmol/L。
1.5 小肠SOD、MDA、GSH和GSH-PX测定
按试剂盒说明书测定小肠组织SOD、MDA、GSH和GSH-PX。
从表1计算结果可以看出,由于在第9节段增加主动临时横撑可以有效的索塔根部应力,且塔梁异布置施工相对于同步施工在进度、安全上都有明显优势,所以最终确定方案为塔梁异步施工,且在第9节段设置主动临时横撑。
1.6Western-blot检测小肠组织PPARγ、Occludin、Bcl-2和Bcl-xL
常规蛋白提取,变性;经SDS-PAGE电泳分离后将蛋白转印至PVDF膜上;5%脱脂牛奶37 ℃封闭2 h;使用特定一抗孵育(PPARγ,1∶1 000;ZO-1,1∶500;Occludin,1∶500; Bcl-2,1∶1 000;Bcl-xL,1∶1 000),4 ℃过夜。次日以对应二抗孵育并采用ECL发光法显色。发光信号由BioSpectrum-410多功能荧光成像扫描系统记录并以Gel-Pro Analyzer 4.0软件分析,结果以目的蛋白与内参吸光度比值来表示。
1.7 小肠组织原位凋亡的检测
采用TUNEL法检测小肠组织原位凋亡,结果以ImagePro软件扫描荧光强度来表示。
1.8 统计学分析
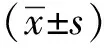
2 结果
2.1 小肠形态学改变
Sham组和sham+RGZ组小肠黏膜形态学未见明显异常。BDL组小肠组织镜下可见较多上皮下间隙,散在溃疡,顶端空泡形成(Plt;0.05)。与BDL相比,BDL+RGZ组仅可见少量顶端空泡,无溃疡形成(Plt;0.05)。而BDL+RGZ+GW9662组较BDL+RGZ组顶端空泡增多(Plt;0.05)。典型病理表现(图1),统计评分(表1)。

表1 小肠形态学评分Table 1 Histologic injury score of intestine in each
*Plt;0.05 compare with Sham group;#Plt;0.05 compare with BDL group;△Plt;0.05 compare with BDL+RGZ group.
2.2 血清TNF-α、IL-6和TB的测定
与sham组相比,BDL组血清IL-6和TNF-α水平显著升高(Plt;0.05)。与BDL相比,BDL+RGZ组IL-6和TNF-α水平显著降低(Plt;0.05),但在BDL+RGZ+GW9662组IL-6和TNF-α水平较BDL+RGZ组显著升高(Plt;0.05),总胆红素模型组较假手术组显著升高(Plt;0.05)(表2)。

图1 各组小肠形态学改变Fig 1 Histologic appearance of intestine in each group(HE×100)

表2 血清TNF-α、IL-6和TB的测定Table 2 Measurement of Serum TNF-α, IL-6 and TB (±s, n=10)
*Plt;0.05 compared with Sham group;#Plt;0.05 compared with BDL group;△Plt;0.05 compared with BDL+RGZ group.
2.3小肠组织SOD、MDA、GSH和GSH-PX的测定
BDL组与sham组相比,小肠组织SOD活性、GSH含量、GSH-PX活性显著降低(Plt;0.05),MDA含量显著升高(Plt;0.05);与BDL组相比,BDL+RGZ组小肠组织SOD活性、GSH含量、GSH-PX活性显著升高(Plt;0.05),MDA含量显著降低(Plt;0.05);与BDL+RGZ组相比,小肠组织SOD活性、GSH含量、GSH-PX活性显著降低(Plt;0.05),MDA含量显著升高(Plt;0.05)(表3)。
2.4小肠组织PPARγ、Occludin、Bcl-2和Bcl-xL的Western-blot检测
与sham组相比,sham+RGZ组PPARγ表达显著增高(Plt;0.05),而BDL组PPARγ表达显著降低(Plt;0.05),同时BDL组Occludin、Bcl-2和Bcl-xL表达也显著降低(Plt;0.05);与BDL组相比,BDL+RGZ组PPARγ、Occludin、Bcl-2和Bcl-xL表达显著增高(Plt;0.05);与BDL+RGZ组相比,BDL+RGZ+GW9662组PPARγ、Occludin、Bcl-2和Bcl-xL表达显著降低(Plt;0.05)(图2)。
2.5 小肠组织原位凋亡检测
与sham 组相比,BDL组小肠组织凋亡阳性细胞显著增多(Plt;0.05)。与BDL组相比,BDL+RGZ组可见凋亡阳性细胞数较少(Plt;0.05)。而BDL+RGZ +GW9662组较BDL+RGZ组凋亡阳性细胞增多(Plt;0.05)(图3)。
3 讨论
CBDO可由多种良恶性因素引起,主要包括胆总管结石、术后胆管狭窄,胆总管及其毗邻癌肿的压迫等。CBDO尤其常见于围手术期患者,不仅会引起胆汁淤积、继发胆道感染,同时CBDO使肠道内胆盐缺乏,继发IBD,以致肠道内细菌入血而引起内毒素血症[2,13],是围手术期患者并发症率和死亡率升高的重要原因,严重影响了患者的预后。
本研究利用BDL构建CBDO模型,首次发现PPARγ在小鼠BDL继发IBD发病过程中的重要作用。PPARγ特异性激动剂RGZ预处理显著改善小鼠BDL引起的小肠组织形态学损伤和小肠紧密连接蛋白的表达水平的降低。在BDL模型组,可观察到小鼠全身炎症损伤,血清炎性细胞因子水平提高,这可能与肠黏膜屏障损伤导致细菌入血有关;而PPARγ表达增高后全身炎性反应程度减轻,与肠黏膜损伤的减轻和肠屏障关键因子——Occludin的表达水平呈正相关。既往研究认为,氧化应激是CBDO引起IBD的关键环节[6- 7],而PPARγ又是调控机体氧化应激的经典因子,可减轻对氧化应激时GSH系统失衡[14]。在本研究中,小鼠BDL引起小肠氧化应激,表现为肠道SOD活性降低、脂质过氧化和GSH系统功能失衡;而RGZ预处理组在提高PPARγ表达的同时显著减轻了GSH耗竭、GSH-PX酶活力下降,降低了小肠组织氧化应激水平。既往研究指出在大鼠CBDO继发IBD模型中肠上皮细胞凋亡,损害了肠道的正常功能[7],而PPARγ对重要抗凋亡因子Bcl家族的表达起显著上调作用[15]。在本研究中,TUNEL显示小鼠BDL引起肠上皮细胞发生凋亡,RGZ预处理组的肠黏膜凋亡较BDL组显著减轻,同时抗凋亡蛋白Bcl-2、Bcl-xL表达水平高于BDL组。RGZ预处理上调了PPARγ表达,从以上多个方面保护了BDL导致的小鼠肠黏膜屏障损伤和全身炎性反应。与此对应,PPARγ特异性抑制剂GW9662预处理在此模型中可部分拮抗RGZ的保护作用,进一步验证了PPARγ的激活在小鼠CBDO继发IBD模型中的关键作用。

表3 小肠组织SOD、MDA、GSH和GSH-PX的测定Table 3 Measurement of intestinal SOD, MDA, GSH and GSH-PX levels(±s, n=10)
*Plt;0.05 compared with Sham group;#Plt;0.05 compared with BDL group;△Plt;0.05 compared with BDL+RGZ group.

A.sham group;B.sham+RGZ group;C.BDL group;D.BDL+RGZ group;E.BDL+RGZ+GW9662 group;*Plt;0.05 compared with sham group;#Plt;0.05 compared with BDL group;△Plt;0.05 compared with BDL+RGZ group
图2各组小肠组织PPARγ、Occludin、Bcl-2和Bcl-xL蛋白表达
Fig2WesternblotanalysisofPPARγ,Occludin,Bcl-2andBcl-xLintheintestine

*Plt;0.05 compared with sham group;#Plt;0.05 compared with BDL group;△Plt;0.05 compared with BDL+RGZ group
图3小肠原位凋亡检测
Fig3Apoptoticanalysisofintestineineachgroup
综上,RGZ激活 PPARγ在CBDO致IBD的发病过程中可起到保护作用,此作用与PPARγ信号激活对其下游抗氧化应激和抗凋亡信号的增强有关。因此,对PPARγ信号通路的调控可能成为防治CBDO引起IBD的重要策略,具有显著的临床意义。
[1] Ingoldby CJ, Mcpherson GA, Blumgart LH. Endotoxemia in human obstructive jaundice. Effect of polymyxin B[J]. Am J Surg, 1984, 147:766- 771.
[2] Berg RD. Bacterial translocation from the gastrointestinal tract[J]. Trends Microbiol, 1995, 3:149- 154.
[3] Evans HJ, Torrealba V, Hudd C,etal. The effect of preoperative bile salt administration on postoperative renal function in patients with obstructive jaundice[J]. Br J Surg, 1982, 69:706- 708.
[4] Inagaki T, Moschetta A, Lee YK,etal. Regulation of antibacterial defense in the small intestine by the nuclear bile acid receptor[J]. Proc Natl Acad Sci U S A, 2006, 103:3920- 3925.
[5] Yamada T, Deitch E, Specian RD,etal. Mechanisms of acute and chronic intestinal inflammation induced by indomethacin, Inflammation[J]. 1993, 17:641- 662.
[6] Assimakopoulos SF, Scopa CD, Zervoudakis G,etal. Bombesin and neurotensin reduce endotoxemia, intestinal oxidative stress, and apoptosis in experimental obstructive jaundice[J]. Ann Surg, 2005, 241:159- 167.
[7] Wang P, Gong G, Wei Z,etal. Ethyl pyruvate prevents intestinal inflammatory response and oxidative stress in a rat model of extrahepatic cholestasis[J]. J Surg Res, 2010, 160:228- 235.
[8] Naito Y, Yoshikawa T. PPARgamma as a new therapeutic target in inflammatory diseases[J]. Nihon Rinsho, 2010, 68:341- 349.
[9] Wang X, Pan L, Lu J,etal. N-3 PUFAs attenuate ischemia/reperfusion induced intestinal barrier injury by activating I-FABP-PPARgamma pathway[J]. Clin Nutr, 2012, 31:951- 957.
[10] Kim MG, Yang HN, Kim HW,etal. IL-10 mediates rosiglitazone-induced kidney protection in cisplatin nephrotoxicity[J]. J Korean Med Sci, 2010, 25:557- 563.
[11] Kogiso M, Shinohara T, Dorey CK,etal. Role of PPARgamma in COX-2 activation in mycobacterial pulmonary inflammation[J]. Inflammation, 2012, 35:1685- 1695.
[12] Zhang HY, Radulescu A, Besner GE. Heparin-binding epidermal growth factor-like growth factor is essential for preservation of gut barrier function after hemorrhagic shock and resuscitation in mice[J]. Surgery, 2009, 146:334- 339.
[13] Deitch EA, Sittig K, Li M,etal. Obstructive jaundice promotes bacterial translocation from the gut[J]. Am J Surg, 1990, 159:79- 84.
[14] Bergamo P, Luongo D, Maurano F,etal. Conjugated linoleic acid enhances glutathione synthesis and attenuates pathological signs in MRL/MpJ-Fas(lpr) mice[J]. J Lipid Res, 2006, 47:2382- 2391.
[15] Wu JS, Lin TN, Wu KK. Rosiglitazone and PPAR-gamma overexpression protect mitochondrial membrane potential and prevent apoptosis by upregulating anti-apoptotic Bcl-2 family proteins[J]. J Cell Physiol, 2009, 220:58- 71.
Rosiglitazone ameliorates intestinal barrier dysfunction induced by bile duct obstruction in mice
NING Qiang1, PENG Da-ying2, GAO Zhi-an1,3*
(1.Dept. of Pathology, Liaoning Medical University, Jinzhou 121001; 2.Dept. of Pathology, General Hospital of Liaohe Oil Field,Panjin 124000; 3.Dept. of Pathology, the First Affiliated Hospital of Liaoning Medical University, Jinzhou 121001, China)
ObjectiveTo investigate the alteration of bile duct ligation (BDL) induced intestinal barrier dysfunction in mice and the potential protective effect of PPARγ pathway activation.MethodsThe mice were divided into five groups randomly: Sham group, Sham+RGZ group, BDL group, BDL+RGZ group and BDL+RGZ+GW9662 group. The model was developed into intestinal barrier dysfunction by bile duct ligation mice. Mice were treated with RGZ, GW9662 or vehicle for 2 days before surgery and 5 days after. Blood and tissue samples were collected at the end of day 5. Intestinal morphological alteration were assessed, PPARγ associated oxidative stress and apoptosis and systematic inflammations of each group were determined by biochemical analysis; Protein expressions of PPARγ, Occludin, Bcl-2 and Bcl-xL in each group were evaluated by western blot.ResultsBDL resulted in significant damage in intestinal barrier and severe systematic inflammation, accompanied by the protein expression of PPARγ, Occludin, Bcl-2 and Bcl-xL suppression (Plt;0.05); Pretreatment of RGZ significantly improved BDL induced intestinal injury and systematic inflammation, and up-regulated the protein expression of PPARγ, Occludin, Bcl-2 and Bcl-xL in the intestine(Plt;0.05). However, such protective effects were ameliorated in the BDL+RGZ+GW9662 group(Plt;0.05).ConclusionsPPARγ activation by rosiglitazone plays a protective role in intestinal barrier dysfunction induced by BDL in mice. This protective effect may be attributed to the anti-oxidant and anti-apoptosis properties of PPARγ.
PPARγ;common bile duct obstruction;rosiglitazone;intestinal barrier dysfunction
2013- 07- 15
2013- 10- 28
*通信作者(correspondingauthor): gaozhianln@126.com
1001-6325(2014)07-0968-06
研究论文
R 656.7
A
