siRNA沉默CD55基因对胰腺癌BxPC-3细胞生物学行为的影响
2014-11-27万荣华
何 政,吴 慧,万荣华,郑 军
(三峡大学 第一临床医学院 肝胆脾胰外科,湖北 宜昌 443002)
siRNA沉默CD55基因对胰腺癌BxPC-3细胞生物学行为的影响
何 政,吴 慧,万荣华,郑 军*
(三峡大学 第一临床医学院 肝胆脾胰外科,湖北 宜昌 443002)
目的探讨小分子干扰RNA(siRNA)沉默衰亡加速因子(CD55)基因对胰腺癌细胞增殖的影响。方法针对CD55基因设计3对siRNA,转染胰腺癌BxPC-3细胞,用实时定量PCR和Western blot检测CD55 mRNA和蛋白的表达,并用流式细胞术检测细胞生物学行为的改变。结果转染BxPC-3细胞48 h后,3条siRNA中仅siRNA3能显著抑制CD55 mRNA和蛋白的表达,细胞凋亡比率显著增加(Plt;0.05);细胞增殖率显著减少(Plt;0.05);细胞G1/G0期升高,G2期变化不明显,S期下降(Plt;0.05)。结论使用siRNA能够有效地沉默CD55基因的表达,并显著影响胰腺癌细胞的生物学行为。
胰腺癌;RNA干扰;CD55;细胞凋亡;细胞增殖;细胞周期
胰腺癌为常见消化道恶性肿瘤之一,手术根治率较低,且对放化疗均不敏感,胰腺癌根治性手术患者的总体术后的5年生存率lt;5%,迫切需要找到新的治疗策略[1- 3]。CD55基因是本实验室通过基因芯片筛选胰腺癌、癌旁组织找到的差异基因之一,其在多种恶性肿瘤组织及大多数胰腺癌细胞系中过量表达[4- 5]。本实验用小分子干扰RNA(small interference RNA,siRNA)下调人胰腺癌细胞CD55基因表达后观察其对细胞凋亡、细胞周期及细胞增殖的影响。
1 材料与方法
1.1 材料
胰腺癌BxPC-3细胞(北京肿瘤研究所);1640培养基(Gibco公司);3对siRNA设计和合成(广州锐博生物公司),其中阴性对照序列由广州锐博生物公司持有,不对外公开(表1);Annexin V-PE/7-AAD 试剂盒(BD公司);荧光实时定量PCR试剂盒(SYBR® Premix Ex TaqTM)(TaKaRa公司);流式细胞仪(FACSAria公司);BrdU染色试剂盒(In Situ Cell Proliferation Kit,FLUOS)(Roche公司)
1.2 实验方法
1.2.1 细胞培养及分组处理:人胰腺癌BxPC-3细胞系常规培养。按照锐博生物公司说明书转染siRNA。转染siRNA、阴性对照siRNA的人胰腺癌BxPC-3细胞分别为干扰组、对照组,未转染的人胰腺癌BxPC-3细胞为空白组。
1.2.2 Western blot检测BxPC-3细胞蛋白的表达:以RIPA裂解液提取蛋白,BCA法进行蛋白定量。配制10%聚丙烯酰胺凝胶,每条泳道加25 μg蛋白电泳分离,以恒定电流持续转膜约70 min;室温下以含5%脱脂奶粉的蛋白封闭液持续封闭2 h,4 ℃兔抗人CD55一抗(1∶200)孵育过夜,以二抗(1∶5 000)室温振荡孵育1 h后蛋白封闭液洗膜。加入ECL试剂暗室显色、曝光。用Image J对胶片半定量分析。
1.2.3 qRT-PCR检测:消化转染48 h的细胞,Trizol裂解法抽提细胞中总RNA; 以紫外分光光度法测定总RNA浓度。根据反转录试剂盒进行操作合成cDNA,具体反转录条件如下:37 ℃ 15 min,85 ℃ 5 s。随后进行Real Time PCR反应:按说明书操作。反应条件如下:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸20 s;反应40个循环。CD55上、下游引物序列为5′-CATGATTGGAGAGCACTCTATTT ATTG-3′和5′-TTGGTGGGACCTTGGAAGTTAG-3′。β-actin上、下游引物序列为5′-TGAGG CACTCTTCC AGCCTT-3′和5′-CACTTCATGATGGAGTTGAAGGT AGT-3′。样本目的基因及内参基因(β-actin)循环阈值的差值记作△Ct,选其中一个样本作为对照样本,各样本与对照样本的△Ct差值记作△△Ct。目的基因相对表达量记作2-△△Ct。
1.2.4 流式细胞仪检测细胞凋亡率:将细胞接种于6孔板内,置细胞培养箱中培养,当细胞汇合度约80%时用胰蛋白酶消化收获细胞,按AnnexinV-PE/7-AAD试剂盒说明书操作,流式细胞仪分析细胞凋亡率。
1.2.5 BrdU流式细胞检测细胞增殖率:将细胞接种于6孔板内,置细胞培养箱中培养,当细胞汇合度约80%时用胰蛋白酶消化收获细胞,按BrdU染色试剂盒说明书操作,流式细胞仪分析细胞增殖状态。
1.2.6 流式细胞仪分析细胞周期:将细胞接种于6孔板内,置细胞培养箱中培养,当细胞汇合度约80%时用胰蛋白酶消化收获细胞,按RNase及PI试剂说明书操作,使用FACSAria公司流式细胞仪分析细胞增殖状态。
1.3 统计学分析


表1 CD55 siRNA引物序列Table 1 The sequence of CD55 siRNA primer
2 结果
2.1siRNA对胰腺癌细胞BxPC-3CD55表达的影响
3条siRNA中仅CD55 siRNA-3能显著抑制CD55 mRNA和蛋白的表达,选择CD55 siRNA-3片段进行后续实验(图 1,2)。
2.2 流式细胞仪检测细胞凋亡
干扰组细胞凋亡比率较空白组和对照组显著增加(Plt;0.05)(表2,图 3)。
2.3 BrdU细胞流式检测细胞增殖率
干扰组增殖率较空白组和对照组减少(Plt;0.05)(表 3,图 4)。
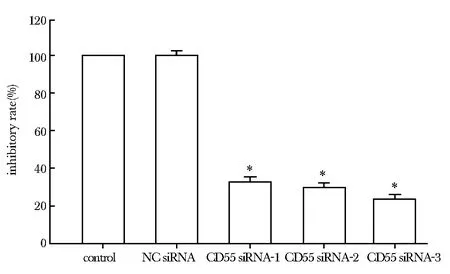
*Plt;0.05 compared with NC siRNA图1 各组细胞CD55 mRNA表达及相对抑制率Fig 1 Expression of mRNA in each group and relative inhibitory rate
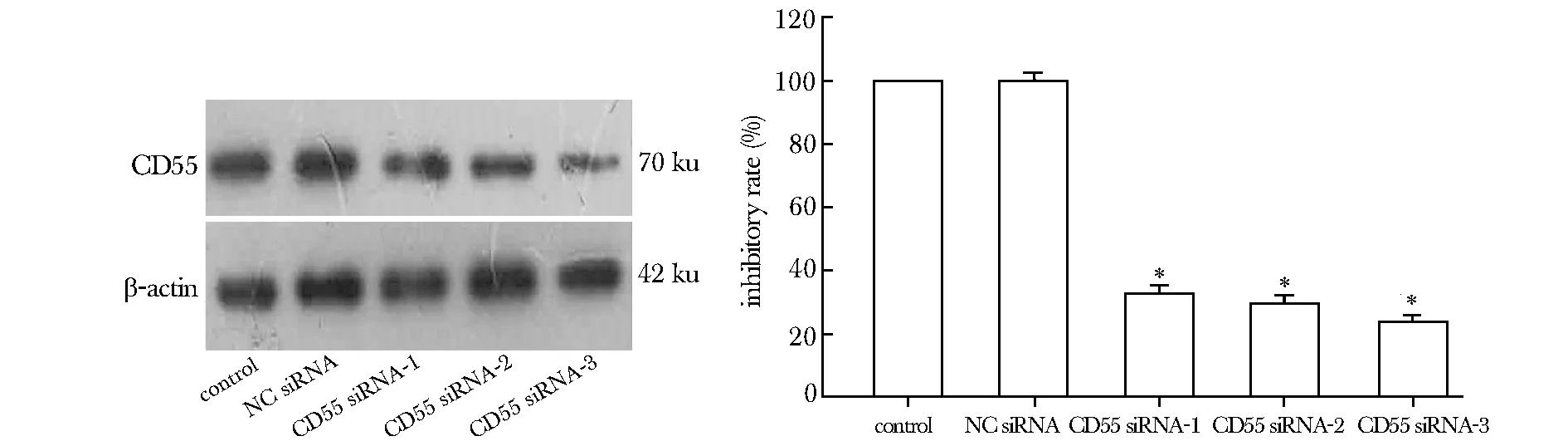
*Plt;0.05 compared with NC siRNA图2 各组细胞CD55蛋白表达及相对抑制率Fig 2 Expression of protein in each group and relative inhibitory rate

表2 流式细胞仪检测BxPC-3细胞凋亡结果Table 2 Effect of CD55 gene silencing on apoptosis of BxPC-3 cells by flow cytometry(%,±s,n=3)
*Plt;0.05 compared with control;#Plt;0.05 compared with NC siRNA.

图3 流式细胞仪检测BxPC-3细胞凋亡结果Fig 3 Effect of CD55 gene silencing on apoptosis of BxPC-3 cells by flow cytometry
2.4 流式细胞仪检测细胞周期
与空白组和对照组相比,干扰组细胞G1/G0期升高,G2期变化不明显,S期下降(Plt;0.05)(表 4,图 5)。

表3 BrdU流式细胞检测细胞增殖率 Table 3 Effect of CD55 gene silencing on proliferation of BxPC-3 cells by BrdU staining flow cytometry(%, ±s,n=3)
*Plt;0.05 compared with control;#Plt;0.05 compared with NC siRNA.
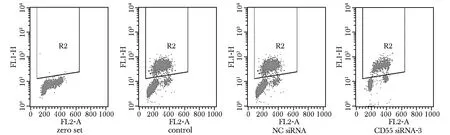
图4 BrdU流式细胞检测细胞增殖率 Fig 4 Effect of CD55 gene silencing on proliferation of BxPC-3 cells by BrdU staining flow cytometry

表4 流式细胞仪检测细胞周期Table 4 Effect of CD55 gene silencing on cell cycle of BxPC-3 cells by flow cytometry(%, ±s,n=3)
*Plt;0.05 compared with control;#Plt;0.05 compared with NC siRNA.
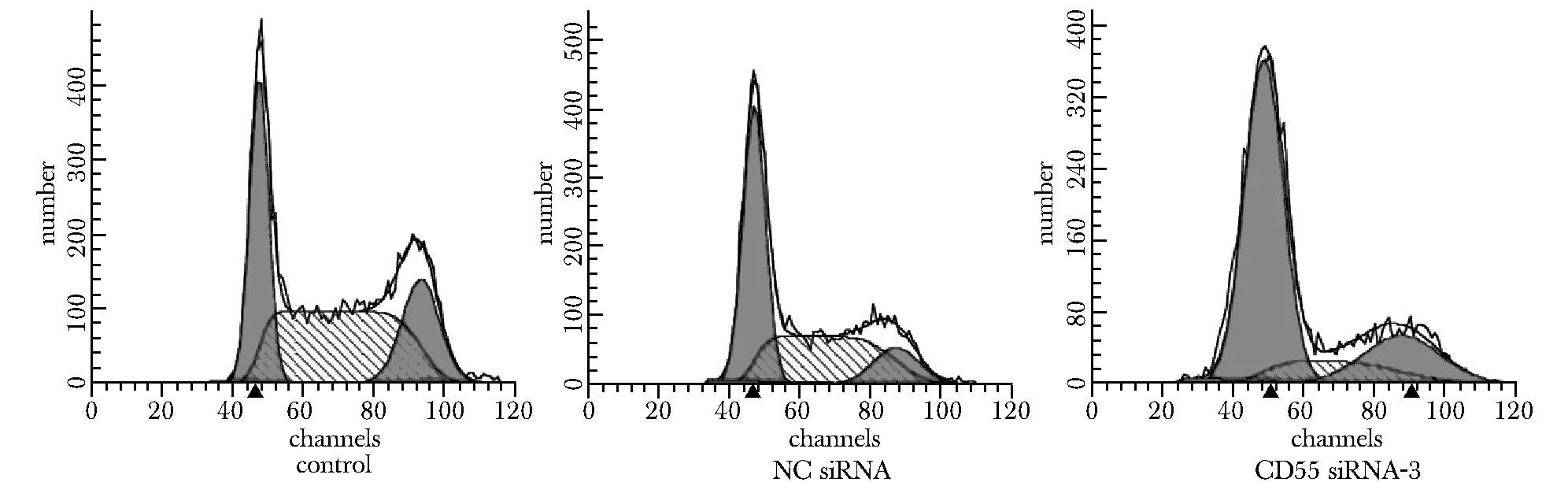
图5 流式细胞仪检测细胞周期 Fig 5 Effect of CD55 gene silencing on cell cycle of BxPC-3 cells by flow cytometry
3 讨论
衰变加速因子(decay accelerating factor,DAF),又名CD55基因,是作者通过基因芯片技术[6]筛选到的癌/癌旁肿瘤差异基因之一。CD55几乎分布于全部细胞[7],主要功能是通过抑制补体的经典及旁路的激活防止损害宿主自身组织[8]。既往研究已在转录和翻译水平上证实乳腺癌、胃癌、结直肠癌、卵巢癌的细胞及食道癌的鳞状细胞、甲状腺的髓质CD55过表达,并且与肿瘤的不良预后显著相关[9]。
既往研究证实DAF表达可由前列腺素E2经G蛋白/CAMP/PKA途径上调,作用4 h后在mRNA水平可提高至20倍,而蛋白水平则提高至2倍,且可维持24 h[10],而前列腺素E2可促进肿瘤转移、侵袭和新生。既往研究报道CD55过度表达在多种癌组织包括胰腺癌细胞系中[4- 5],具体机制不清,探讨CD55基因的生物学作用有助于揭示CD55基因在肿瘤发展中的角色。
小分子干扰技术近年来被广泛应用于基因功能分析和疾病治疗研究[11],本实验以人胰腺细胞系BxPC-3作研究对象,针对CD55基因设计3对siRNA,通过脂质体Lipofectamine 2000转染胰腺癌BxPC-3细胞系,用实时荧光定量PCR和Western blot免疫印迹方法挑选能显著抑制CD55表达的siRNA后,并以其转染胰腺癌BxPC-3细胞,用流式细胞术观察到小分子干扰RNA下调人胰腺癌细胞CD55表达后对细胞凋亡、细胞周期及细胞增殖的影响。结果提示,用小分子干扰RNA抑制后BxPC-3细胞凋亡率增加,增殖率减小,细胞G1期升高,G2期变化不明显,S期下降,与预期结果符合。既往研究证明细胞凋亡、增殖和周期等生物学行为变化与肿瘤发生密切相关[12],CD55作为肿瘤细胞信号分子有促肿瘤细胞增生的作用[13]。人宫颈癌细胞系中抑制CD55可能诱导细胞增殖率减小[14]。本实验结果揭示CD55基因表达可能在一定水平上促进胰腺肿瘤细胞增殖,但是相关机制需进一步探讨。
[1] Kleeff J, Michalski C, Friess H,etal. Pancreatic cancer: from bench to 5-year survival [J]. Pancreas, 2006,33:111- 118.
[2] Schneider G, Siveke JT, Eckel F,etal. Pancreatic cancer: basicand clinical aspects [J]. Gastroenterology, 2005,128: 1606- 1625.
[3] 杨小燕,张玉祥,王泽生.胰腺癌BxPC3细胞中Src激酶对Notch-1活化的调节[J].基础医学与临床, 2008,28: 964- 968.
[4] Juhl H, Helmiq F, Baltzer K,etal. Frequent expression of complement resistance factors CD46, CD55, and CD59 on gastrointestinal cancer cells limits the therapeutic potential of monoclonal antibody 17-1A[J]. J Surg Oncol, 1997,64:222- 230.
[5] Gorter A, Meri S. Immune evasion of tumor cell using membrane-bound complement regulatory proteins [J].Immunol Today, 1999,20:576- 582.
[6] 廖长秀,汪晖,平洁,等.基因芯片技术研究乙醇对肝星状细胞增殖及其CYP450亚型表达的影响[J].基础医学与临床, 2008,28: 988- 989.
[7] Nicholson-Weller A, March JP, Rosen CE,etal. Surface membrane expression by human blood leukocytes and platelets of decay-accelerating factor, a regulatory protein of the complement system[J]. Blood, 1985,65:1237- 1244.
[8] Atkinson JP, Oglesby TJ, White D,etal. Separation of self from non-self in the complement system: a role for membrane cofactor protein and decay accelerating factor[J]. Clin Exp Immunol,1991, 86: 27- 30.
[9] Mustafa T, Klonisch T,Hombach-Klonisch S,etal. Expression of CD97 and CD55 in human medullary thyroid carcinomas[J ]. Int J Oncol,2004,24:285- 294.
[10] Holla VR, Wang D,Brown JR,etal. Prostaglandin E2 regulates the complement inhibitor CD55/ decay-accelerating factor in colorectal cancer[J]. J Biol Chem,2005,280: 476- 483.
[11] 程晓刚,叶琬,张绍兰,等.SiRNA沉默Jab1表达抑制肝癌细胞增殖[J].基础医学与临床, 2012,32: 1288- 1292.
[12] 王维斌,赵玉沛,廖泉,等.BHLHB2 在人胰腺癌细胞株SU86.86的生物学功能研究[J].基础医学与临床, 2012,32: 300- 304.
[13] Morgan J, Spendlove I, Durrant LG. The role of CD55 in protecting the tumour environment from complement attack[J]. Tissue Antigens,2002,60:213- 223.
[14] Gao LJ, Guo SY, Cai YQ,etal. Cooperation of decay-accelerating factor and membrane cofactor protein in regulating survival of human cervical cancer cells[J ]. BMC Cancer, 2009,9:384.
Effect of siRNA-mediated silencing of the accelerating factor (CD55) on biological behaviour of human pancreatic cancer cell line BxPC-3
HE Zheng, WU Hui, WAN Rong-hua, ZHENG Jun*
(Dept. of Hepatopancreatobiliary Spleen Surgery, the First Clinical Medical College of Three Gorges University, Yichang 443002, China)
ObjectiveTo study the specific effect of silencing ofCD55 gene by small interfering RNA (siRNA) on the growth of human pancreatic cancer cell line BxPC-3.MethodsThree CD55-specific siRNAs and one negative siRNA were designed and then transfected into human pancreatic cancer cell line BxPC-3 by Lipofectamine 2000.Quantitative real-time PCR(qRT-PCR) and Western blot were used to check the expression of CD55 mRNA and protein respectively. And flow cytometry were used to detect apoptosis, proliferation and cell cycle of target cells.ResultsOne of three CD55-specific siRNAs, siRNA3 silenced the expression of theCD55 gene. The expression of CD55 mRNA and protein remarkably decreased. The cells transfected with siRNA3 were found to increase apoptosis and reduce proliferation significantly(Plt;0.05); the target cells stagnated in phase G1after transfection(Plt;0.05).ConclusionssiRNA-mediated silencing ofCD55 can effectively affect the biological behavior of human pancreatic cancer cell line BxPC-3.
pancreatic carcinoma; RNA interference; CD55; cell apoptosis; cell proliferation; cell cycle
2013- 11- 11
2014- 03- 25
*通信作者(correspondingauthor): 805226494@qq.com
1001-6325(2014)07-0974-05
研究论文
R 735.9
A
