异硫氰酸苯乙酯通过PI3K-NF-κB-MMP-9途径抑制结肠癌SW480 细胞的迁移和侵袭
2014-11-27魏付桥谢文彪申清香刘昌化罗康宁
魏付桥,谢文彪*,申清香,刘昌化,罗康宁
(南华大学 附属第二医院 1.胃肠外科; 2.妇产科, 湖南 衡阳 421001)
异硫氰酸苯乙酯通过PI3K-NF-κB-MMP-9途径抑制结肠癌SW480 细胞的迁移和侵袭
魏付桥1,谢文彪1*,申清香2,刘昌化1,罗康宁1
(南华大学 附属第二医院 1.胃肠外科; 2.妇产科, 湖南 衡阳 421001)
目的观察异硫氰酸苯乙酯(PEITC)对结肠癌细胞SW480增殖侵袭的分子机制。方法体外培养结肠癌细胞系SW480,分别用10,30和50 μmol/L PEITC作用24 h,MTT法检测细胞的增殖;伤口愈合实验和侵袭实验分别检测PEITC对SW480细胞迁移与侵袭的影响。荧光共振能量转移法检测基质金属蛋白酶9(MMP-9)的活性,RT-PCR检测MMP-9 mRNA表达情况;Western blot检测PI3K和PTEN的表达和Akt、mTOR磷酸化,以及NF-κB核转位情况。荧光素酶报告基因分析NF-κB的活性。最后,建立裸鼠异种移植瘤动物模型,观察PEITC对异种移植瘤生长的抑制作用。结果PEITC能在不影响细胞活性的条件下显著抑制SW480细胞侵袭和迁移(Plt;0.05),也能抑制MMP-9的酶活性以及mRNA表达(Plt;0.05)。同时PEITC能抑制PI3K的表达以及抑制Akt和mTOR磷酸化(Plt;0.05),上调PTEN表达。PEITC也能抑制NF-κB核转位,并能降低其活性(Plt;0.05)。此外,PEITC也能抑制裸鼠异种移植瘤的生长(Plt;0.05)。结论PEITC是一种潜在的抗结肠癌细胞转移药物,它可能通过影响PI3K/Akt和NF-κB通路发挥作用。
异硫氰酸苯乙酯;SW480细胞;基质金属蛋白酶9;PI3K/Akt;核转录因子κB
结肠癌是胃肠外科最常见的恶性肿瘤。据统计,全世界每年新发病例可达120万人以上。和其他恶性肿瘤一样,90%以上结肠癌患者死于癌细胞的侵袭和转移[1- 3]。在此过程中,基质金属蛋白酶(matrix metalloproteinases,MMPs)介导的细胞外基质(extracellular matrix ECM)降解中发挥重要作用[4]。在所有的MMPs中,以MMP-9(明胶酶B)最重要。因此以MMP-9为治疗靶点,对结肠癌的治疗具有重要意义。
异硫氰酸苯乙酯(phenethyl isothiocyanate, PEITC)异硫氰酸脂的一种,广泛存在于橄榄,花椰菜等十字花科植物当中。研究显示,PEITC可与β-微管蛋白结合,促进微管蛋白的稳定而使细胞阻滞于G2/M期[5]。同时,PEITC也能抑制去乙酰化酶的活性[6]。此外,体内外毒性实验显示PEITC对正常组织细胞无明显的不良反应[7]。尽管如此,但PEITC能否影响结肠癌细胞的迁移与侵袭,目前仍不完全清楚。本研究旨在观察PEITC对结肠癌SW480细胞的迁移与侵袭有何影响,并探讨其可能的调控机制。
1 材料与方法
1.1 主要试剂
6~8周龄的SPF级BALB/c(nu/nu)雄性裸鼠(体质量16~18 g,南华大学动物部,批号:20120302);PEITC(LKT Laboratories,纯度≥95%),并用二甲基亚砜(DMSO)溶解;细胞培养基和Trizol(Invitrogen公司)、培养板和Transwell小室(Corning公司);RT-PCR试剂盒(大连宝生物公司);MMP-9活性检测试剂盒(AnaSpec公司);细胞蛋白提取试剂盒(Thermo);抗P65,P85,α-tublin、PARP和PTEN(Santa Cruz);磷酸化Akt,总Akt以及磷酸化mTOR和总TOR(Cell Signaling公司);ECl化学发光试剂盒(Amersham Pharmacia公司);NF-κB荧光素酶报告基因(SABioscicence公司);双重荧光素酶实验系统(Promega公司);DNA转染试剂(Roche公司)。
1.2 细胞培养及活性检测
SW480细胞系(中南大学肿瘤研究所)用含10%胎牛血清的RPMI-1640培养基于37 ℃,5% CO2条件下培养。分别设立对照组(加入等体积的DMSO)及不同浓度PEITC处理组(加入终浓度为10、30和50 μmol/L的PEITC作用24 h)。采用MTT观察PEITC对SW480细胞的增殖情况,即,SW480孵育结束后,每孔加入30 μL噻唑兰(Methylthiazolyldiphenyl-tetrazolium bromide,MTT)溶液(1 g/L)孵育2 h。弃上清,并加入200 μL DMSO,充分混匀,用酶标仪测定各孔的吸光度值(A570),并计算抑制率。抑制率=(对照组A值-实验组A值)/对照组A值×100%。
1.3 MMP-9活性测定
细胞处理结束后,获取上清,采用间接法测定MMP-9的酶活性。其步骤根据试剂盒提供的步骤进行。根据荧光酶标仪上测定的荧光强度(与MMP-9的活性成正比,激发/发射波长分别为340 nm和490 nm),并计算各组与对照组的比值(相对活性)。
1.4 RT-PCR检测MMP-9 mRNA表达
采用Trizol提取RNA,并根据试剂盒提供的步骤进行RT-PCR。PCR反应条件如下:94 ℃ 变性30 s,65 ℃(MMP-9)或59 ℃(GAPDH) 30 s,72 ℃延伸30 s。随后进入40(MMP-9)或35(GAPHD)个扩增循环。其中MMP-9引物分别为5′-CGCTACC ACCTCGAACTTTG-3′和5′-GCCATTCACGTCGTCCT TAT-3′,产物196 bp。GAPDH:5′TCACCATCTTCCA GGAGCGA-3′,5′-CACAATGCCGAAGTGGTCGT-3′,产物700 bp。扩增产物随后经2%琼脂糖凝胶电泳,并采用Image J软件进行灰度分析。
1.5 伤口愈合实验
通过伤口愈合实验测定细胞的迁移能力。即5×106个细胞接种于6孔板中37 ℃培养6 h。待细胞呈单层贴壁生长后,用用200 μL的移液管尖端在板上划痕。PBS洗涤后加入含有PEITC的完全培养基孵育24 h。在显微镜下拍照并计算迁移率:(1-处理后划痕距离/对照组划痕距离)×100%。
1.6 侵袭性实验
将基质胶均匀铺至Transwell小室上室,并加入100 μL细胞悬液(106/ml),下室加入500 μL完全培养基,37 ℃孵育24 h。取出Transwell,多聚甲醛固定,风干后加入0.1%结晶紫染色20 min。擦除上室细胞,显微镜下随机选择视野拍照,计算迁移到下腔表面的细胞数。其中侵袭抑制率=(1-样本穿膜细胞数/对照组穿膜细胞数)×100%。
1.7 Western blot以及 NF-кB核转位分析
根据试剂盒提供的步骤提细胞总蛋白或核蛋白,并测定其浓度。获取100 μg蛋白用于SDS-PAGE。分离的总蛋白或核蛋白随后转印至PVDF膜上(Millipore),并利用含5%脱脂牛奶的TBST封闭1 h,随后加入一抗抗体4 ℃孵育过夜。多次洗涤之后,加入HRP标记的二抗孵育膜1 h。ECL发光、显影。
1.8 NF-κB荧光素酶报告基因实验
用x-tremeGENE HP DNA转染试剂将NF-κB荧光素酶报告基因转染至SW480细胞中。18 h后,细胞加入不同浓度PEITC作用2 h,根据双荧光素酶检测系统于光度计下检测荧光素酶活性(BMG Lebtech)。
1.9 异种移植瘤动物模型的建立及处理
获取对数生长期的 SW480 细胞,在每只裸鼠右腋皮下接种 0.2 mL细胞悬液(细胞量约5×106个),接种后置于SPF环境饲养。每2~3日测量皮下肿瘤直径,待肿瘤直径为 0.5~0.6 cm 时,按每克体重每2天灌胃给予0.5,1和5 μmol PEITC,共7次。接种后的小鼠自由进食、饮水。最后1次灌胃20 d后测量小鼠体质量以及肿块质量,计算抑瘤率(%)=(1-实验组平均瘤重/对照组平均瘤重)×100%。
1.9 统计学分析

2 结果
2.1 PEITC抑制SW480细胞的迁移和侵袭
10,30和50 μmol/L PEITC处理SW480细胞后,细胞迁移率分显著低于对照组(Plt;0.05)(图1A,表1)。不同浓度的PEITC也能呈剂量依赖性方式抑制SW480细胞侵袭(Plt;0.05)(图1B,表1)。

A.migration (×10);B.invasion (×20)图1 PEITC抑制SW480细胞迁移与侵袭Fig 1 PEITC reduces SW480 cells migration and invasion
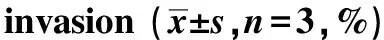
表1 PEITC抑制SW480细胞迁移与侵袭Table 1 PEITC reduces SW480 cells migration and
*Plt;0.05 compared with control.
2.2PEITC抑制SW480细胞MMP-9的表达mRNA并抑制其酶活性
SW480细胞未处理前,MMP-9 mRNA表达水平较高,经不同浓度PEITC处理后,其mRNA水平随着浓度的增高而降低(图2)。

A:The mRNA was determined by RT-PCR analysis;B:Enzymic activity analysis of MMP-9; 1.control; 2.10 μmol/L PEITC;3.30 μmol/L PEITC;4.50 μmol/L PEITC; *Plt;0.05 compared with control图2 PEITC抑制MMP-9 mRNA表达及其酶活性Fig 2 PEITC down-regulates the mRNA expression and enzymic activity of MMP-9
2.3 PEITC抑制SW480细胞中PI3K/AKT通路
PEITC处理后,SW480细胞中PI3K(P85)水平(图3A),磷酸化Akt以及磷酸化mTOR水平明显降低(图3B,C),而总Akt和mTOR无明显影响。此外,PEITC能上调SW480细胞中PTEN水平(图3D)。
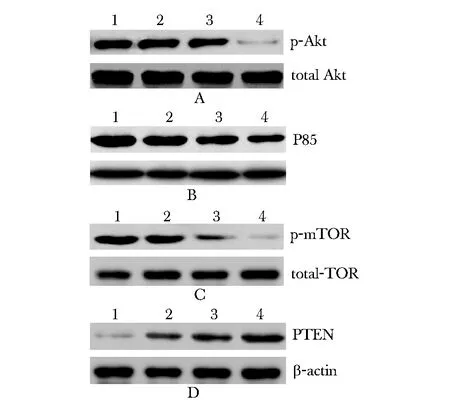
图3 PEITC对SW480细胞中PI3K/AKT通路的影响Fig 3 Effect of PEITC on PI3K/AKT pathways in SW480 cells
2.4 PEITC抑制SW480细胞NF-κB的活性
10~50 μmol/L PEITC处理后,能显著抑制SW480细胞中NF-κB P65亚基转位至细胞核内(图4A)。10 μmol/L PEITC即可影响NF-κB的转录活性,50 μmol/L时其活性降低了42%(图4B)。

A.Western blot analysis of P65 nuclear translocation;B.luciferase activity of NF-κB; 1.control; 2.10 μmol/L PEITC;3.30 μmol/L PEITC;4.50 μmol/L PEITC; *Plt;0.05 compared with control图4 PEITC抑制SW480细胞NF-κB活性Fig 4 PEITC blocks the NF-κB pathway in SW480 cells
2.6 PEITC对裸鼠异种移植瘤生长的抑制作用
不同剂量PEITC可显著BALB/c裸鼠异种移植瘤的生长。随着PEITC剂量的增加,肿瘤重量随之降低,对实体瘤生长的抑制率随之增高(表2)。
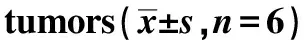
表2 PEITC对异种移植瘤生长的影响Table 2 Effect of PEITC on growth in xenograft
*Plt;0.05 compared with control.
3 讨论
肿瘤细胞侵袭性生长过程中,蛋白水解酶(如MMP-9)降解ECM蛋白是癌细胞侵袭和转移发生的关键。有研究显示PEITC能抑制前列腺癌、乳腺癌以及肺癌细胞肺转移[8- 9],然而,PEITC对结肠癌的抑制作用尚未完全清楚,本研究证实PEITC在无细胞毒性的浓度范围内能明显抑制SW480细胞的侵袭和转移,减少细胞黏附到基质膜,并能明显抑制明胶酶活性和MMP-9的表达,最终抑制肿瘤生长。这表明PEITC在结肠癌中通过抑制MMP-9的表达和活性而具有抗侵袭的潜能。
PI3K是一种脂质激酶,通过激活Akt(蛋白激酶B)控制多种生理过程,它通过诱导P21WAF1定位于细胞质,并通过灭活前凋亡因子BAD和caspase-9发挥抗凋亡作用,此外,活化的Akt可通过诱导MMPs的表达而促进癌细胞侵袭和转移[10]。mTOR是Akt所调控的下游靶分子之一。mTOR通过诱导分泌MMP-2和MMP-9而导致ECM重构而促进肿瘤细胞转移[11]。PTEN是一个具有双重特异性的脂质磷酸酶,通过负调控PI3K/AKT通路而抑制AKT的活性。研究显示, MMP-9 mRNA含量与PI3K/AKT/mTOR通路相关,而与PTEN成负相关[12]。本研究也证实,PEITC能增加PTEN的表达,同时也能抑制PI3K(P85)通路和Akt和 mTOR的磷酸化。NF-κB是Akt下游通路的重要靶分子。并参与调控MMP-9的表达,并与炎性反应、肿瘤细胞增殖、侵袭和转移密切相关[13]。此外,NF-κB在多种肿瘤细胞中持续激活,并诱导多种抗凋亡蛋白表达而导致化疗/放疗耐受[14]。因此抑制NF-κB的活性可能有利于提高药物的疗效。本研究结果显示,PEITC可有效抑制NF-κB转录活性,并能抑制其核转位。由于MMP-9的启动子区域存在NF-κB的结合位点[15],因此PEITC对NF-κB活性的抑制作用,可能是其下调MMP-9表达的原因。
总之,本研究证明PEITC具有抑制SW480细胞侵袭以及实体瘤生长的能力。其机制可能通过上调PTEN表达、抑制PI3K/Akt通路以及NF-κB的活性而抑制MMP-9活性和表达。由于PEITC来源于可食用天然植物,这无疑为肿瘤的预防和治疗提供了重要参考,即,长期食用PEITC含量丰富的蔬菜可降低肿瘤发生的风险,此外,PEITC有望成为结肠癌的重要辅助治疗药物。
[1] Kennelly R, Kavanagh DO, Hogan AM,etal. Oestrogen and the colon: potential mechanisms for cancer prevention[J]. Lancet Oncol, 2008,9:385- 391.
[2] 沈默, 曲宸绪, 游伟程, 等. 北京市城区结肠癌发病率分布滞后预测模型研究[J]. 首都医科大学学报, 2008,29:501- 504.
[3] 宗振久, 张红军, 王曦, 等. 结肠癌发病的危险因素logistic回归分析[J]. 中国医药指南, 2012,10:160- 161.
[4] Nakayama Y, Okazaki K, Shibao K,etal. Alterative expression of the collagenase and adhesion molecules in the highly metastatic clones of human colonic cancer cell lines[J]. Clin Exp Metastasis, 1998,16:461- 469.
[5] Di PAJ, Hong C, Wu MY,etal. Sensitization of non-small cell lung cancer cells to cisplatin by naturally occurring isothiocyanates[J]. Chem Res Toxicol, 2010,23:1307- 1309.
[6] Tang NY, Huang YT, Yu CS,etal. Phenethyl isothiocyanate (PEITC) promotes G2/M phase arrest via p53 expression and induces apoptosis through caspase- and mitochondria-dependent signaling pathways in human prostate cancer DU 145 cells[J]. Anticancer Res, 2011,31:1691- 1702.
[7] Tang L, Zhang Y. Mitochondria are the primary target in isothiocyanate-induced apoptosis in human bladder cancer cells[J]. Mol Cancer Ther, 2005,4:1250- 1259.
[8] Sarkars R, Mukherjee S, Roy M. Targeting heat shock proteins by phenethyl isothiocyanate results in cell-cycle arrest and apoptosis of human breast cancer cells[J]. Nutr Cancer, 2013,65:480- 493.
[9] Pawlik A, Szczepanski MA, Klimaszewska A,etal. Phenethyl isothiocyanate-induced cytoskeletal changes and cell death in lung cancer cells[J]. Food Chem Toxicol, 2012,50:3577- 3594.
[10] Chen JS, Wang Q, Fu XH,etal. Involvement of PI3K/PTEN/AKT/mTOR pathway in invasion and metastasis in hepatocellular carcinoma: Association with MMP-9[J]. Hepatol Res, 2009,39:177- 186.
[11] Osman B, el-S A, Doller A,etal. Differential modulation of the cytokine-induced MMP-9/TIMP-1 protease-antiprotease system by the mTOR inhibitor rapamycin[J]. Biochem Pharmacol, 2011,81:134- 143.
[12] Hildebrandt MA, Yang H, Hung MC,etal. Genetic variations in the PI3K/PTEN/AKT/mTOR pathway are associated with clinical outcomes in esophageal cancer patients treated with chemoradiotherapy[J]. J Clin Oncol, 2009,27:857- 871.
[13] Kim Y, Kang H, Jang SW,etal. Celastrol inhibits breast cancer cell invasion via suppression of NF-kB-mediated matrix metalloproteinase-9 expression[J]. Cell Physiol Biochem, 2011,28:175- 184.
[14] Lee CH, Jeon YT, Kim SH,etal. NF-kappaB as a potential molecular target for cancer therapy[J]. Biofactors, 2007,29:19- 35.
[15] Wu HT, Sie SS, Kuan TC,etal. Identifying the regulative role of NF-kappaB binding sites within promoter region of human matrix metalloproteinase 9 (MMP-9) by TNF-alpha induction[J]. Appl Biochem Biotechnol, 2013,169:438- 449.
Phenethyl isothiocyanate inhibits human colon cancer SW480 cells migration and invasion by PI3K-NF-κB-MMP-9 pathway
WEI Fu-qiao1, XIE Wen-biao1*, SHEN Qing-xiang2, LIU Chang-hua1, LUO Kang-ning1
(1.Dept. of Gastrointestinal Surgery; 2.Dept. of Gynaecology and Obstetrics, the Second Affiliated Hospital of Nanhua University, Hengyang 421001, China)
ObjectiveTo investigate the anti-invasive mechanisms of phenethyl isothiocyanate(PEITC) in human colon cancer SW480 cells.MethodsHuman colon cancer SW480 cell line was cultured, and treated with 10, 30,50 μmol/L PEITC for 24 h. Cell viability, cell migration and invasion were analyzed by MTT assay, scratch healing assay and transwell membrane assay. Activity of matrix metalloproteinase-9 (MMP-9) was analyzed by a fluorescence resonance energy transfer kits, and MMP-9 mRNA expression was detected by RT-PCR. Activation of phosphoinisitide-3-kinase (PI3K) /Akt/mammalian target of rapamycin (mTOR) and phosphatase and tensin homologue (PTEN), and nuclear translocation of nuclear factor kappa B (NF-κB) were examined by Western blot. NF-κB activity was detected by luciferase reporter assay. Furthermore, a mice model with xenograft tumors was constructed,and the effect of PEITC on tumor growth was analyzed.ResultsPEITC significantly reduced SW480 cells invasion and migration without affecting the viability of cells (Plt;0.05). PEITC also markedly inhibited MMP-9 activity and expression at both protein and mRNA levels (Plt;0.05). PEITC attenuated PI3K and phosphorylation of AKT and mTOR, whereas PTEN increased. In the meantime, PEITC inhibited NF-κB transcriptional activity (Plt;0.05). In addition, PEITC diminished NF-κB nuclear translocation. Furthermore, PEITC could significantly inhibit xenograft tumors growth in nude mice (Plt;0.05).ConclusionsPEITC is a potential anti-invasive agent by inhibiting MMP-9 to be involved in PI3K/AKT and NF-κB pathways.
phenethyl isothiocyanate(PEITC);SW480 cells; MMP-9;PI3K/AKT; NF-κB
2013- 10- 25
2013- 12- 24
湖南省科技计划项目(2013SK3120);湖南省高校科技创新团队资助项目[湘教通(2010)212号]
*通信作者(correspondingauthor): xiewenbiao2013@sohu.com
1001-6325(2014)04-0927-06
研究论文
R739.6
A
