藻蓝素减轻大鼠脓毒症性急性肺损伤及其分子机制
2014-11-27张大利吴建华谢黎明刘双全
张大利,吴建华,谢黎明,刘双全
(1.南华大学 附属第一医院 急诊科;2.衡阳市第一人民医院 呼吸内科, 湖南 衡阳 421001)
藻蓝素减轻大鼠脓毒症性急性肺损伤及其分子机制
张大利1*,吴建华2,谢黎明1,刘双全1
(1.南华大学 附属第一医院 急诊科;2.衡阳市第一人民医院 呼吸内科, 湖南 衡阳 421001)
目的观察藻蓝素(CPC)对脓毒症急性肺损伤大鼠的保护作用及其分子机制。方法将大鼠随机分为对照组、模型组和CPC干预组。其中模型组采用盲肠结扎穿刺建立脓毒症急性肺损伤大鼠模型。CPC干预组在模型组基础上分别腹腔注射给予20、40和60 mg/kg CPC。术后72 h后获取血液及肺组织标本,检测PaO2/FiO2、肺湿干重比(W/D)、支气管肺泡灌洗液中肿瘤坏死因子(TNF)-α、白介素(IL)- 1β和IL-6水平,以及肺组织中丙二醛(MDA)水平及髓过氧化物酶(MPO)活性;比色法检测血红素氧合酶(HO)- 1活性,用RT-PCR检测mRNA表达。结果与对照组相比,模型组PaO2/FiO2含量显著降低(Plt;0.05),W/D比值以及MDA和MPO显著高于对照组(Plt;0.05)。不同浓度CPC干预后,PaO2/FiO2进一步增高,肺湿干重、MDA和MPO水平随之降低(Plt;0.05);模型组大鼠BALF中TNF-α、IL-1β和IL-6含量、HO- 1活性及其mRNA表达水平增高(Plt;0.05),而CPC能进一步降低TNF-α、IL-1β和IL-6含量,同时能增加HO- 1的酶活性以及上调其mRNA水平(Plt;0.05)。此外,HO- 1激动剂锡原卟啉(CoPP)处理后,能协同CPC降低TNF-α、IL-1β和IL-6含量,而HO- 1抑制剂锌原卟啉(ZnPP)能进一步促进细胞因子产生(Plt;0.05)。结论CPC可能通过上调HO- 1表达,从而减轻脓毒症急性肺损伤大鼠肺部气体交换功能和炎性反应。
藻蓝素;脓毒症;急性肺损伤;血红素氧合酶1
脓毒症(sepsis)是由感染所引发的全身炎性反应综合征。严重脓毒症时,急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)在多器官功能衰竭中出现最早,且发生率最高。ALI/ARDS本质上属于一种肺内过度性、失控性的炎性反应[1]。其病理生理基础是中性粒细胞大量渗出,分泌大量的炎性分子和介质,导致广泛的组织损伤。因此,采取不同的干预措施,针对促炎/抗炎性反应失衡的方向和程度,是防治ALI/ARDS的关键[2]。由于藻蓝素(C- phycocyanin,CPC)一种从螺旋藻提取、加工而成的天然食用色素,是一种营养价值极高的营养物质[3- 4]。研究显示,CPC不但可以帮助调节合成人体所需要的多种重要酶,同时对人体的免疫系统具有一定的调控作用。本研究旨在探讨CPC对脓毒症诱导的ALI中发挥保护效应及其可能的分子机制。
1 材料与方法
1.1 实验动物与主要试剂
SPF级雄性SD大鼠90只,体质量180~200 g,(南华大学实验动物中心提供,合格证号:2009A023)。食用标准饲料,实验期间大鼠均自由饮水。CPC、钴原卟啉、锌原卟啉(纯度98%,Sigma-Aldrich公司),肿瘤坏死因子(TNF)-α、白介素(IL)- 1β和IL-6 ELISA检测试剂盒(深圳新博盛生物科技有限公司)。丙二醛和髓过氧化物酶检测试剂盒(南京建成生物工程研究所)。
1.2 实验分组与处理
将大鼠随机分为对照组(或假手术组)、模型组、CPC干预组(每组10只)。对照组SD大鼠用10%水合氯醛0.9%氯化钠注射液麻醉(400 mg/kg),去除毛发并进行皮肤消毒后,沿前腹正中线作3 cm长的切口,取出盲肠,然后逐层关腹。模型组大鼠取出盲肠后,用4.0丝线在距盲端1.5 cm处结扎,用18号针头在盲肠结扎处远端队穿刺2次,挤出少量粪便,随后将盲肠回纳入腹腔中,逐层关腹。CPC干预组于术后2 h分别予20、40和60 mg/kg CPC腹腔注射,12 h后给予第2次注射。72 h后处死大鼠用于下一步研究。
1.3 血气分析以及肺损伤指标测定的测定
获取处理后大鼠动脉血,采用全自动血气分析机(NOVA-K)检测PaO2/FiO2。随后通过CO2麻醉处死大鼠,取各组右肺下部,获得湿重,然后在烤箱内60 ℃放置48 h,获取干重。计算肺组织湿干比(wet-to-dry weight ratio,W/D)。丙二醛(malondialdehyde,MDA)和髓过氧化物酶(myeloperoxidase,MPO)含量按剂盒说明书进行操作,使用可见光分光光度计测得各管吸光度值,按照说明书上公式计算肺组织MDA含量和MPO活性,单位分别为nmol/(mg·protein)和ΔA/(min·g·protein)表示,其中ΔA为1 min内吸光度的改变。
1.4 支气管肺泡灌洗液的采集以及细胞因子测定
在大鼠右主支气管部位对右肺进行结扎,气管插管后注入5mL无菌PBS并从左肺收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)。利用ELISA法测定BALF中肿瘤坏死因子(TNF)-α、白介素(IL)- 1β和IL-6水平。
1.5肺组织血红素氧合酶(hemeoxygenase,HO)-1活性检测
取肺组织加入5体积冷蔗糖Tris·HCl缓冲液(pH 7.4)制备组织匀浆,4 ℃ 13 500×g离心20 min,弃沉淀;上清液15 000×g离心60 min。所获得的微粒体悬浮于100 mmol/L磷酸钾缓冲液(含0.1 mmol/L乙二胺四乙酸二钠,pH 7.4)中,制成微粒体悬液,用考马斯亮蓝法测蛋白含量。HO- 1的活性测定按参考文献提供的方法进行[5]。
1.6 RT-PCR检测HO- 1 mRNA的表达
用Trizol试剂从处理的细胞中提取细胞总RNA,使用AMV反转录酶和随机9聚体合成第一链cDNA。HO- 1和β-actin(内对照)的引物为:HO- 1(309 bp): 5′-CTTTCAGAAGGGTCAGGTGTCCA- 3′(上游)和5′- CTGAGAGGTCACCCAGGTAGCGG- 3′(下游)。β-actin的上游引物(224 bp):5′-CGTGG GCCGCCCT AGGCACCA- 3′,下游:5′-TTGGCTTA GGGTTCAGGGGG- 3′(上游)。PCR反应结束后取10 μL PCR产物进行琼脂糖凝胶电泳,拍照。结果以目的基因/内参照吸光度比值表示。
1.7 统计学分析
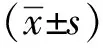
2 结果
2.1 各实验组大鼠血气分析
与正常对照组相比,模型组PaO2/FiO2含量显著降低(Plt;0.01)。不同浓度CPC干预后,PaO2/FiO2进一步增高(图1)。
2.2各组肺组织中W/D、MDA含量以及MPO和HO-1活性的变化
模型组W/D、MDA含量和MPO活性显著高于对照组 (Plt;0.01)。不同浓度CPC干预后,肺组织W/D、MDA水平和MPO活性随着CPC浓度的增高而降低 (Plt;0.05)。此外,模型组肺组织中HO- 1的活性相比对照组而言有所增高(Plt;0.05);CPC干预后,HO- 1活性进一步增高(表1)。
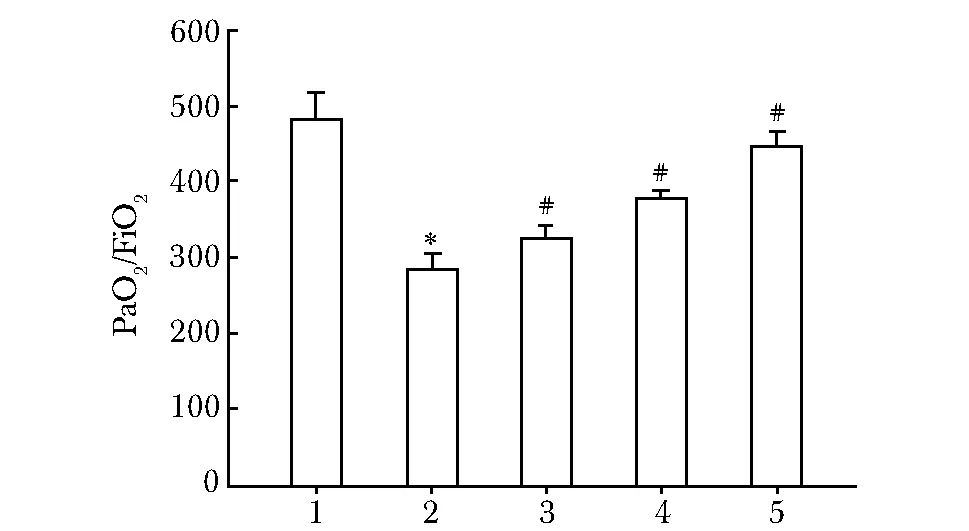
1.control;2.model;3.20 mg/kg CPC;4.40 mg/kg CPC;5.60 mg/kg CPC; *Plt;0.01 compared with control;#Plt;0.05 compared with model图1 各组大鼠动脉血气分析PaO2/FiO2结果Fig 1 PaO2/FiO2 in different groups (±s, n=3)
2.3 各组BALF细胞因子含量测定
与对照组相比,模型组大鼠BALF中TNF-α、IL-1β和IL-6含量明显增高。不同浓度CPC干预后,TNF-α、IL-1β和IL-6含量进一步降低,其中60 mg/kg CPC处理后,细胞因子含量显著低于20和40 mg/kg组(Plt;0.05)。此外,给予HO- 1激动剂锡原卟啉(CoPP)处理后,能协同CPC降低TNF-α、IL-1β和IL-6的水平,而HO- 1抑制剂锌原卟啉(ZnPP)能削弱CPC对细胞因子水平的抑制作用(表2)。
2.4 肺组织中HO- 1 mRNA表达
对照组中HO- 1 mRNA表达水平极低。模型组HO- 1 mRNA表达仅有轻微增高,而分别给予20、40和60 mg/kg CPC处理后,大鼠肺组织内HO- 1 mRNA水平显著高于对照组(Plt;0.01)(图2A, B)。

表1 各组肺组织中W/D、MDA含量以及MPO和HO- 1活性的变化Table 1 W/D, MDA concentration and MPO and HO- 1 enzyme activity in the different groups(±s,n=3)
*Plt;0.01 compared with control;△Plt;0.05 compared with model;▲Plt;0.05 compared with 20 mg/kg CPC.

表2 各组BALF中TNF-α、IL-1β和IL-6含量Table 2 TNF-α,IL-1β and IL-6 in the BALF of different groups(±s, pg/mL, n=3)
*Plt;0.01 compared with control;△Plt;0.05 compared with model;▲Plt;0.05 compared with 20 mg/kg CPC;#Plt;0.05 compared with 60 mg/kg CPC.
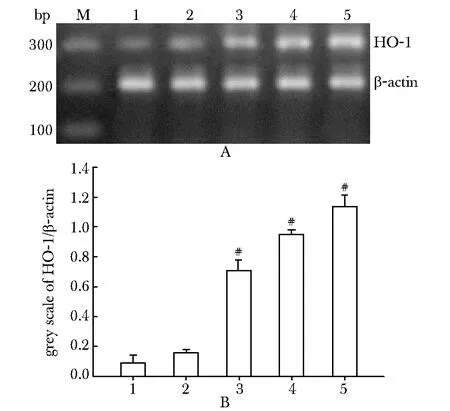
1.control;2.model;3.20 mg/kg CPC;4.40 mg/kg CPC;5.60 mg/kg CPC; #Plt;0.01 compared with model图2 肺组织中HO- 1 mRNA表达情况Fig 2 Expression of HO- 1 mRNA in lung tissue
3 讨论
ALI发生时,由于肺组织水肿导致的顺应性改变以及通气血流灌注比例异常,临床上常表现为难治性低氧血症。因此肺换气功能的改善是评价ALI病情的重要依据[6]。由于PaO2/FiO2受吸氧浓度的干扰小,因此能真实地反应体内的缺氧状态[7]。肺湿/干比反应的是肺组织中水的含量,常用于评价肺水肿的严重程度[8]。MPO是一种含铁溶酶体,主要存在中性粒细胞和单核细胞的嗜苯胺蓝颗粒中,因此MPO的活性可间接反应出中性粒细胞的活性[9]。MDA是常用的膜脂过氧化指标,ALI发生时往往显著增高。本研究采用经典的大鼠盲肠结扎穿刺法建立脓毒症肺损伤动物模型[10]。结果显示,大鼠盲肠结扎穿刺法建立的急性肺损伤模型后,大鼠气体交换、肺水含量、细胞因子含量以及肺组织中MDA和MPO活性的变化与对照组相比存在统计学差异,表明ALI模型成功。近年来针对脓毒症所致的治疗是研究的热点。由于CPC不良反应低,药源充足,在防治脓毒症所致ALI中日益受到重视。本研究显示,不同剂量CPC处理后,PaO2/FiO2得到了明显的改善。同时,CPC也可降低W/D比值,表明CPC可能在一定程度上改善肺微血管的通透性,从而抑制肺内组织液的渗出。本研究还发现MPO水平随着CPC浓度的增高而降低,这也说明CPC可在一定程度上抑制中性粒细胞的渗出。同时在BALF中,中性粒细胞释放的促炎性细胞因子TNF-α、IL-1β和IL-6的水平也受到了一定的抑制。由于各种细胞因子可通过多种途径相互作用于免疫系统,形成广泛的炎性反应网络,最终可加重各种活性氧、蛋白水解酶等生物活性分子的大量释放,形成恶性循环。因此CPC对细胞因子的抑制可抑制过度炎性反应的发生。
血红素氧合酶(heme oxygenase- 1,HO- 1)是催化血红素降解为CO、亚铁离子和胆红素的限速酶,并在机体的抗炎性反应、抗氧化损伤中发挥重要作用[11]。本研究证实,模型组HO- 1的活性及mRNA水平虽然具有轻微增高,这可能是机体的反馈性保护机制。而CPC处理后,组织HO- 1活性及表达显著增强。同时采用HO- 1激动剂CoPP处理后,TNF-α、IL-1β和IL-6的水平明显降低,表明诱导HO- 1表达后能协同CPC抑制细胞因子的产生。此外,采用特异性抑制剂ZnPP能明显逆转CPC对细胞因子的抑制作用,表明上调HO- 1的表达是CPC抗炎性反应的重要机制。
总之,本研究证实CPC能有效抑制细胞因子的过度分泌,表明其能在一定程度上减轻脓毒症急性肺损伤大鼠肺部气体交换功能,抑制炎性反应,从而发挥对脓毒症急性肺损伤大鼠的保护作用。
[1] Zhang H, Neuhofer P, Song L,etal. IL-6 trans-signaling promotes pancreatitis-associated lung injury and lethality[J]. J Clin Invest, 2013,123:1019- 1031.
[2] Dechert RE, Haas CF, Ostwani W. Current knowledge of acute lung injury and acute respiratory distress syndrome[J]. Crit Care Nurs Clin North Am, 2012,24:377- 401.
[3] Shih CM, Cheng SN, Wong CS,etal. Antiinflammatory and antihyperalgesic activity of C-phycocyanin[J]. Anesth Analg, 2009,108:1303- 1310.
[4] Cherng SC, Cheng SN, Tarn A,etal. Anti-inflammatory activity of c-phycocyanin in lipopolysaccharide-stimulated RAW 264.7 macrophages[J]. Life Sci, 2007,81:1431- 1435.
[5] Ma X, You X, Zeng Y,etal. Mycoplasma fermentans MALP- 2 induces heme oxygenase- 1 expression via mitogen-activated protein kinases and Nrf2 pathways to modulate cyclooxygenase 2 expression in human monocytes[J]. Clin Vaccine Immunol, 2013,20:827- 834.
[6] Lange M, Hamahata A, Enkhbaatar P,etal. Assessment of vascular permeability in an ovine model of acute lung injury and pneumonia-induced Pseudomonas aeruginosa sepsis[J]. Crit Care Med, 2008,36:1284- 1289.
[7] Muellenbach RM, Kredel M, Zollhoefer B,etal. Acute respiratory distress induced by repeated saline lavage provides stable experimental conditions for 24 hours in pigs[J]. Exp Lung Res, 2009,35:222- 233.
[8] 徐文莉, 何俊, 曾因明, 等. 异氟醚后处理对盲肠结扎穿孔大鼠急性肺损伤的保护作用[J]. 徐州医学院学报, 2010,30:290- 293.
[9] Krupa A, Fudala R, Florence JM,etal. Bruton’s tyrosine kinase mediates FcgammaRIIa/Toll-like receptor- 4 receptor crosstalk in human neutrophils[J]. Am J Respir Cell Mol Biol, 2013,48:240- 249.
[10] 魏西军. 盲肠结扎穿刺法大鼠脓毒症模型的复制[J]. 西部医学, 2012,24:1243- 1244,1248.
[11] Deshane J, Chen S, Caballero S,etal. Stromal cell-derived factor 1 promotes angiogenesis via a heme oxygenase 1-dependent mechanism[J]. J Exp Med, 2007,204:605- 618.
Molecular mechanism of C-phycocyanin in alleviation of acute lung injury in septic rats
ZHANG Da-li1*,WU Jian-hua2,XIE Li-ming1,LIU Shuang-quan1
(1.Dept. of Emergency, the First Affiliated Hospital of Nanhua University;2.Dept. of Respiratory,the First People’s Hospital of Hengyang, Hengyang 421001, China)
ObjectiveTo observe the protective effect and molecular mechanism of C-phycocyanin (CPC) on acute lung injury in septic rats.MethodsThe rats were randomly divided into control group, model group and CPC group. Cecal ligation and puncture was used to establish a septic acute lung injury rats (model group). For the CPC groups, septic acute lung injury rats were administrated by 20,40 and 60 mg/kg of CPC by peritoneal injection. 72 h after the operation, serum and lung tissue were obtained, the PaO2/FiO2, the wet to dry weight ratio, content of tumor necrosis factor (TNF)-α,interleukin (IL)- 6 and IL-10 in bronchoalveolar lavage fluid, the concentration of malondialdehyde (MDA) and activity of myeloperoxidase (MPO) were analyzed. Enzymic activity of heme oxygenase (HO)- 1 and its mRNA was detected by colorimetric method and RT-PCR respectively.ResultsPaO2/FiO2, content of MDA, activity of MPO, and thewet to dry weight ratio significantly increased in the model group, after CPC treatment, the level of PaO2/FiO2increased, the wet to dry weight ratio and the content of MDA and activity of MPO decreased (Plt;0.05), In the medel group, TNF-α,IL-6 and IL-1β in bronchoalveolar lavage fluid increased, HO- 1 acivity and mRNA level also increased(Plt;0.05). CPC may decrease the cytokines level, and upregulate HO- 1 acitvity and mRNA expression. In addition, HO- 1 agonist CoPP may synergize CPC to production of TNF-α,IL-6 and IL-10 1β, but HO- 1 antagonist ZnPP may futher increase the cytokines production.ConclusionsCPC may induce HO- 1 expression, and thus relieve gas exchange function and the inflammatory response in the septic acute lung injury.
C-phycocyanin;sepsis;acute lung injury;heme oxygenase- 1
2013- 12- 23
2014- 04- 08
国家自然科学基金(81201331)
*通信作者(correspondingauthor):nhzhangdali@163.com
1001-6325(2014)07-0891-05
研究论文
R453.9
A
