人源化CDR3δ1移植性抗体对PBMC治疗肝癌的影响
2014-11-27高运安
高运安,姜 燕,何 维
(中国医学科学院 基础医学研究所 免疫系,北京 100005)
人源化CDR3δ1移植性抗体对PBMC治疗肝癌的影响
高运安,姜 燕,何 维*
(中国医学科学院 基础医学研究所 免疫系,北京 100005)
目的研究人源化CDR3δ移植性抗体GTM-Fc对PBMC治疗肝癌的影响。方法裸鼠皮下注射HepG2.2.15肝癌细胞,建立移植瘤模型,将荷瘤裸鼠分成PBS组、PBMC和PBMC+Ab 3组,每组9只,PBS组瘤内注射100 μL PBS/只,PBMC组注射1×106PBMC/100 μL/只,PBMC+Ab组注射3 μg GTM-Fc/1×106PBMC/100 μL。每3天给药1次并测体质量和肿瘤大小,给药5次后的第3天处死裸鼠。流式细胞仪检测GTM-Fc与肝癌细胞系的结合能力,抗体依赖细胞介导的细胞毒作用(ADCC)检测GTM-Fc对PBMC杀伤肝癌细胞系的影响。结果人源化CDRδ1移植性抗体GTM-Fc与肝癌细胞系有良好的结合能力。体外实验证明,它能够促进PBMC对肝癌细胞系的杀伤作用。结论人源化CDR3δ移植性抗体GTM-Fc能够促进PBMC对肝癌的杀伤作用,为研究免疫治疗肝癌提供了新的线索。
人源化抗体;GTM-Fc;外周血单核淋巴细胞
肝癌是目前最常见及病死率高的恶性肿瘤之一,据统计,中国每年死于肝癌的患者高达11万例,病死率已分别上升至农村及城市恶性肿瘤病死率的第1、2位[1- 2]。即使是身为发达国家的美国,2013年诊断出患有肝癌的患者就达到3万余例,其中约71%为恶性肿瘤[3]。一百多年来,从早期单一的手术切除到化疗、放疗,研究人员为攻克这一疾病进行了多种尝试,虽然有一定效果,但都局限在对病灶局部的治疗上,仍然不能解决肝癌易复发及易转移等问题,对于晚期肝癌患者来说,其效果更是微乎其微[4- 5]。
近年来,随着对肝癌研究的逐渐深入,生物治疗作为继手术、放疗和化疗后肿瘤治疗的第4种模式,已经显示出了良好的应用前景。目前生物治疗主要包括肿瘤非特异小分子化合物治疗、过继免疫治疗、疫苗治疗、单克隆抗体的免疫治疗、靶向治疗及基因治疗等[6]。
本实验室近年来一直致力于研究抗体对肿瘤的靶向治疗。在前期工作中,获得了一个优势TCRδ2链互补决定区3(complementary-determining region 3,CDR3)的TCRγ9δ2-Fc移植性抗体,命名为OT3-Fc;以及一个TCRγ4δ1-Fc移植性抗体,命名为GTM-Fc。本文拟对上述两个人源化移植性抗体对外周血单核淋巴细胞(peripheral blood mononuclear cell,PBMC)杀伤肝癌细胞系所起的作用进行研究,从而为抗体靶向治疗肝癌提供新的策略。
1 材料与方法
1.1 实验材料
1.1.1 细胞:PBMC(取自健康志愿者全血);肝癌细胞系HepG2(中国人民解放军301总医院);HepG2.2.15和Hep3b(中国医学科学院基础医学研究所基础医学细胞中心)。
1.1.2 小鼠:SPF级BALB/c裸鼠,3~5周龄(中国医学科学院基础医学研究所实验动物中心)
1.1.3 主要材料与试剂:GTM-Fc、OT3-Fc(由义翘神州公司纯化);hIgG1、FITC标记山羊抗人IgG(Fc)多抗(Sigma公司);R1640培养基(Takara生物公司);胎牛血清(Thermo Fisher Scientific公司);0.05%胰蛋白酶(协和细胞资源中心);含1%牛血清白蛋白的磷酸缓冲盐水(1% PBS-BSA)、人外周血淋巴细胞分离液(天津灏洋生物公司);CytoTox 96® Non-Radioactive Cytotoxicity Assay试剂盒(Promega公司)等。
1.2 实验方法
1.2.1 梯度离心法分离PBMC:准备好用R1640培养基稀释10倍的肝素抗凝剂,抽取志愿者全血,以1∶1的比例加入到稀释好的抗凝剂中,混匀。之后将抗凝血以2∶1的比例缓慢加入至淋巴细胞分离液中,1 900 r/min离心15 min。离心结束后整个液体分成4层,其中第2层为PBMC。用玻璃吸管将PBMC层吸至盛有R1640培养基的离心管中,混匀后1 500 r/min离心10 min。倒去上清液,重新加入R1640培养基并重悬细胞,1 200 r/min离心8 min。倒去上清液,加入适量R1640培养基重悬细胞,PBMC分离完成。
1.2.2 流式细胞术检测移植性抗体与肝癌细胞的结合:实验设实验组、同型对照组、空白对照组,实验组加3 μg/管移植性GTM-Fc或OT3-Fc抗体,同型对照组加3 μL hIgG1,对照组以缓冲液代替抗体。取增长至对数期的肝癌细胞系,用0.05%胰蛋白酶消化细胞后,用1% PBS-BSA洗涤3遍,之后进行细胞计数,将癌细胞稀释成1×105个/mL 置微量离心管。按实验设计,将GTM-Fc、OT3-Fc或hIgG1分别加入细胞悬液中,混匀后放入4 ℃冰箱孵育1 h。孵育结束后洗涤3遍,加入2 μL/管FITC标记的山羊抗人IgG (Fc)多抗,重悬细胞后放入4 ℃冰箱中,避光孵育30 min。之后洗涤3遍,用400目的滤网过滤,之后进行流式细胞仪检测。
1.2.3 LDH法检测细胞毒作用:用0.05%胰蛋白酶将对数生长期的肝癌细胞消化后细胞计数,细胞用含10%小牛血清(calf serum,CS)的R1640培养基稀释成1×105个/mL,按100 μL/孔加入96孔培养板中,将GTM-Fc设为1、2 和3 μg/mL 3种浓度梯度,分别处理肝癌细胞4 h,之后按靶效比1∶5、1∶10、1∶20和1∶40加入PBMC,按LDH试剂盒说明开始进行细胞的杀伤。
1.2.4 体内实验:裸鼠荷瘤:消化增长至对数期的肝癌细胞HepG2.2.15,洗涤后细胞计数,将细胞稀释成1×107个/mL,在裸鼠背部皮下注射,100 μL/只。待裸鼠肿瘤达到一定大小后,进行给药治疗:将荷瘤成功的裸鼠平均分成3组,每组9只。1号组为PBS对照组,瘤内注射无菌PBS,100 μL/只;2号组为PBMC治疗组,每只瘤内注射1×106PBMC/100 μL;3号组为PBMC+Ab治疗组,每只瘤内注射3 μg GTM-Fc/1×106PBMC/100 μL。每3天治疗1次并测量裸鼠体质量及肿瘤大小,治疗5次后的第3天处死裸鼠,拍照记录肿瘤大小及称重。
1.3 统计学分析

2 结果
2.1流式细胞仪检测人源化移植抗体与肝癌细胞系的结合
GTM-Fc和OT3-Fc与3种肝癌细胞系均有不同程度的结合(图1),GTM-Fc与肝癌细胞系的结合程度均比OT3-Fc的高。因此,之后的杀伤实验和体内实验中,均采用GTM-Fc。
2.2LDH法检测人源化移植抗体GTM-Fc对PBMC杀伤肝癌细胞系的影响
添加GTM-Fc抗体后,PBMC对3种肝癌细胞HepG2(图2A)、Hep3b(图2B)、HepG2.2.15(图2C)的杀伤作用与对照组相比都有了较大提高,并且随着添加的GTM-Fc浓度的增加,其促进PBMC杀伤肝癌细胞的作用也愈明显。
2.3体内实验检测人源化移植抗体GTM-Fc对PBMC杀伤肝癌细胞系HepG2.2.15的影响
3组裸鼠在荷瘤之后体质量呈一致上升趋势,给药后,体质量均有下降,同时下降程度差别不明显(图3A)。 PBMC组及PBMC+Ab组的裸鼠在给药后与PBS对照组相比,其肿瘤大小变化有明显的区别,前两组裸鼠的肿瘤的增长趋势较PBS组更加缓慢(图3B, 3C)。
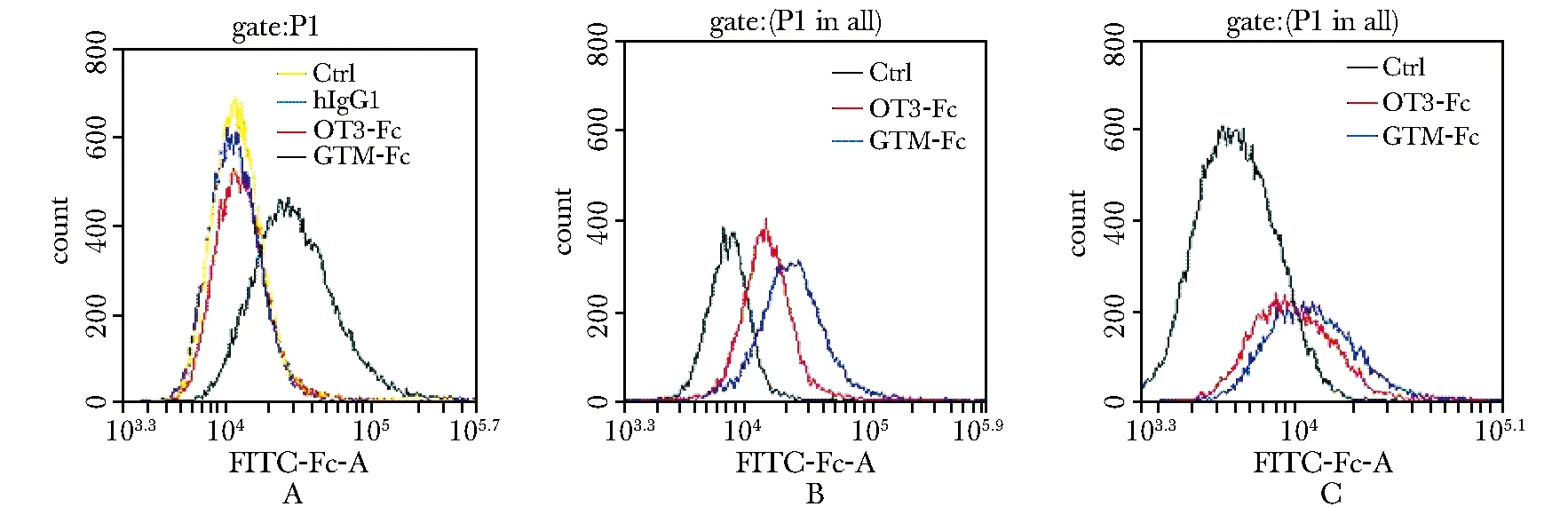
A.antibody was combined with HepG2.2.15; B.antibody was combined with Hep3b; C.antibody was combined with HepG2图1 人源化移植抗体与肝癌细胞系的结合能力Fig 1 The combining capacity between the humanized grafted-antibody and HHCC

A.the effect of GTM-Fc to killing HepG2; B.the effect of GTM-Fc to killing Hep3b; C.the effect of GTM-Fc to killing HepG2.2.15;*Plt;0.05,**Plt;0.01,***Plt;0.001 compared with control group
图2GTM-Fc对PBMC体外杀伤肝癌细胞系的影响
Fig2TheeffectofGTM-FcinvitroonkillingHHCCofPBMC

A.the change of weight of nude mice; B.the change of the tumor; C.the picture of tumor (×0.5);*Plt;0.05,**Plt;0.01,***Plt;0.001 compared with PBS group;#Plt;0.05,##Plt;0.01,###Plt;0.001 compared with PBMC group
图3GTM-Fc对PBMC体内杀伤肝癌细胞系HepG2.2.15的影响
Fig3TheresultofGTM-FcinvivoonkillingHepG2.2.15ofPBMC
3 讨论
抗体的肿瘤靶向治疗,是免疫生物治疗的手段之一,是指根据免疫学原理,利用抗体对肿瘤进行治疗的方法。自1975年杂交瘤技术问世以来,单克隆抗体给靶向治疗肿瘤提供了新的途径。通过基因工程技术制备的人源化和人源抗体,克服了鼠源性抗体所引起人抗鼠免疫反应(human anti-mouse antibody,HAMA),这成为了治疗性抗体进展的关键。迄今为止美国食品及药物管理局(food and drug administration,FDA)已经正式批准了20多种单克隆抗体用于肿瘤的治疗,另外还有多种抗体处于临床试验阶段,抗体靶向治疗肿瘤的前景一片光明[7]。
本实验之前对多种不同肿瘤来源(胃癌、肾癌、卵巢癌、膀胱癌、食管癌、肺癌、嗜铬细胞瘤和浆乳癌等)的肿瘤浸润γδT淋巴细胞(tumor infiltration lymphocytes, γδTIL)进行扩增后通过测序筛选到其中3例胃癌组织共有的CDR3δ1优势序列,命名为GTM;同时,通过基因重组技术,获得了CDR3δ1被GTM基因取代的人源化移植抗体TCRγ4-Fc/δ1-Fc融合蛋白(GTM-Fc)。本研究用此融合蛋白作为靶向治疗肝癌的抗体,通过流式细胞术、ADCC和体内抑瘤实验等方法来观察其对PBMC杀伤肝癌细胞的影响,从而对免疫治疗肝癌提供参考。实验结果发现,GTM-Fc与肝癌细胞有良好的结合能力,且在体内外均能促进PBMC杀伤肝癌细胞,提示GTM-Fc在PBMC和肝癌细胞之间很好的起到了介导的作用,GTM-Fc识别肿瘤抗原后,能够很大程度的募集PBMC并提高其杀伤肝癌细胞的能力。动物体内实验结果表明,裸鼠体质量的变化与给药之间并无明显关系,差异不显著。另外,体内杀伤结果相比之下,不如体外实验结果那么明朗,这说明复杂的生理环境在一定程度上对GTM-Fc结合抗体或者对PBMC的募集产生了影响,具体机制还有待下一步研究。
[1] Chen JG, Zhang SW. Liver cancer epidemic in China:past,present and future[J]. Semin Cancer Biol, 2011, 21:59- 69.
[2] 李海军, 孟宪飞, 董志意, 等. CCN5对肝癌细胞系HepG2增殖、迁移和侵袭能力的影响及其作用机制[J]. 基础医学与临床, 2014, 34:376- 380.
[3] Raoslav S, Xingxuan H, Isael F,etal. Recombinant Human Acid Sphingomyelinase as an Adjuvant to Sorafenib Treatment of Experimental Liver Cancer[J]. Plos ONE, 2013, 8:10.1371.
[4] 杨帆, 张琪, 陈规划. 肝癌细胞免疫治疗进展[J]. 外科研究与新技术, 2013, 2:262- 266.
[5] 王鹏, 朱争艳, 李成龙, 等. EphA2在不同肝癌细胞系中过表达及其与乙肝病毒感染相关[J]. 基础医学与临床, 2013, 33:1590- 1594.
[6] 陈规划, 张填. 肝癌生物治疗的现状与展望[J]. 外科理论与实践, 2012, 17:434 - 436.
[7] 赵甜甜, 范娜娜, 林莉, 等. 胃肠道肿瘤的抗体靶向治疗研究进展[J]. 浙江大学学报, 2012, 41:345- 352.
The effect of humanized CDR3δ1-grafted antibody on PBMC-mediated treatment of human liver cancer
GAO Yun-an, JIANG Yan, HE Wei*
(State Key Laboratory of Medical Molecular Biology, Dept. of Immunology,Institute of Basic Medical Sciences, CAMS, School of Basic Medicine, PUMC, Beijing 100005, China)
ObjectiveTo investigate the effect of humanized CDR3δ1-grafted antibody GTM-Fc on PBMC-mediated treatment of human hepatoma.MethodsHepG2.2.15 were transplanted by subcutaneous injection to form transplantation tumor in nude mice. Then the animals were divided into PBS group, PBMC group and PBMC+Ab group, nine mice in each group. Mice in PBS group were injected within tumor with 100 μL PBS(phosphate buffer solution) while those in PBMC group and PBMC+Ab group were injected respectively with 1×106of PBMC and 1×106of PBMC added 3 μg GTM-Fc. Repeated the treatment every three days and measured the weight and the tumor size. executed all the mice three day after the fith treatment. Flow cytometry(FCM) was performed to detect the binding capability of GTM-Fc to human hepatic carcinoma cells(HHCC). The antibody-dependent cell-mediated cytotoxicity (ADCC) was applied to detect the effect of GTM-Fc on PBMC-mediated killing HHCCinvivoandinvitro.ResultsHumanized CDR3δ1-grafted antibody GTM-Fc displayed excellent binding activity for HHCC. Experimentsinvitroshowed that GTM-Fc augmented the killing effect of PBMC to HHCC.ConclusionsHumanized CDR3δ1-grafted antibody GTM-Fc can enhance the killing effect of PBMC on HHCC.
humanized antibody; GTM-Fc; PBMC
2014- 04- 14
2014- 05- 19
国家科技重大专项课题(2012ZX10002015008)
*通信作者(correspondingauthor):heweiimu@public.bta.net.cn
1001-6325(2014)07-0904-05
研究论文
R 392.11
A
