HMGB1-TLR4促进缺氧复氧介导的大鼠肾小管上皮细胞凋亡
2014-11-27尹金凤刘秀娟沈江山尹秀英
尹金凤,刘秀娟,沈江山,周 阳,尹秀英
(1.南昌大学 第四附属医院 肾内科, 江西 南昌 330000; 2.解放军第九四医院 肾内科, 江西 南昌 330000)
HMGB1-TLR4促进缺氧复氧介导的大鼠肾小管上皮细胞凋亡
尹金凤1,刘秀娟2*,沈江山1,周 阳1,尹秀英2
(1.南昌大学 第四附属医院 肾内科, 江西 南昌 330000; 2.解放军第九四医院 肾内科, 江西 南昌 330000)
目的研究缺氧复氧后大鼠肾小管上皮细胞中高迁移率族蛋白1(HMGB1) 和Toll样受体4(TLR4)的表达及其在肾小管上皮细胞凋亡中的调控机制。方法大鼠原代肾小管上皮细胞(PTECs) 置于6孔培养板培养,随机分为对照组(control)、缺氧复氧组(A/R)、HMGB1抗体处理组(A/R+HMGB1)和TLR4抗体处理组(A/R+TLR4)(每组n=3)。用RT-PCR检测HMGB1和TLR4 mRNA的表达;Western blot法检测HMGB1、TLR4 及凋亡相关分子Bcl-2、Bax、CHOP和caspase-8的蛋白表达;流式细胞术检测细胞凋亡。结果A/R组HMGB1和TLR4的mRNA和蛋白的表达水平较对照组均显著上调 (Plt; 0.01),细胞凋亡水平较对照组显著增加 (Plt; 0.01),凋亡相关分子Bax、CHOP和caspase-8蛋白表达水平较对照组显著增加(Plt; 0.01),Bcl-2蛋白表达较正常对照组下调(Plt; 0.05)。 经抗体处理后,HMGB1抗体处理组和TLR4抗体处理组PTECs细胞凋亡水平较缺氧复氧组显著下降(Plt; 0.05),凋亡相关分子Bax、CHOP和caspase-8蛋白表达水平较缺氧复氧组下降(Plt; 0.05),Bcl-2蛋白表达变化不明显。结论HMGB1-TLR4轴可促进缺氧复氧介导的大鼠肾小管上皮细胞凋亡。
高迁移率族蛋白1;Toll样受体4;细胞凋亡
缺血再灌注损伤(ischemia/reperfusion injury, I/R)与缺氧复氧性损伤(anoxia/reoxygenation injury,A/R)都与肾小管上皮细胞凋亡有关[1],进一步研究肾小管上皮细胞凋亡的调控机制将为急性肾损伤的临床治疗奠定理论基础。
高迁移率族蛋白1(high mobility group box 1, HMGB1) 作为内源性危险性信号分子,一旦释放到胞外则具有促炎性反应作用。应激状态、机体损伤、炎性反应和坏死性细胞死亡等过程中都可以引起HMGB1的释放[2]。HMG 分子B box模序可与Toll样受体4(toll-like receptor 4, TLR4) 结构域结合,进一步激活细胞核因子kappa B(nuclear factor kappa B, NF-κB)等信号通路,促进IL-lβ和TNF-α等炎性因子释放[3- 4]。HMGB1-TLR4在肾脏缺血再灌注损伤中的作用及调控机理尚不清楚,本实验将检测HMGB1和TLR4在缺氧复氧介导的肾小管上皮细胞中的表达,探讨二者在肾小管上皮细胞凋亡中的作用机制。
1 材料与方法
1.1 材料
DMEM培养基、胎牛血清(Gibco公司);总RNA提取试剂盒(Tiangen公司);RT-PCR MasterMix kit(Toyobo公司);BCA总蛋白定量试剂盒(Thermo Scientific公司);抗体(Santa Cruz公司);PCR引物(北京赛百盛生物技术有限公司);rTaq酶 和dNTP(Takara公司);AnnexinV/P染色凋亡检测试剂盒(上海博谷生物公司)。
1.2 方法
1.2.1 细胞培养及体外A/R模型制备:6 只清洁级3月龄雄性Wistar大鼠(体重量约200 g)(南昌大学实验动物学部,合格证号:医字第021/96-002号)。原代肾小管上皮细胞(primary renal tubular epithelial cell)分离方法:腹腔注射戊巴比妥钠(50 mg/kg)麻醉大鼠,腹正中线切开,以含有蛋白胶原酶的克雷布斯-汉斯莱特(Krebs Henseleit)缓冲液6 mL/min灌注两侧肾脏,取肾脏皮质,在缓冲液中研磨,消化2~3 min,消化后的悬液经80 μm筛网过滤,密度梯度离心,接种在直径100 mm培养皿,在含10%胎牛血清,5% CO237 ℃条件下培养,细胞生长至汇集后用于实验。
体外 A/R 模型参照文献[5]进行ATP 耗竭时,吸去含10%胎牛血清的改良的DMEM培养液,温PBS洗两次,换用含10 mol/L抗霉素A,1. 5 mmol/L CaCl2和2 mmol/L MgCl2的PBS,将待缺氧细胞的培养板放入37 ℃密闭恒温培养箱中, 通入气体流量为100 mL/min的95% N2+5% CO2混合气体进行缺氧处理60 min。随后更换含10%胎牛血清的完全培养液,再放入含95% O2+5% CO2培养箱作复氧处理。分组:对照组、缺氧复氧组(A/R)、HMGB1抗体处理组和TLR4抗体处理组。在A/R后细胞的培养液中分别加入一定浓度的HMGB1抗体和TLR4抗体,于5% CO237 ℃条件下孵育24 h。
1.2.2 RT-PCR:收集PTECs细胞,按试剂盒说明书提取总RNA。用 Exscript RT试剂盒反转录成 cDNA,进行定量 PCR 扩增。引物:HMGB1上游5′-TGCTCAT ATCGAGCTAAGG-3′,下游5′-CCATACGTACCAGC AAGGT-3′;TLR4上游:5′-CTGGTTGCAGAAAATG CCA-3′,下游:5′- CGCAGAGTTTTGTACTCC- 3′。反应条件为95 ℃ 5 min,94 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 1 min,30个循环,72 ℃ 10 min。
1.2.3 Western blot检测蛋白表达:利用预冷RIPA对细胞进行裂解并提取总蛋白,BCA法测定其浓度后95 ℃变性5 min。SDS-PAGE电泳,上样量为80 μg。以150 mA 3 h转PVDF膜。3%脱脂奶粉封闭抗原1 h 后,加入一抗(1∶1 000比例稀释),4 ℃过夜,tween20-Tris缓冲盐溶液(TBST)洗膜3次,每次5 min。HRP-IgG(1∶2 000比例稀释),室温孵育1 h,TBST洗膜3次,加入电化学发光(ECL)显色液曝光显影。
1.2.4 流式细胞仪检测细胞凋亡:参照 AnnexinV/PI 染色凋亡检测试剂盒操作步骤进行。
2 结果
2.1缺氧复氧前后PTECs中HMGB1和TLR4的表达
与对照组相比,A/R组PTECs细胞中HMGB1和TLR4的mRNA和蛋白表达均显著增高(Plt;0.01)(图1)。
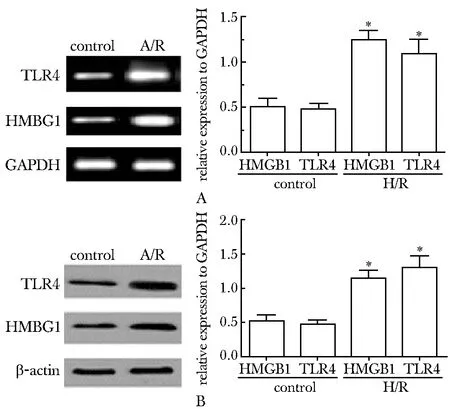
A.HMGB1 and TLR4 mRNA levels and quantification; B.HMGB1 and TLR4 expressions and quantification; *Plt; 0.01 compared with control图1 A/R前后PTECs中HMGB1和TLR4的表达Fig 1 Expression of HMGB1 and TLR4 in PTECs before and after A/R(±s, n=3)
2.2 缺氧复氧前后PTECs细胞凋亡
缺氧复氧损伤组的PTECs细胞凋亡显著高于对照组(14.75%vs7.83%,Plt; 0. 01)(图2)。
2.3缺氧复氧前后PTECs中Bcl-2、Bax、CHOP和caspase-8的表达
A/R组PTECs细胞中Bax、CHOP和caspase-8的蛋白表达量均明显高于对照组(Plt; 0.01),而Bcl-2的则显著低于对照组(Plt; 0.05)(图3)。
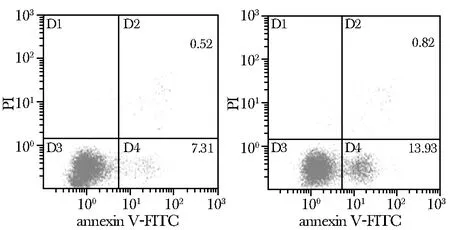
A.control; B.A/R图2 A/R前后PTECs凋亡Fig 2 Apoptosis of PTECs before and after A/R
2.4HMGB1和TLR4抗体处理后PTECs细胞凋亡及凋亡相关分子的表达
HMGB1和TLR4抗体干预组的PTECs凋亡显著低于A/R组 (10.89%vs14.75%,Plt; 0.05;9.13%vs14.75%,Plt; 0.05)(图4A,B)。与A/R组相比,HMGB1和TLR4抗体干预组PTECs细胞中Bax、CHOP 和 caspase-8的蛋白表达量均明显下调(Plt; 0.05),Bcl-2表达量变化不明显(图4C)。
3 讨论
肾脏缺血再灌注损伤(ischemia reperfusion injury, IRI)是肾移植过程的必然结果,其严重程度与急性和慢性排异反应的发生密切相关。TLR受体家族活化是肾脏IRI触发自身免疫反应的重要途径之一,其中TLR4在引起急性肾损伤和介导自身免疫反应发生过程中起重要作用[6]。同时,IRI还可引起低氧或坏死组织细胞表达和释放一系列TLR4內源配体,如HMGB1,热休克蛋白(heat shock protein, HSP),胞外基质组分双链蛋白多糖以及乙酰肝素等,它们可与TLR4结合并将其活化[7]。
HMGB1是一种低分子量非DNA结合组蛋白,是新发现的一种“晚期炎性反应介质”, 它能上调黏附分子,细胞因子和炎性反应趋化因子,并在与其受体TLRs和高度聚糖化作用终产物受体(RACE) 结合后促进缺血再灌注损伤[2]。HMGB1与TLR4结合可以激活TLR4信号途径,促进炎性因子的生成与释放,引起炎性反应。HMGB1的表达受TLR4调节,反过来它又可以激活TLR4途径放大与维持炎性反应应答[8]。另外,研究表明TLR4介导的细胞因子TNF-α和IL-6的释放可促进细胞凋亡[9]。同时TLR4也可通过其下游信号分子MyD88依赖和非依赖型途径诱导细胞凋亡[10]。但是,目前对HMGB1是否参与了IRI后TLR4介导的细胞凋亡过程以及其作用机制的研究尚不明确。
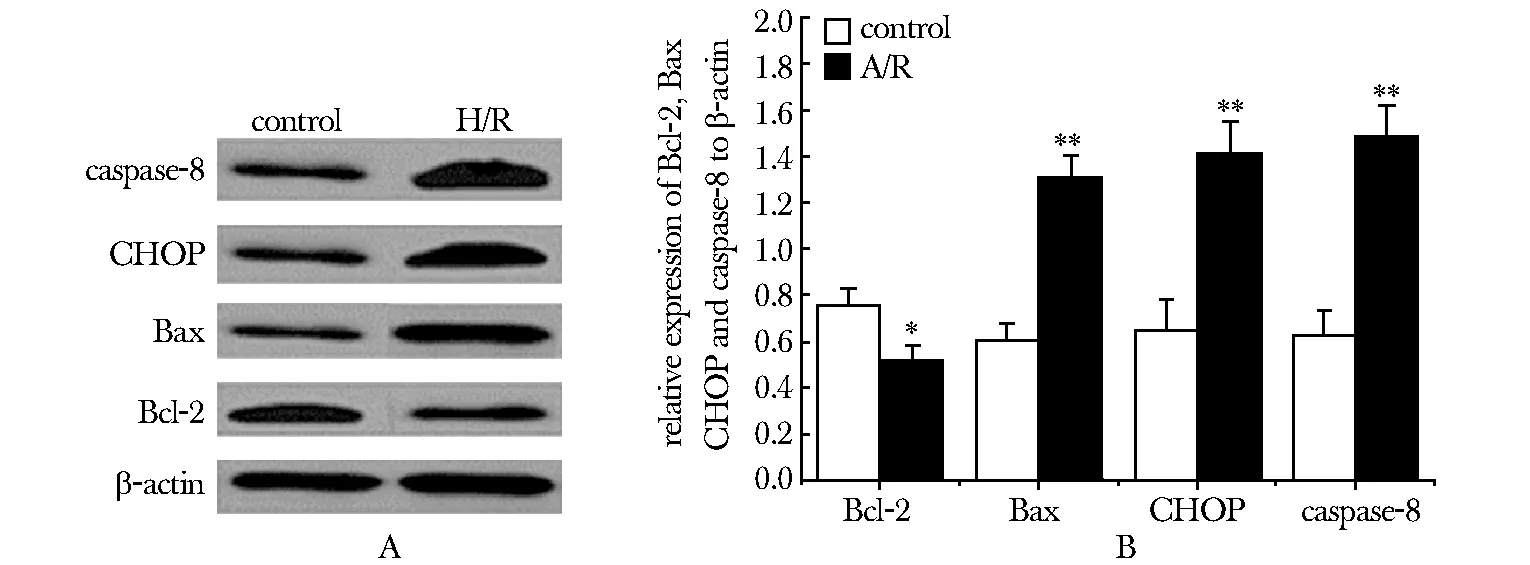
A.Bcl-2, Bax, CHOP and caspase-8 expression in PTECs; B.quantification of the expressions;*Plt; 0.05,**Plt; 0.01 compared with control

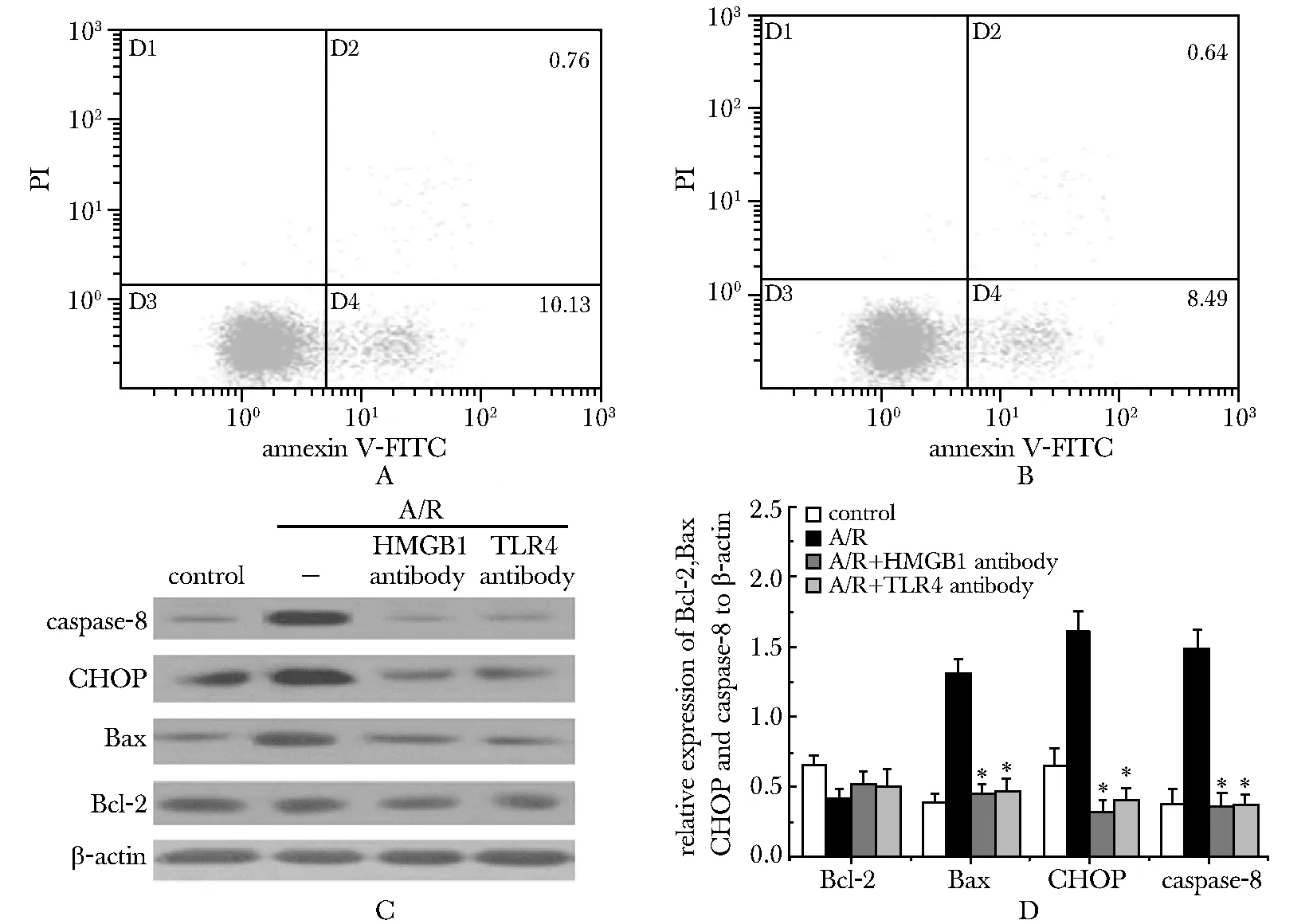
A.HMGB1 antibody treatment after A/R; B.TLR4 antibody treatment after A/R; C.Bcl-2, Bax, CHOP and caspase-8 expression in PTECs;*Plt; 0.05 compared with A/R
图4HMGB1和TLR4抗体处理后PTECs细胞凋亡及凋亡相关分子的表达
相关研究发现,IRI可促进正常和TLR4缺陷型心肌细胞中HMGB1产生,而TLR4缺失则缓减了IRI诱导的心肌细胞凋亡[11],说明在HMGB1-TLR4参与了IRI介导的心肌细胞凋亡进程,同时,封闭HMGB1或TLR4能有效抑制炎性反应并减弱缺血再灌注后心肌细胞的损伤[12]。与上述结果一致,本研究也证实了在肾小管上皮细胞中HMGB1-TLR4轴参与了IRI诱导的细胞凋亡过程。Bcl-2家族中促细胞凋亡因子(Bax)和抗凋亡因子(Bcl-2)之间的平衡决定了细胞在一定的刺激和损伤后存活或凋亡的命运[13]。活化的caspase通路能影响线粒体功能,加剧细胞凋亡。内质网应激可引起该通路中促凋亡因子CHOP 表达的上调[14]。本实验发现在IRI诱导HMGB1-TLR4轴活化后促使细胞中促凋亡因子表达上调。
综上,HMGB1-TLR4轴在缺氧复氧诱导的肾小管上皮细胞中高表达,并通过上调caspase 8、Bax和CHOP促进细胞凋亡,最终加剧细胞损伤。 HMGB1-TLR4轴有望成为治疗急性肾衰竭的新靶点。
[1] 杨永红, 李建华. Apocynin 对缺氧复氧后肾小管上皮细胞凋亡的干预研究 [J]. 武警医学, 2009, 20: 337- 340.
[2] Klune JR, Dhupar R, Cardinal J,etal. HMGB1: endogenous danger signaling [J]. Mol Med, 2008,14: 476- 484.
[3] Vezzani A, Maroso M, Balosso S,etal. IL-1 receptor/Toll-like receptor signaling in infection, inflammation, stress and neurodegeneration couples hyperexcitability and seizures [J]. Brain Behav Immun, 2011,25:1281- 1289.
[4] Kim SW, Lim CM, Kim JB,etal. Extracellular HMGB1 released by NMDA treatment confers neuronal apoptosis via RAGE-p38 MAPK/ERK signaling pathway [J]. Neurotox Res, 2011,20:159- 169.
[5] Bacallao R, Garfinkel A, Monke S,etal. ATP depletion: a novel method to study junctional properties in epithelial tissues. I. Rearrangement of the actin cytoskeleton [J]. J Cell Sci, 1994,107:3301- 3313.
[6] Wu H, Steenstra R, de Boer EC,etal. Preconditioning with recombinant high-mobility group box 1 protein protects the kidney against ischemia-reperfusion injury in mice [J]. Kidney Int, 2014,85:824- 832.
[7] Ben Mkaddem S, Pedruzzi E, Werts C,etal. Heat shock protein gp96 and NAD(P)H oxidase 4 play key roles in Toll-like receptor 4-activated apoptosis during renal ischemia/reperfusion injury [J]. Cell Death Differ, 2010,17:1474- 1485.
[8] Kim S-C, Ghanem A, Stapel H,etal. Toll-like receptor 4 deficiency: smaller infarcts, but nogain in function [J]. BMC Physiology, 2007,7:1- 10.
[9] Rusai K, Sollinger D, Baumann M,etal. Toll-like receptors 2 and 4 in renal ischemia/reperfusion injury [J]. Pediatr Nephrol, 2010,25:853- 860.
[10] Mkaddem SB, Chassin C, Vandewalle A. Contribution of renal tubule epithelial cells in the innate immune response during renal bacterial infections and ischemia-reperfusion injury [J]. Chang Gung Med J, 2010, 33:225- 240.
[11] Xu H, Yao Y, Su Z,etal. Endogenous HMGB1 contributes to ischemia-reperfusion-induced myocardial apoptosis by potentiating the effect of TNF-alpha/JNK [J]. Am J Physiol Heart Circ Physiol, 2011,300:913- 921.
[12] Yao Y, Xu X, Zhang G,etal. Role of HMGB1 in doxorubicin-induced myocardial apoptosis and its regulation pathway [J]. Basic Res Cardiol, 2012,107: 1- 12.
[13] Dong Y, Undyala VV, Gottlieb RA,etal. Autophagy: definition, molecular machinery, and potential role in myocardial ischemia-reperfusion injury [J]. J Cardiovasc Pharmacol Ther, 2010,15:220- 230.
[14] Gao X, Fu L, Xiao M,etal. The nephroprotective effect of tauroursodeoxycholic acid on ischaemia/reperfusion-induced acute kidney injury by inhibiting endoplasmic reticulum stress [J]. Basic Clin Pharmacol Toxicol, 2012,111:14- 23.
HMGB1-TLR4 promotes anoxia/reoxygenation injury-mediated apoptosis of rat proximal tubular epithelial cells
YIN Jin-feng1, LIU Xiu-juan2*, SHEN Jiang-shan1, ZHOU Yang1, YIN Xiu-ying2
(1.Dept. of Nephrology, the Fourth Affiliated Hospital of Nanchang University, Nanchang, 330000;2.Dept. of Nephrology, 94 Hospital of Chinese PLA, Nanchang, 330000, China)
ObjectiveTo study the expression of high mobility group box-1 protein (HMGB1) and Toll-like receptor 4 (TLR4) in renal proximal epithelial cells following by anoxia/reoxygenation injury and the underlying mechanisms in cell apoptosis.MethodsRat primary proximal tubule epithelial cells (PTECs) were cultured and randomly divided into control, anoxia/reoxygenation group(A/R), HMGB1 antibody treatment group (A/R+HMGB1) and TLR4 antibody treatment group (A/R+TLR4). RT-PCR was used to detect the mRNA level of HMGB1 and TLR4; Western blot was used to detect the protein expression of HMGB1, TLR4 and the apoptosis-related factors. Flow cytometry was used to detect apoptosis.ResultsThe expression of mRNA and protein of TLR4 and HMGB1 significantly increased in A/R group as compared to control(Plt; 0.01). The apoptosis cells in A/R group increased significantly compared as with control (Plt; 0.01). The expression of Bax, CHOP and caspase-8 significantly increased as compared with control (Plt; 0.01). While the expression of Bcl-2 decreased(Plt; 0.05). After HMGB1 and TLR4 antibodies treatment, the apoptosis cells in A/R+HMGB1 group and A/R+TLR4 group significantly decreased as compared to A/R group (Plt; 0.05). The expression of Bax, CHOP and caspase-8 also decreased significantly as compared with A/R group (Plt; 0.05). The change of Bcl-2 protein expression was not obviously.ConclusionsHMGB1-TLR4 axis promotes apoptosis of PTECs following A/R injury.
HMGB1; TLR4; apoptosis
2013- 10- 21
2014- 05- 19
国家自然科学基金(81260114);南京军区医药卫生科研项目(2007151193)
*通信作者(correspondingauthor):liuxinfanjian@126.com
1001-6325(2014)07-0909-05
研究论文
R 322.6+1
A
