肝移植术后血管并发症及其治疗进展
2014-11-23杨翰张水军郑州大学第一附属医院肝胆胰外科河南省肝移植中心河南省消化器官移植重点实验室郑州450052
杨翰,张水军(郑州大学第一附属医院肝胆胰外科,河南省肝移植中心,河南省消化器官移植重点实验室,郑州 450052)
肝移植术是各种肝病终末期的唯一有效治疗手段。受益于器官保存方法、新型免疫抑制剂的应用及现代外科技术的创新发展,国内较大的移植中心肝移植受者围手术期病死率已降至 5%以下,术后1、5、10年生存率也已分别达到90%、80%和70%[1]。但是术后血管并发症仍然是影响肝移植受者生存质量和生存率的重要因素。
肝移植术后血管并发症主要包括肝动脉、肝静脉和门静脉病变,虽然少见,但能导致严重的后果,是引起移植物丢失和受体死亡的重要原因之一。任何形式、任何部位的血管吻合都可能导致出血、狭窄、血栓、血管瘤等并发症,总体发生率为8%~ 15%[2-6],在劈离式肝移植和活体供肝肝移植受者中甚至可达20%[3]。例如,肝动脉血栓形成(hepatic artery thrombosis,HAT)和门静脉血栓形成(portal vein thrombosis,PVT)影响供肝血供,引起早期移植物丢失、远期器官功能障碍,严重时可导致受者死亡,所以,肝移植术后血管并发症一经发现必须积极治疗[4]。
血管并发症的治疗主要有血管内介入治疗和外科手术两种方法,前者包括经皮腔内血管成形术(percutaneous transluminal angiography,PTA)、 动脉内溶栓治疗(intra-arterial thrombolysis,IAT)、支架置入术和介入栓塞等,后者包括血栓切除术、再吻合术以及再次移植。以前,外科手术是解决肝移植术后血管并发症的首选,而随着血管内介入技术的不断进步,越来越多的肝移植中心已将其作为解决这一问题重要的、可行的选择。
1 动脉并发症
动脉并发症是肝移植术后最常见的血管并发症(> 50%)[4-5,7-9],包括 HAT、肝动脉狭窄(hepatic artery stenosis,HAS)、肝动脉扭转(hepatic artery kinks,HAK)和动脉瘤等。
1.1 HAT
根据移植术后血栓发生的时间,可以将HAT分为早期(4周内)和晚期。HAT的临床症状因血栓发生时间的早晚而不同,可能只表现为转氨酶异常、发热,严重时会出现由继发胆道并发症引起的脓毒症,甚至是移植失败。早期HAT可能与吻合技术、肝动脉病变有关[9],能引起胆管缺血坏死及脓毒症,较晚期HAT病死率高,必须进行及时干预。晚期HAT通常是由缺血性或免疫性损伤引起的[6],超过50%的受者没有临床症状而只有肝功能检测异常[10-11],且HAT出现得越晚,代偿循环越完善,临床症状也就越不明显。也有研究提示,肝移植术后早期HAT发生率高可能与晚期HAT症状隐匿及诊疗经验不足有关[5]。
与HAT相关的因素可分为以下几类[4-5,8-13](表1)。巨细胞病毒(CMV)抗体阴性的受体接受CMV阳性移植物是晚期HAT的危险因素,预防性应用更昔洛韦对预防HAT有一定的价值[12]。虽然HAS和HAK被当做是HAT的触发事件,但是术后早期由于缺血/再灌注损伤、凝血机制紊乱使血液呈高凝状态,能够在无解剖学缺陷基础上导致HAT的发生[4-5,8]。引起HAT的因素还包括动脉内径细小 (<3 mm)、手术时间长、输血量大(全血>6 U或新鲜冰冻血浆≥15 U)等。其他与移植手术或操作无关的因素对HAT的发生同样扮演着重要角色。例如,经导管肝动脉化疗栓塞术(transarterial chemoembolization,TACE)作为肝细胞肝癌肝移植术前的“过渡”或“降期”治疗手段,能够导致动脉周围炎,进而诱发HAT。
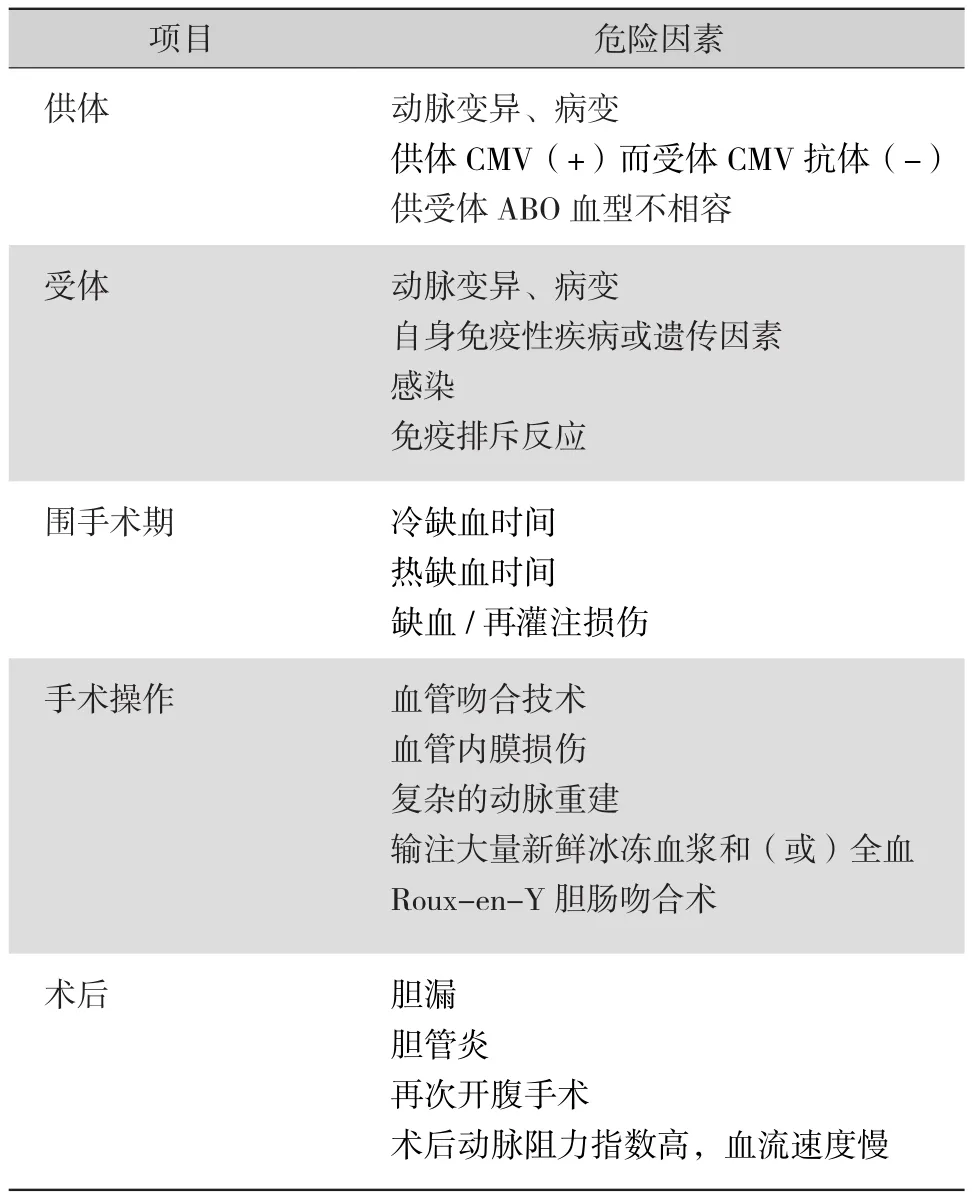
表1 肝移植术后HAT形成的危险因素[4-5,8-13]
以前,再次移植是治疗早期HAT的主要手段,如今越来越多地被血管内介入治疗所取代。研究表明,利用PTA/支架置入术控制HAS可将HAT的发生率降低3倍[14]。但是血管内介入治疗所引起的血栓形成、血管损伤甚至破裂出血的风险也应引起重视。在血管内介入无效或禁忌的情况下,应考虑血管重建及再次移植等外科手术治疗[15]。
IAT亦可选择性应用于HAT的治疗。IAT最常见的并发症是出血,对近期(<2周)行腹部手术的受者是禁忌证,必须在监测纤维蛋白原水平、凝血酶原时间(PT)及活化部分凝血活酶时间(APTT)情况下指导溶栓药物的使用。
Singhal等[5]报道溶栓治疗的成功率为68%(47/69),在溶栓成功的47例患者中,有29例之后又接受了PTA和(或)支架置入术。此外,IAT禁忌时可以选择经皮血栓切除术。
Duffy等[4]报道了 1984—2007年间4 234例肝移植患者,203例术后出现HAT,其中早期133例,晚期70例。总体中有90例受者进行了手术探查、血栓切除术或再吻合术,9例采用导管介入溶栓,13例接受了内科抗凝治疗。在接受血栓切除术或再吻合术的早期HAT受者中,只有9例(10%)挽救了移植物,其余均需再次移植。203例受者中有153例(75%)必须进行再次移植,但其生存率高于溶栓治疗的受者。国内高海军等[16]报道了3例肝移植术后急性HAT患儿,2例患儿行肝动脉重新吻合及取栓治疗;1例行动脉内溶栓、PTA及支架治疗,均获得了较好疗效,肝功能恢复正常。
1.2 肝动脉动脉瘤和假性动脉瘤
肝动脉动脉瘤和假性动脉瘤是肝移植术后非常罕见的并发症,远低于肝移植术后其他血管并发症的发生率,但病死率非常高(>50%)[6]。这类血管并发症通常没有症状,需要通过内脏血管造影或灌注成像来诊断[17]。动脉瘤并发症可以分为肝外型和肝内型,肝外型最严重的表现是破裂出血后引起的低血压,出血可以发生在胃肠道系统或者腹腔内,亦可表现为胆道压迫和梗阻[8];肝内型通常是医源性的,发生在肝穿刺活检或支架植入的部位。多数受者的出血可以通过弹簧圈栓塞来解决,但某些情况下也需急诊行剖腹探查术。
外科手术或血管内介入对肝动脉动脉瘤和假性动脉瘤均有较好的疗效,但血管内介入能够更快地控制出血,减少输血,缩短住院时间[18]。
此外,由于活体供肝肝移植血管重建多而复杂,加上供肝动脉缩短,术野深,供受体动脉不匹配或者使用动脉移植物等,这些受者动脉并发症的发生率更高[19-20]。术前细致评估肝动脉以及显微外科技术在术中的应用,可以减少活体供肝肝移植术后血管并发症的发生,血管内介入治疗也在最近的研究中表现出良好的疗效[21]。
2 静脉并发症
肝移植术后静脉并发症较动脉并发症少见(2%)[2],通常发生在肝静脉、门静脉系统和下腔静脉,包括PVT、门静脉狭窄(portal vein stenosis,PVS)、肝静脉、下腔静脉狭窄或闭塞等。
2.1 门静脉并发症
门静脉并发症主要是PVS和PVT,它们的临床表现缺乏特异性,轻者没有任何临床症状,重者出现肝功能异常或因门静脉高压而出现顽固性腹腔积液、上消化道大出血等。门静脉并发症的危险因素包括血管吻合技术、术前即已存在门静脉病变、管径小(<5 mm)门静脉血流减少、高凝状态或供受体门静脉管径不匹配以及门静脉重建时使用移植血管等[22]。Yerdel等[23]指出,男性、术前存在严重门脉高压症病史或行经颈静脉肝内门体静脉分流术(TIPS)、硬化剂治疗、门腔分流术和脾切除治疗的肝移植受者、术前存在门静脉血栓等病变的肝移植受者术后门静脉并发症的发生率高达12.5%。Buell等[24]研究发现,使用冻存静脉作为流出道时,术后静脉并发症的发生率为6.3%,未使用冻存静脉则能使这一风险降低至1.0%。
血栓切除术、再吻合术、门腔静脉分流术以及再次移植等外科手术治疗,受创伤大、并发症多、门脉长度不够、病死率高、肝源紧张等因素的限制,逐渐被血管内介入治疗所取代。与动脉并发症相比,静脉并发症通常对PTA、支架植入等方式的反应性较好[1,25-28],血管内介入治疗是目前肝移植术后静脉并发症的一线治疗方案[29-30]。门静脉并发症的标准治疗方案是经皮肝穿刺,结合受者及并发症特点,辅以球囊扩张术、支架植入术和药物溶栓等。
此外,由于肝脏的血供特点,PVT后再次移植比HAT后再次移植更具危险性,一旦介入治疗失败,必须及时手术治疗。
2.2 下腔静脉并发症
下腔静脉狭窄和(或)血栓形成发生率较低,Sánchez-Bueno等[31]报道的2 379例肝移植中仅发现12例明显的下腔静脉狭窄。Merhav等[32]也只在600例肝移植中发现4例下腔静脉血栓形成。此类并发症好发于吻合口部位,主要归因于吻合技术缺陷、肝脏/血肿压迫等,与布-加综合征或下腔静脉闭塞综合征有相似的临床表现。PTA和支架植入是治疗下腔静脉狭窄的首选方法,当出现严重狭窄或血栓形成等并发症时,则需要手术进行血管重建以挽救移植物及受者生命。
3 结 语
即便是在移植技术不断进步的今天,血管并发症仍是导致移植物丢失、术后病死率增加的重要因素。动脉并发症最常见,发生在移植术后早期,与移植物丢失及受体高病死率有关。相反,静脉并发症较少,一般对移植物丢失及受体病死率没有显著影响。血管并发症一经发现,必须及时处理,只有这样才能够有效减少受体病死率及再移植的可能。目前,各中心对于移植术后血管并发症的治疗遵循多样化和个体化的原则,血管内介入治疗正在发挥越来越重要的作用,而外科治疗作为传统有效的治疗手段依然占据重要地位。
