番鸭细小病毒VP3基因和鸭IL-2基因真核融合表达载体的构建
2014-11-23董嘉文李林林孙敏华袁建丰邝瑞欢胡奇林
董嘉文,李林林,孙敏华,袁建丰,邝瑞欢,胡奇林
(广东省农业科学院动物卫生研究所 广东省兽医公共卫生公共实验室,广东 广州 510640)
番鸭细小病毒病是由番鸭细小病毒(MDPV)引起的一种急性传染病,主要侵害1~3周龄的雏番鸭,故又称为“三周病”。其发病率为26%~62%,病死率为22%~43%,是目前番鸭饲养业种危害最严重的传染病之一,严重地影响了养鸭业的发展[1]。目前,番鸭细小病毒病的预防主要以弱毒疫苗为主,但弱毒疫苗存在着毒力返强的缺点,而基因工程疫苗如核酸疫苗具有安全、稳定性好、能诱导体液免疫和细胞免疫应答等诸多优点,是未来疫苗的发展方向。
MDPV的基因组为单链、线状DNA,MDPV全长均为5 132 bp。VP3是病毒的主要衣壳蛋白,该基因全长1 605 bp,编码534个氨基酸,能诱导机体产生抗体,也是MDPV的免疫保护性抗原[2-3]。白细胞介素-2(interleukin-2,IL-2)能诱导T淋巴细胞增殖,刺激细胞分泌IFN-γ等细胞因子,促进机体的细胞免疫反应;同时也能激活B淋巴细胞,参与机体的体液免疫应答[4]。CpG基序可直接活化免疫细胞,诱导Thl型细胞因子的产生,增强针对编码抗原的特异性免疫应答[5]。
因此,本研究将VP3基因和免疫刺激基序(CpG)克隆至真核表达质粒pIRES-dIL2,构建了番鸭细小病毒核酸疫苗质粒pIRES-dIL2-VP3-CpG,并在BHK-21细胞中获得表达。本试验在国内首次把CpG基序引入含有表达MDPV VP3基因的核酸疫苗质粒中,为研制新型番鸭细小病毒核酸疫苗奠定基础,具有重要的理论和实际意义。
1 材料与方法
1.1 病毒、质粒和单抗 MDPV gd分离株由本实验室分离鉴定和保存;pMD-dIL2质粒由华南农业大学兽医学院罗满林教授惠赠;pIRES-dIL2质粒由本实验室构建和保存;鼠抗MDPV单克隆抗体由本实验室制备。
1.2 主要试剂 限制性内切酶Nhe I和Xho I,购自NEB;预混Ex Taq、T4 DNA连接酶、MiniBest病毒RNA/DNA抽提试剂盒、DNA Marker,购自TaKaRa公司;DNA凝胶回收试剂盒和小量质粒提取试剂盒,购自天根生物科技(北京)有限公司;质粒中提试剂盒,购自QIAGEN公司;羊抗鼠IgG为Protein Tech Group公司产品。
1.3 MDPV VP3基因的克隆
1.3.1 引物合成 根据GenBank已发表的MDPV全基因组设计并合成了1对引物,扩增片段为1 623 bp。90 bp的CpG序列[7-9]含有6个GTCGTT基序、3个TTGCTT基序和2个AGCGCT基序,基序间以TT相连,由上海捷瑞生物工程有限公司合成并克隆至pGHB2317G载体。
MVP3-F:5'-CTAGCTAGCATGGCAGAGGGAG GAA-3'(Nhe I);
MVP3-R:5'-CCGCTCGAGTTACAGATTCTGA GTCAA-3'(Xho I);
CPG:5'-CG ACGCGT GTCGTT TT GTCGTT TT GTCGTT TT TTGCTT TC TTGCTT TC TTGCTT TC A GCGCT AGCGCT TC GTCGTT TT GTCGTT TT GTCGTT ACGCGT GC-3'(Mlu I)。
1.3.2 PCR扩增 用病毒RNA/DNA抽提试剂盒提取病毒DNA。PCR反应体系为:预混Ex Taq 25 μL,引物各2 μL,模板DNA 4 μL,用蒸馏水补至50 μL。PCR反应条件为:95℃预变性5 min、94℃变性30 s、55℃退火30 s、72℃延伸2 min,共30个循环,最后72℃延伸10 min。
1.4 MDPV核酸疫苗重组质粒的构建及鉴定 用Nhe I和Xho I双酶切重组表达质粒pIRES-dIL2和VP3基因,按照常规方法构建重组表达质粒pIRES-dIL2-VP3。用MluⅠ酶切pIRES-dIL2-VP3和pGH-CPG,按常规方法构建重组表达质粒pIRES-dIL2-VP3-CPG。将构建好的质粒送测序进行进一步鉴定。
1.5 MDPV核酸疫苗重组质粒转染细胞 在24孔培养板中接种传代BHK-21细胞,当细胞长满至80%单层,将营养液弃掉,用Hank′s洗涤细胞两遍。接种转染试剂,即在50 μL DMEM中加入Lipofectamine TM 2000轻轻混匀,另外取 50 μL DMEM加入纯化质粒DNA 1 μg混匀;然后将上述两种稀释液混合,室温孵育20 min,加入细胞板内,置37℃5%CO2培养箱内作用5 h,更换新鲜配制的含2%FCS继续培养24 h,收取细胞。
1.6 间接荧光抗体试验检测 pIRES-dIL2-VP3-CPG质粒转染24 h后,弃去细胞生长液,用PBS(pH值7.4)轻轻洗涤细胞3次;将转染的细胞用乙醇:丙酮(4∶6)混合液室温固定10 min,自然晾干后将鼠抗MPV单克隆抗体作为一抗(1∶50稀释),37℃湿盒内孵育 l h;PBS洗涤3次,加入FITC 标记的羊抗鼠 IgG(1∶100倍稀释),37℃1 h后,PBS洗涤3次,在荧光倒置显微镜下镜检。试验同时设pIRES空载体转染细胞作为对照。
2 结果
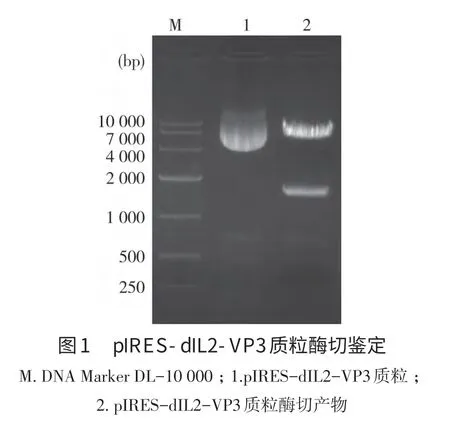
2.1 MDPV核酸疫苗重组质粒的构建 用Nhe I、Xho I双酶切pIRES-dIL2和VP3基因,把VP3基因定向克隆至pIRES-dIL2中,构建重组表达质粒pIRES-dIL2-VP3转化、提取质粒再进行双酶切鉴定。从图1可见长约6 460 bp(pIRES-dIL2)和1 605 bp(VP3基因)DAN条带。重组表达质粒pIRES-dIL2-VP3和pGH-CpG同时经过MluⅠ酶切、连接和转化,构建出重组表达质粒pIRES-dIL2-VP3-CpG。从图2可见长约90 bp的CpG片段。由此证明,pIRES-dIL2-VP3-CpG重组表达质粒已经成功构建。
2.2 间接免疫荧光抗体法检测质粒在 BHK-21的瞬时表达 pIRES-dIL2-VP3-CpG重组质粒以脂质体法转染BHK-21细胞,进行间接免疫荧光试验,从图中可以看到细胞浆内出现了绿色荧光(图3a),进一步表明了pIRES-dIL2-VP3-CpG质粒成功地在真核细胞内表达,而pIRES空载体转染的细胞没有检测到荧光(图3b)。


3 讨论
MDPV基因组含有主要两个开放阅读框架(ORF),左侧ORF编码非结构蛋白(NS)右侧ORF编码3种结构蛋白,VP2和VP3基因编码的氨基酸位于VP1基因内部。VP3是病毒的主要衣壳蛋白,约占总蛋白含量的80%。Le Gall-Recule[1]等利用杆状病毒系统表达MDPV衣壳蛋白(VP2-VP3),Western blotting证实重组的衣壳蛋白可以与MPV抗血清反应。李雪梅等[9]将鹅细小病毒(GPV)番鸭细小病毒(MPV)主要结构蛋白(VP2-VP3)基因克隆到核酸疫苗质粒pIRES1neo载体上构建了核酸疫苗,转染鸭胚成纤维细胞后,并对其表达产物进行Western blotting检测。国内外学者利用真核表达系统表达了禽IL-2蛋白,探讨了禽IL-2真核表达质粒和重组蛋白作为疫苗佐剂应用的潜力[10-11]。近年来,CpG免疫佐剂已经用于家禽和水禽的DNA疫苗研究中,石星明等[8]将CpG基序克隆至真核表达载体可作为新城疫病毒DNA疫苗的高效免疫增强剂,提高抗原特异性免疫应答,诱导高水平保护性抗体。
本研究将VP3基因和CpG基序克隆至质粒pIRES-dIL2中,构建了核酸疫苗质粒pIRES-dIL2-VP3-CpG,通过脂质体法转染BHK-21细胞,间接免疫荧光试验证明,转染质粒可在细胞浆中检测到绿色荧光,表明本试验构建的核酸疫苗质粒能在真核细胞内表达。引入CpG基序的MDPV核酸疫苗质粒的成功构建和表达为探索CpG作为MDPV核酸疫苗免疫增强剂的可能性以及为研制新型番鸭细小病毒核酸疫苗奠定了基础。
[1]Le Gall-Recule G,Jestin V,Chagnaud P,et al.Expression of muscovy duck parvovirus capsid proteins(VP2and VP3)in a baculovirus expression system and demonstration of immunity induced by the recombinant proteins.Journal of General Virology[J].1996,77,2159-2163.
[2]程由铨,胡奇林,陈少莺,等.番鸭细小病毒和鹅细小病毒生化及基因组特性的比较[J].中国兽医学报,2001,21(5):429-433.
[3]Le Gall-Recule G,Jestin V.Biochemical and genomic characterization of muscovy duck parvovirus.Archives of Virology[J].1994,139(1-2):121-131.
[4]Swain S L.Lymphokines and the immune response:the central role of interleukin-2[J].Curr Opin Immunol,1991,3(3):304-310.
[5]Krieg A M,Hartmann G,Yi A K.Mechanism of action of CpG DNA[J].Curr top Microbiol Immunol,2000,247:1-21.
[6]朱鸿飞,朱建中,李光富,等.体外筛选对鸡具有免疫刺激活性的CpG寡脱氧核苷酸[J].南京农业大学学报,2004,27(2):83-86.
[7]李杰,杨汉春,郭鑫,等.CpG ODN对鸡新城疫LaSota活疫苗的免疫增强效应[J].畜牧兽医学报,2006,37(1):44-49.
[8]石星明,王玫,张晶,等.CpG基序对新城疫病毒DNA免疫效果的影响[J].中国预防兽医学报,2010,32(7):554-558.
[9]李雪梅,章金刚,向华,等.鹅细小病毒和番鸭细小病毒核酸疫苗重组质粒的构建及表达[J].生物技术通讯,2002,13(6):433-435.
[10]Sreekumar E,Premraj A,Rasool T J.Duck(Anas platyrhynchos),Japanese quail(Coturnix coturnix japonica)and other avian interleukin-2 reveals significant conservation of gene organization,promoter elements and functional residues[J].Int J Immunogenet,2005,32(6):355-365
[11]Jai-Wei Lee,Yu-Ming Lin,Ting-Ying Yen,et al.CpG oligodeoxynucleotides containing GACGTT motifs enhance the immune responses elicited by a goose parvovirus vaccine in ducks[J].Vaccine,2010(28):7956-7962.
