一株鸭肝炎病毒的分离与鉴定
2014-11-23孙林杰王雪平宋国亮陈凌燕焦金波白朝勇
孙林杰,王雪平,宋国亮,2,陈凌燕,焦金波,白朝勇,2*
(1.国家兽用药品工程技术研究中心,河南洛阳471000;2.普莱柯生物工程股份有限公司,河南洛阳471000)
鸭肝炎(DH)是一种传播迅速并高度致死雏鸭的疫病,以肝炎为主要特征[1],主要侵害4周龄内雏鸭,特别是不足1周龄的雏鸭最易感染,死亡率高达 90% 以上[2]。1992 年,Sandhu[3]曾报道有Ⅰ型鸭病毒性肝炎病毒(DHV-1)的变异株,命名为DHV -1a。近年来,苏敬良[4]、范书才[5]、张大丙[6]、何冉娅[7-8]、林世堂[9]、M.C.Kim[10-11]、Tseng[12-13]等人相继报道了与 DHV -1 不同的新型DHV。新型鸭肝炎病毒的不断出现制约着养鸭业的发展,给养鸭业带来了严重的经济损失。
2010 年,作者从山东某养鸭场病料中分离出一株疑似鸭肝炎病毒,并对其特性进行了深入研究,以期为指导本地鸭病毒性肝炎的防治工作提供依据。
1 材料与方法
1.1 材料 DHV-1型肝组织毒LY株、DHV-1型鸭胚适应毒LY-20株、DHV-1型LY株蛋黄抗体:普莱柯生物工程股份有限公司提供;标准Ⅰ型DHV阳性血清:中国兽医药品监察所范书才老师惠赠;非免疫鸭蛋及雏鸭:均购自洛阳富民养禽有限公司。
1.2 病毒分离及传代
1.2.1 样品采集及处理 无菌采集病变典型的送检鸭肝脏,加入4倍体积的灭菌PBS,研细,冻融3次,加 5%的氯仿,振摇 20 min,离心取上清,0.22 μm滤膜过滤,参照《中华人民共和国兽药典》[14]经无菌、支原体及相关病原检测合格后分装,作为接种用样品,-70℃冻存。
1.2.2 鸭胚病毒分离及传代 将上述样品做100倍稀释后经尿囊腔接种10日龄易感鸭胚,0.1 mL/胚,置37℃观察168 h,收获48~120 h死亡的鸭胚液及肝脏,将收获的鸭胚液及肝脏研细,离心取上清,经无菌及支原体等检验合格后分装,作为鸭胚适应毒,-70℃冻存。
1.2.3 雏鸭病毒分离及传代 将上述样品做100倍稀释后,经腿部肌肉接种4日龄易感雏鸭,0.1 mL/只。观察168 h,无菌采集攻毒后20~72 h死亡且病变典型的雏鸭肝脏,按上述病料处理方法处理后置-70℃冻存。
1.3 病毒鉴定
1.3.1 病毒含量及毒力测定
1.3.1.1 用鸭胚测定 将鸭胚适应毒经10倍系列稀释,取适宜稀释度经尿囊腔接种10日龄易感鸭胚,每个稀释度接种5枚,0.1 mL/枚,37℃观察168 h,根据 24 h~168 h的死胚,按照 Reed-Muench法计算鸭胚半数致死剂量(ELD50)。
1.3.1.2 用雏鸭测定 将雏鸭肝组织毒经10倍系列稀释,取适宜稀释度经腿部肌肉注射4日龄易感雏鸭,每个稀释度接种5只,0.1 mL/只,观察10 d,根据雏鸭死亡情况,计算雏鸭半数致死剂量(LD50)。
1.3.2 本动物回归试验 选择4日龄易感雏鸭,将鸭胚适应毒 E2代(105.32ELD50/0.1 mL)经 100 倍稀释后,腿部肌肉注射试验组雏鸭,空白对照组注射 PBS,0.1 mL/只,隔离饲养观察 168 h,记录死亡及剖检情况。
1.3.3 理化特性鉴定 参照文献方法[15]进行部分理化特性研究。用鸭胚适应毒E8代病毒液进行红细胞(猪、鸡、鸭、兔、羊、小鼠)凝集试验、脂溶剂(乙醚和氯仿)敏感性、胰酶敏感性、耐酸性和耐热性试验。
1.3.4 中和试验
1.3.4.1 特异性血清中和试验 将鸭胚适应毒E8代和LY-20株E32代病毒液稀释至病毒含量为200 ELD50/0.1 mL,分别与等量标准Ⅰ型DHV阳性血清混合,37℃中和1 h,0.2 mL/枚,同时设病毒和空白对照,5枚/组,37℃培养168 h,记录各组死亡情况。
1.3.4.2 交叉中和试验 采用固定病毒稀释血清法[14]进行。将鸭胚适应毒E8代和LY-20株E32代病毒液稀释至病毒含量为200 ELD50/0.1 mL,取适宜稀释度抗体与等量稀释后病毒液混合,37℃中和1 h,0.2 mL/枚,分别设病毒和空白对照,5 枚/组,37℃培养168 h,记录各组死亡情况,以50%鸭(鸡)胚保护的最高抗体稀释度为抗体的中和效价。
1.3.5 雏鸭交叉保护试验 将4日龄雏鸭分为7组,10只/组,将分离株和LY-20株抗体稀释成含512个中和效价单位,按表1注射抗体,24 h后攻毒,同时设病毒和空白对照,隔离饲养观察168 h。记录各组死亡数,计算保护率。

表1 雏鸭交叉保护试验-抗体注射及攻毒详情
1.3.6 对不同日龄雏鸭的毒力测定 将分离株E2代肝组织毒稀释至病毒含量为100 LD50/0.1 mL,分别接种4日龄、8日龄、12日龄、16日龄、20日龄雏鸭,每个日龄段接种10只雏鸭,0.1 mL/只,隔离饲养观察168 h,记录各组死亡情况。
1.3.7 RT-PCR检测 根据 GenBank中已公布的韩国N-DHV全基因组序列,设计引物,韩国新型VP1引物序列为:上游引物5'-CAGATGGCCGCCAATGATCAG-3',下游引物 5'- GTCTCTGACATTTCGAAATTGGTATGA -3',由上海英骏生物技术有限公司合成。参照文献方法[16],将采集的病料、鸭胚适应毒、雏鸭传代肝组织毒等进行RT-PCR扩增,将扩增产物经琼脂糖凝胶电泳检测,参照GenBank公布的预计扩增片段大小为768 bp。
1.3.8 PCR产物的扩增与测序分析 将PCR产物送至上海英骏生物技术公司测序,应用 DNA Star5.07基因分析软件包对VP1基因测序结果进行分析整理,确定序列正确。将测序结果提交NCBI BLAST SERVER(Version2.0)与鸭肝炎病毒VP1基因序列进行在线比对,并构建系统进化树。
2 结果
2.1 鸭胚传代及病毒含量测定 结果见表2。在鸭胚上连续传至E8代,鸭胚传代死亡时间主要集中在90~120 h,剖检病变:胎儿全身水肿,肝脏肿大并有出血点,传至E6代后鸭胚死亡规律且毒价较稳定,表明该分离株能很好的适应10日龄鸭胚。

表2 鸭胚传代及病毒测定结果
2.2 雏鸭传代及病毒含量测定 该分离株用4日龄雏鸭进行传代,各代次的雏鸭死亡情况及毒价测定见表3。雏鸭于攻毒后20 h开始死亡,死亡高峰集中在20~72 h,死亡雏鸭呈典型的角弓反张状态,剖检病变:肝脏肿大,并伴随有点状或块状出血。
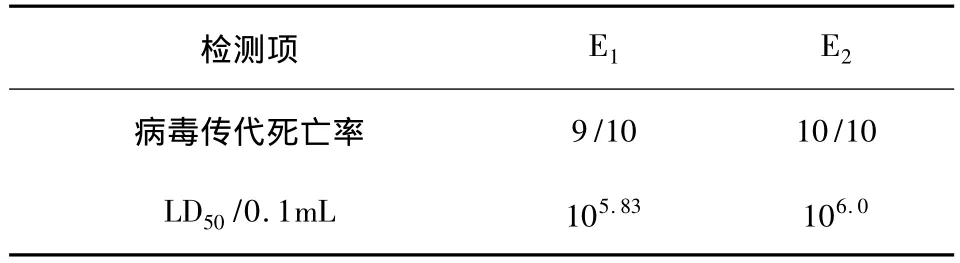
表3 雏鸭传代及病毒含量测定结果
2.3 本动物回归试验 试验组10只雏鸭72 h内全部死亡,死亡状态角弓反张(图1),剖检变化:肝脏肿大,并伴随有大量出血斑点(图2)。对照组10只雏鸭全部健活,剖检后雏鸭无任何病变。
2.4 理化特性鉴定 结果见表4。分离株经脂溶剂(氯仿和乙醚)、酸、热、胰酶处理后,毒价差异不到2个滴度,表明为无囊膜病毒,且对以上处理均不敏感。凝集试验显示该分离株不凝集任何红细胞,即无血凝性。

图1 角弓反张

图2 肝脏肿大、出血

表4 理化特性鉴定结果
2.5 特异性血清中和试验 结果见表5。死亡胚肝脏肿大,并伴有出血点等典型症状。结果表明分离株不能被标准Ⅰ型DHV阳性血清中和,LY-20株能被标准Ⅰ型DHV阳性血清中和,说明二者为不同血清型。

表5 特异性血清中和试验结果


表6 交叉中和试验抗体效价测定结果

表7 口蹄疫病毒亚型区分标准
2.7 雏鸭交叉保护试验 结果见表8,且死亡雏鸭经剖检呈典型鸭肝炎症状。可以看出,两个毒株之间无交叉保护作用,即分离株与DHV-1为不同血清型。
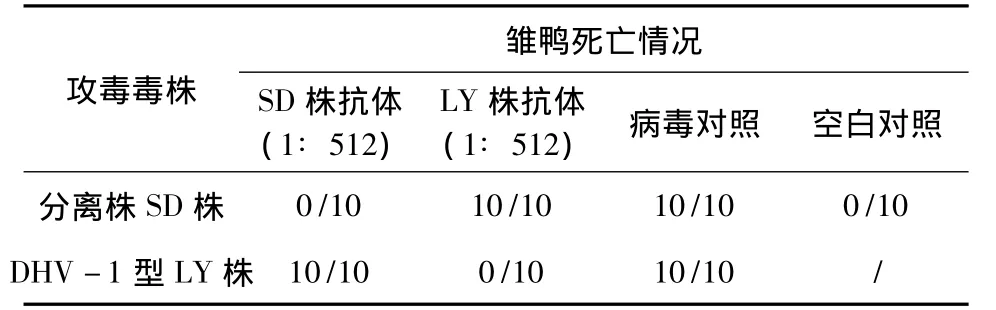
表8 雏鸭交叉保护试验结果
2.8 对不同日龄雏鸭的毒力测定 结果见表9,可见对12日龄内雏鸭致死率达100%。病死雏鸭经剖检有肝脏肿大,并伴有出血点。12日龄后随着日龄的增大,雏鸭的死亡率逐渐降低。

表9 对不同日龄雏鸭的毒力测定试验结果
2.9 RT-PCR检测 用韩国N-DHV引物对分离株进行RT-PCR扩增,产物经琼脂糖凝胶电泳后,可见与试验设计相符的768 bp电泳条带(图3),而DHV-1 LY-20株扩增结果为阴性。
2.10 PCR产物的扩增与测序分析 将测序结果与鸭肝炎病毒VP1基因序列进行比对,并构建进化树(图4),结果显示该分离株与韩国N-DHV VP1基因序列同源性在99%以上,该分离株与韩国N-DHV属同一基因型,且与台湾N-DHV相邻,但与DHV-1处于明显不同的分支。
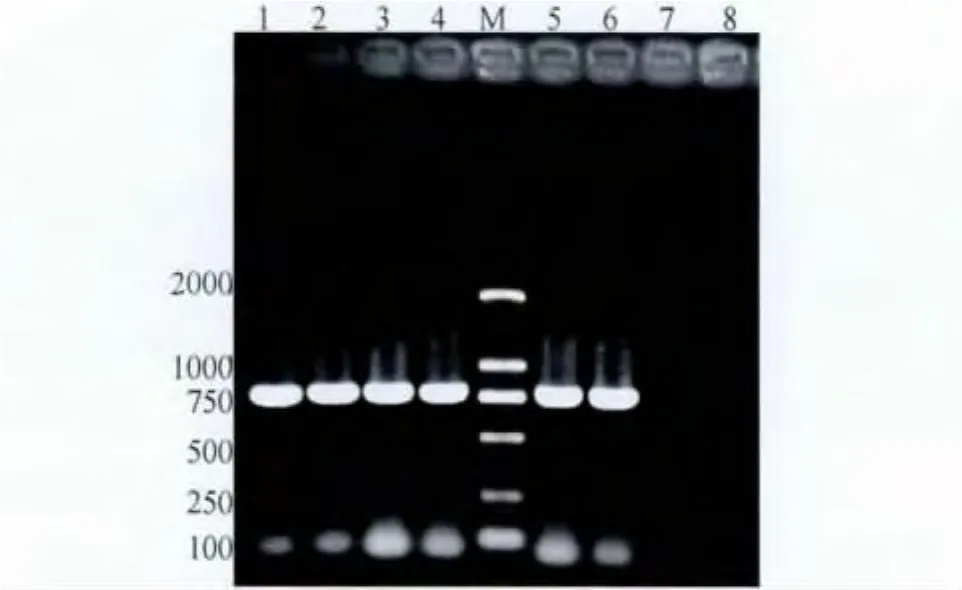
图3 RT-PCR结果
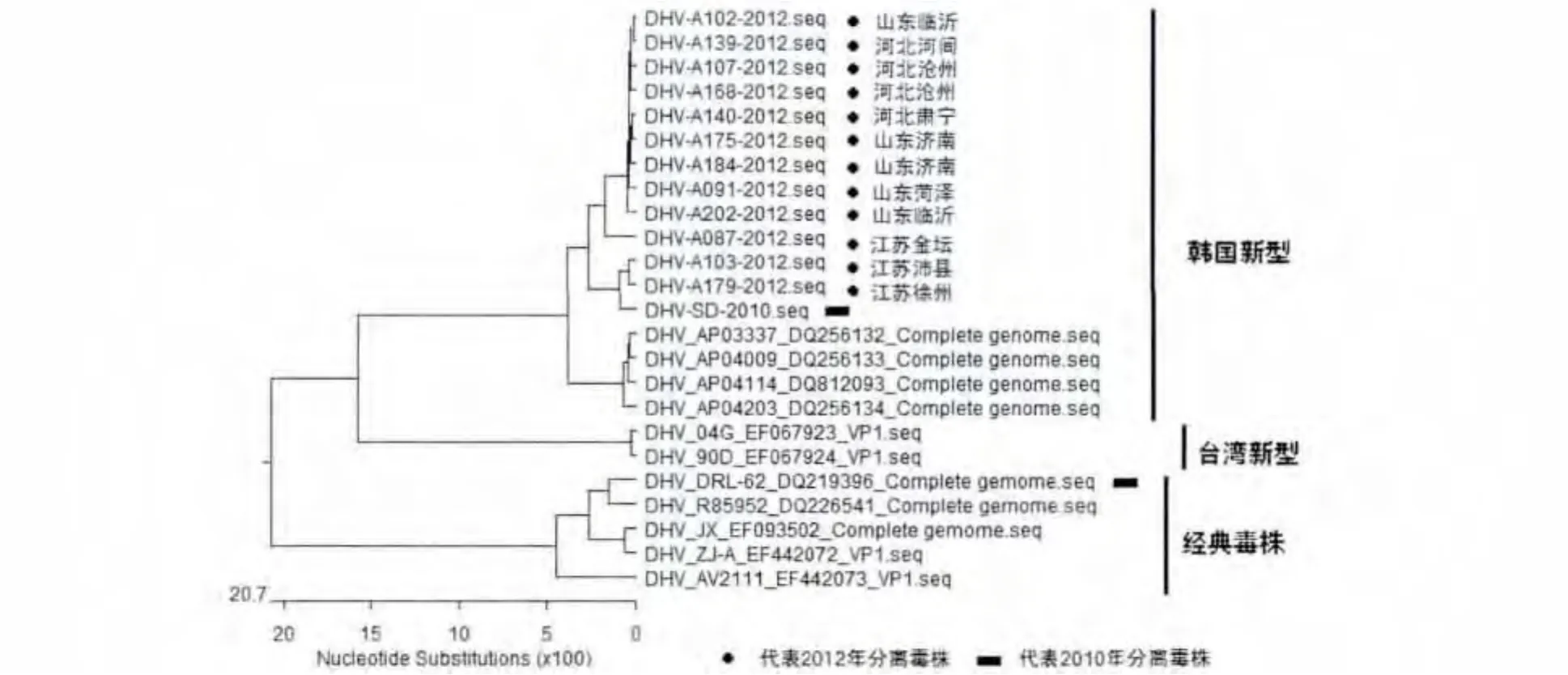
图4 分离株(DHV-SD-2010)测序结果核苷酸进化分析
3 讨论与结论
本试验使用10日龄易感鸭胚对分离株进行了传代培养,该分离株经本动物回归试验、理化特性试验、交叉中和试验、雏鸭交叉保护试验、对不同日龄雏鸭的毒力测定试验及RT-PCR检测等试验鉴定为新型鸭病毒性肝炎病毒,并命名为SD株。本试验成功分离到一株与DHV-1无血清学交叉免疫反应的新型DHV,并建立毒株之间的相关性,为我公司开展研制鸭肝二价精制蛋黄抗体及诊断试剂的研究工作奠定基础。
由于新型鸭病毒肝炎病毒的流行,仅用Ⅰ型鸭病毒性肝炎精制蛋黄抗体对雏鸭进行免疫达不到理想效果,给鸭肝炎病毒的防治带来困难。及时用鸭肝二价精制蛋黄抗体可作为预防鸭病毒性肝炎病毒流行的一种有效办法,但新型DHV抗体的中和效价与雏鸭保护率之间的关系有待进一步研究。同时,长期不断地收集DHV流行毒株,及时关注鸭肝炎病毒的流行传播特点,可为该病的科学防控提供试验依据。
[1]Saif Y M,Barnes H J,Glisson J R,et al.Diseases of Poultry[M].11th ed.Ames,IA:Iowa State Press,2003:343-354.
[2]马超英.新型鸭肝炎病毒的分离鉴定[J].中国畜牧兽医,2012,39(12):177-179.
[3]Sandhu T B,B W Calnek,L Zeman.Pathologic and serologic characterization of a variant of duck hepatitis type I virus[J].Avian diseases,1992,36:932 -936.
[4]苏敬良,黄 瑜,贺荣莲,等.新型鸭肝炎病毒的分离及初步鉴定[J].中国兽医科技,2002,32(1):15-16.
[5]范书才,李 虹,袁率珍,等.新型鸭肝炎病毒的分离鉴定[J].中国预防兽医学报,2009(10):770-775.
[6]Ding C,Zhang D B.Molecular analysis of duck hepatitis virus type 1[J].Virology,2007,361(1):9 -17.
[7]何冉娅,于 淼,张玉玲,等.2007-2009年华南地区鸭肝炎病毒流行病学调查及分离株的VP1基因变异分析[J].中国动物传染病学报,2010.18(1):7-15.
[8]何冉娅,罗玉均,张桂红,等.一株新型DHV的分离及初步鉴定[J].养禽与禽病防制,2008,8:14-16.
[9]林世棠,黄瑜,黄纪铨,等.一种新的鸭传染病研究Ⅰ.流行情况与初步诊断[J].中国畜禽传染病,1996,4:14-17.
[10]Kim M C,Kwon Y K,Joh S J,et al.Molecular analysis of duck hepatitis virus type 1 reveals a novel lineage close to the genus Parechovirus in the family Picornaviridae[J].Journal of general virology,2006,87(11):3307-3316.
[11]Kim M C,Kwon Y K,Joh S J,et al.Recent Korean isolates of duck hepatitis virus reveal the presence of a new geno-and serotype when compared to duck hepatitis virus type 1 type[J].Archives of Virology,2007,152(11):2059-2072.
[12]Tseng C H,Knowles N J,Tsai H J.Molecular analysis of duck hepatitis virus type 1 indicates that it should be assigned to a new genus[J].Virus Research,2007,123(2):190 -203.
[13]Tseng C H,Tsai H J.Molecular characterization of a new serotype of duck hepatitis virus[J].Virus Research,2007,126(1):19-31.
[14]中国兽药典委员会.中华人民共和国兽药典二○○五年版[S].
[15]殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.
[16]袁率珍.鸭肝炎病毒抗原性鉴定及相关基因分析[D].北京:中国兽医药品监察所,2010.
