吉兰-巴雷综合征中的传导阻滞与电生理分型变化
2014-11-23王雨晨冯国栋王静刘学东赵钢
王雨晨 冯国栋 王静 刘学东 赵钢
吉兰-巴雷综合征(Guillain-Barre syndrome,GBS)即急性炎性脱髓鞘性多发性神经根神经炎。该病为免疫介导的自身免疫性疾病,具有急性起病,多有前驱事件及病程多呈单时相自限性等特点。典型表现为快速进展的对称性瘫痪、腱反射消失及脑脊液蛋白-细胞分离等。GBS主要根据临床表现及电生理特征分为急性炎症脱髓鞘性多发神经病(acute inflammatory demyelinating poly—neuropathy,AIDP)和急性运动轴索型神经病(acute motor axonal neuropathy,AMAN)两种主要类型,Miller-Fisher综合征(MFS)及其他亚型临床上较为少见[1]。神经电生理检查作为GBS诊断中不可替代的一项辅助检查,在该病的诊断及分型中起着极为重要的作用。本研究对2008年8月至2013年2月期间收治的132例GBS患者的临床资料进行回顾性分析,研究GBS患者病程中电生理分型的变化情况,及其与早期发生CB现象的关系。
1 对象与方法
1.1 研究对象本研究回顾性研究了2008年8月~2013年2月于我科住院治疗的GBS患者132例,所有患者均于发病2周后进行神经电生理检查,并于10~14天后复查。其中男性88例(66.7%),女性44例(33.3%);年龄4~82岁,平均(40.4±18.3)岁,所有患者均符合吉兰-巴雷综合症诊治标准[1]。入组标准:①急性或亚急性起病,呈进行性加重;②常有前驱感染;③肢体呈对称性无力,可伴有感觉障碍;④腱反射常减弱甚至消失;⑤可伴有颅神经损害⑥脑脊液常出现蛋白-细胞分离现象;⑦神经电生理检查提示运动和/或感觉神经受累;⑧病程常有自限性。排除标准:①诊断为Miller-Fisher综合征的患者;②未按时进行电生理检查或复查者。
1.2 神经电生理检查方法 采用丹麦丹迪公司Keypoint型肌电图仪。由于超早期电生理检查结果多为F波的异常,神经传导多仅为复合肌肉动作电位(compound motor active potentials,CMAP)波幅的降低,所有患者均于发病2周后进行第1次神经电生理检查,并于首次检查后10~14 d进行复查:①全部患者行神经传导检测,刺激和记录采用表面电极,运动神经传导测定双侧正中、尺、腓、胫神经,记录运动神经传导速度(motor conduction ve⁃locity,MCV)、远端潜伏期、波幅等,观察是否有CB;感觉神经传导测定正中、尺、腓肠、腓浅神经,记录感觉神经传导速度(sensory conduction veloci⁃ty,SCV);②进行正中、尺、腓、胫神经F波检测,记录出波率、潜伏期等;③行针极肌电图检查,使用同心圆电极针,测定大小鱼际肌、三角肌、股四头肌、胫前肌、腓肠肌等,观察静息时有无自发电位、轻收缩时运动单位电位、大力收缩时运动单位电位募集相及电压[2]。
1.3 诊断标准与评价标准 ①GBS及运动传导阻滞的诊断标准根据中华医学会神经病学分会2010年GBS诊治指南;②AIDP及AMAN的分型根据Hadden等的标准进行诊断[3];③病情程度根据Hughes等制定的评分量表进行打分[4]:0级:肢体运动正常;1级:轻微的症状和体征,可以跑动:2级:能独立行走5 m;3级:借助拐杖或助行器支撑能行走5 m;4级:只能在床上或座椅上活动;5级:需要辅助通气治疗;6级:死亡。
1.4 统计学方法 全部数据经SPSS17.0统计软件进行处理。对各组间的比较用χ2方检验,检验水准α=0.05。
2 结果
2.1 临床资料 前驱事件发病前1~4周内有呼吸道感染史或发热病史60例(45.5%),消化道感染29例(22.0%),其他因素6例(4.5%),余无明显诱因;首发症状肢体无力122例(92.4%),感觉障碍54例(40.9%),颅神经症状23例(17.4%);临床表现有颅神经症状31例(23.5%),其中面神经麻痹13例,眼肌瘫痪4例,复视4例,饮水呛咳29例;临床表现有感觉障碍54例(41.0%),上肢无力117例(88.6%),下肢无力125例(94.7%);腱反射减低81例(61.4%),消失35例(26.5%),亢进7例(5.3%);入院后行腰穿121例,有蛋白-细胞分离现象94例(78.5%);出现肺部感染 31例(23.5%),泌尿系统感染10例(7.6%)。
2.2 电生理检查结果及分型 所有患者发病2周后首次电生理检查分型结果:AIDP组58例(44%),AMAN组24例(18%),不明确分型组50例(38%)。10~14 d后复查再次分型结果:AIDP组42例(31%),AMAN组53例(41%),不明确分型组37例(28%)(图1)。
2.3 电生理分型变化病例中的传导阻滞 复查结果显示AIDP组转为AMAN有20例(34.5%),其中17例(85.0%)发病早期伴CB;AMAN组仍为AMAN有15例(62.5%),其中5例(33.3%)在发病早期伴随CB;不明确分型组转为AMAN有18例(36.0%),其中7例(38.9%)发病早期伴CB(图2)。
2.4 早期发生传导阻滞与分型转变为AMAN及病情严重程度的关系 AIDP组共36例发生CB,再分型为AMAN与其他亚型之比为17:19;AMAN组共6例发生CB,再分型为AMAN与其它亚型之比为5:1;不明确分型组共10例发生CB,再分型为AMAN与其它亚型之比为7:3(表1)。
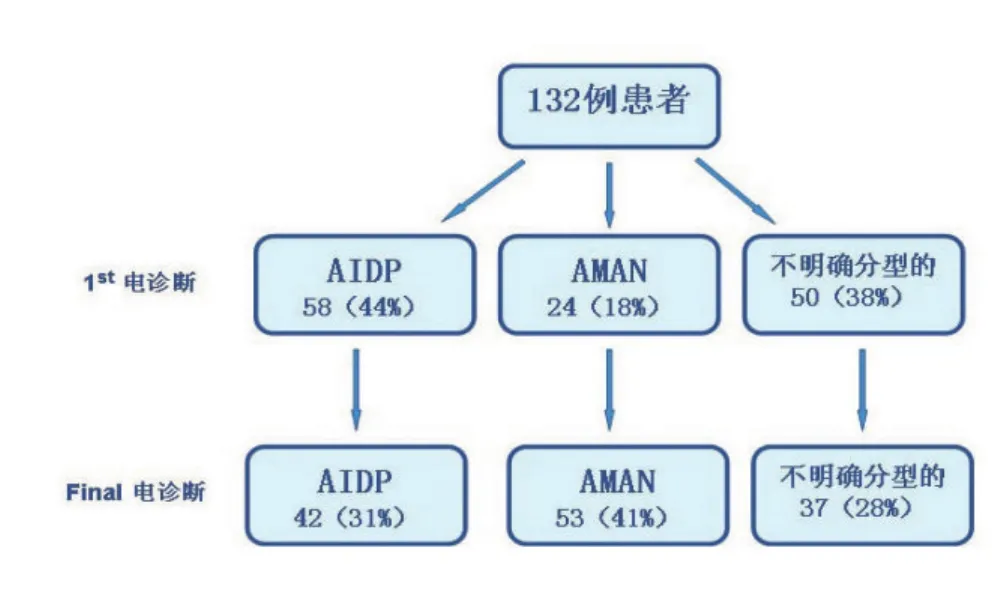
图1 132例GBS患者的电生理分型变化第1次电生理分型。AIDP组58例(44%);AMAN组24例(18%);不明确分型组50例(38%)。第2次电生理分型:AIDP组42例(31%);AMAN组53例(41%);不明确分型组37例(28%)
3 讨论
本组研究对象男性发病多于女性,前驱事件以呼吸道感染和肠道感染为主,符合该病多有非特异性感染史的特点,有特异性感染相关GBS的报道,本组研究未见[5]。本组研究对象临床表现符合GBS患者对称性肢体肌力减弱常伴四肢末端麻木感,可有腱反射减弱或消失等临床特点。GBS以AIDP和AMAN最为常见,有文献报道欧美地区AIDP多见[6],而中国GBS患者以AMAN为主65%[7]。本组对象132例GBS患者电生理分型以AIDP型为主,与近年国内报道一致[8]。
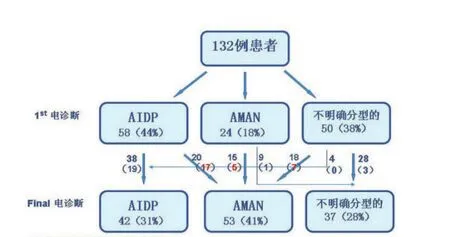
图2 132例GBS患者电生理分型变化和传导阻滞箭头旁括号中为发生CB的例数,红色数字表示分型为AMAN伴CB的例数
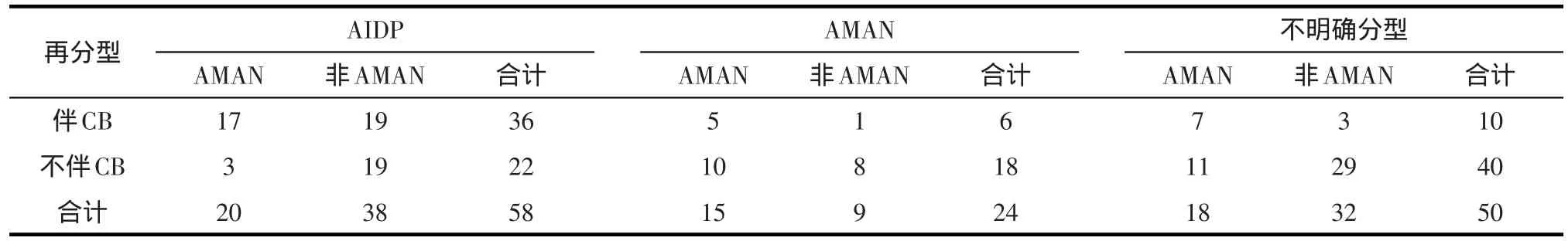
表1 各分型组复查电生理后再次分型与早期发生CB的关系
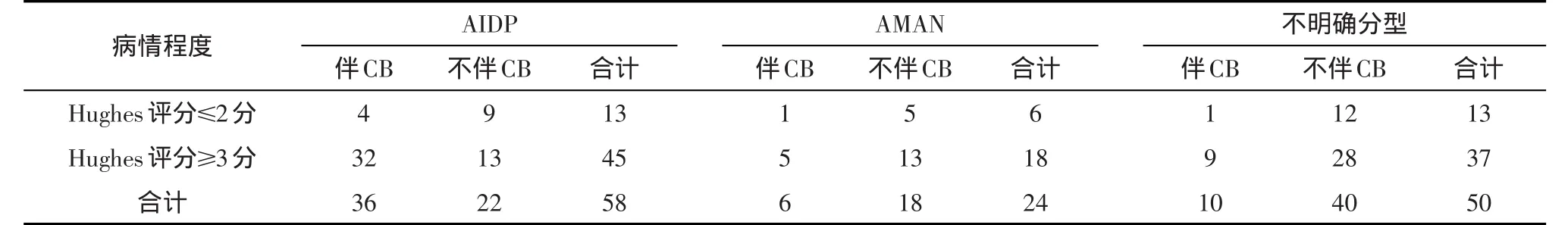
表2 各分型组病情程度与早期发生CB的关系
有文献报道,一部分GBS患者发病早期的电生理分型可能会随病情进展而改变,在病程不同时期复查电生理,AIDP和AMAN所占比例较发病早期发生变化[9]。本研究将病例分为AIDP组和AMAN组,以及电生理结果不符合这两型诊断标准和电生理无明显异常的病例归入不明确分型病例组,发现部分患者电生理结果确实随病情进展发生了变化,相应电生理分型也随之改变。研究结果显示复查电生理时AMAN患者的比例与首次检查结果有明显增加,AIDP型由44%减少至31%,而AMAN型由18%增加至41%,与文献报道一致[9-10]。早前有研究显示AMAN较AIDP预后差[11],这意味着更多的患者可能预后不良。若只按照首次电生理检查结果分型,可能会使部分患者诊断和预后判断不够准确,必要的电生理复查可及时判断患者病情变化,在一定程度上预测患者病情转归,进而调整相应治疗方案。
此外,发生在疾病早期的CB值得注意。本组研究显示CB不仅发生在AIDP患者中,AMAN组和不明确分型组都有患者病程早期伴随CB现象,有学者研究认为CB在轴索损害为主的AMAN同样发挥重要作用[12],AMAN的CB可能是由于原发轴索变性后GM-1抗体介导的炎性细胞与轴索桥梁式结合,释放炎症介质和局部酸中毒以及轴索膜钠离子通道损害,加上正常轴索髓鞘紧密连接的破坏,导致安全因子进一步下降,最终形成CB[13]。此次研究显示AIDP组和不明确分型组都有超过1/3的病例转变为AMAN,且通过各亚型组内前后病程不同阶段的电生理检查结果比较和分析,在AIDP组和不明确分型组CB的发生和再次分型转变为AMAN型有相关性。CB是指神经冲动沿完好的神经纤维传导时受到阻碍,是评价周围神经功能状态的重要电生理学参数之一。传统观念认为CB主要是由神经纤维脱髓鞘引起,是脱髓鞘所致的生理结果之一,也是脱髓鞘神经病中诸多异常临床表现的生理基础[14]。但近年有研究表明,脱髓鞘并不是CB发生的唯一原因,而是脱髓鞘及郎飞结附近轴索膜的去极化、超极化以及钠离子通道损伤等多方面原因相互作用的结果[15]。
近郎飞结处的轴索膜受到损伤因子攻击后可能发生CB,电生理表现为波幅下降、波形离散的传导阻滞样改变,如进一步发展则由可逆的CB转变为不可逆CB,进而成为轴索变性。据Norito Kokubun等报道[10],他们观察到的AMAN患者出现CB后,这两种转归的比例接近1:1。本组研究显示AIDP组早期CB与病情加重有关,可能与CB的发生与转归结果有关,但绝大部分病例在复查电生理检查后未能再进行复查,故未观察到CB的最终转归,这也是我们在今后的研究中应当注意的问题。
综上所述,不可逆性的CB可能导致GBS患者电生理分型的改变;CB不仅是AIDP的典型电生理表现,在其它亚型的GBS患者病程早期发生同样具有重要意义。由此可见,GBS患者病程进展过程中的电生理检查结果及分型是一个动态变化的过程,及时进行必要的电生理复查对及时准确的判断分型和病情发展都有积极的意义。
[1]Asbury AK,Cornblath DR.Assessment of current diagnostic cri⁃teria for Guillain-Barré syndrome[J].Ann Neurol,1990,27(Suppl):s21-s24.
[2]管宇宙.同心圆针肌电图[M]刘明生.神经传导速度测定[M]∥崔丽英.简明肌电图学手册.北京:科学出版社,2008:39,58-59,73,83,107-115,126-134.
[3]Antonino U,Satoshi K.Electrodiagnostic criteria for Guillain–Barrè syndrome:A critical revision and the need for an update[J].Clin Neurophysiol,2012,123:1487-1495.
[4]Hughes RA,Newsom-Davis JM,Perkin GD,et al.Controlled trial prednisolone in acute polyneuropathy[J].Lancet,1978,2(8093):750-753.
[5]朱真真,张玉生,郭黎.梅毒相关性吉兰—巴雷综合征1例报告 [J].中国神经精神疾病杂志,2013,39(11):683-684.
[6]Nobuhiro Y,Guillain–Barré Syndrome[J].N Engl J Med,june 14,2012
[7]Ho TW,Mishu B,Li CY,et al.Guillain-Barré syndrome in northern China:relationship to Campylobacter jejuni infection and anti-glycolipid antibodies[J].Brain,1995,118:597-605.
[8]侯世芳,秦绍森,刘银红,等.脱髓鞘型与轴索型吉兰一巴雷综合征的临床对比研究[J].中国神经精神疾病杂志,2009,35(5):273-275.
[9]Uncini A,Manzoli C,Notturno F,et al.Pitfalls in electrodiagno⁃sis of Guillain-Barré syndrome subtypes[J].J Neurol Neurosurg Psychiatry,2010,81:1157-1163.
[10]Kokubun N,Nishibayashi M,Uncini A,et al.Conduction block in acute motor axonal neuropathy[J].Brain,2010,133:2897-2908.
[11]Hirage A,Mori M,Ogawara K,et al.Differences in patterns of progression in demyelinating and axonal Guillain-Barré syn⁃drome[J].Muscle Nerve,2003,28(6):683-689.
[12]Kokubun N,Shahrizaila N,Hirata K,et al.Conduction block and axonal degeneration co-occurring in a patient with axonal Guillain-Barré syndrome[J].J Neurol Sci,2012,319:164-167.
[13]汪仁斌,刘兴洲.神经传导阻滞及其发生机制[J].脑与神经疾病杂志,2006,14:239.
[14]刘涛,卢祖能.脱髓鞘神经病中传导阻滞的生理基础[J].卒中与神经疾病,2006,2(13):59.
[15]汤晓芙.对传导阻滞的新认识[J].中华神经科杂志,2003,12(36):404.
