脉搏量变异监测在老年粗隆间骨折患者手术中的应用
2014-11-21高明龙李红芳刘永哲郭文治马亚群
高明龙,李红芳,刘永哲,郭文治,马亚群
(1北京军区总医院麻醉科,北京 100700;2首都医科大学附属地坛医院妇产科)
容量治疗是临床麻醉管理的重要组成部分,术中液体补充得当,不仅可以维持良好的组织灌注、血流动力学的平稳,而且可以减少术后并发症的发生[1]。对患者病理生理的了解是进行液体治疗的前提,而对容量的有效监测是进行液体治疗的基础。目前临床麻醉中主要是通过患者的禁食水时间、术中出血量、尿量及血压心率的变化情况来综合评估容量状态,但依靠这些又过于粗略。传统的中心静脉压(central venous pressure,CVP)和肺毛细血管压(pulmonary capillary wedge press,PCWP)能够比较好地反映前负荷的变化,但二者在穿刺、置管、使用过程中有创伤大、易出现心律失常、栓塞、感染等严重并发症,所以在临床使用过程中有所顾虑[2,3]。
脉搏量变异(stroke volume variation,SVV)是指在一个呼吸周期中左心室每搏量的变异度,它反映的是胸腔内压力变化引起的回心血量的改变,进而导致每搏量的变化。本研究目的探讨脉搏量变异在老年粗隆间骨折患者手术中容量治疗的应用价值。
1 资料和方法
1.1 研究对象
本研究经北京军区总医院伦理委员会批准,观察本院2012-02~2013-09在全麻下行粗隆间骨折内固定术、年龄65岁以上的老年患者60例,ASAⅡ-Ⅲ级,左侧25例,右侧35例。所有患者均签署知情同意书。60例患者按照就诊前后顺序随机分为ART组(在术中只进行有创动脉压的监测)、CVP组(术中进行有创动脉压和中心静脉压的监测)和SVV组(术中进行有创动脉压和SVV监测),每组20例。
病例排除标准:有严重心律失常(心房纤颤和频发性室性早搏)的患者,中、重度主动脉瓣关闭不全并返流的患者,肺功能严重通气功能障碍的患者,肺叶部分切除或单侧全肺切除术后的患者,双侧桡动脉Allen试验阳性的患者,各种原因的休克患者,术中出血大于1 000 ml,血压需持续使用血管活性药物维持者。
1.2 麻醉和方法
所有患者术前禁食水6 h,入手术室后建立静脉通路,应用Drager监护仪监测心电图、心率(HR)、脉搏氧饱和度(SpO2)、无创动脉血压(NIBP),应用A-2000XP BIS监护仪(美国ASPECT公司)监测BIS,同时面罩吸氧。所有患者在局部麻醉下进行桡动脉穿刺,置管成功后连接压力换能器(Edawards Lifescienses公司,美国)监测有创动脉血压,SVV组同时监测SVV和心脏指数(cardiac index,CI),CVP组在麻醉成功后经右侧锁骨下或右侧颈内静脉入路置入中心静脉导管,连接压力换能器监测CVP。
静脉注射咪达唑仑0.05 mg/kg、芬太尼2-3 μg/kg、依托咪酯0.3 mg/kg、万可松 0.05-0.1 mg/kg进行麻醉诱导,气管插管成功后接麻醉机行控制呼吸,设置潮气量10 ml/kg,呼吸频率10-12次/min,维持PetCO2在30-40 mmHg。术中持续泵注丙泊酚2-6 mg/(kg·h)和瑞芬太尼8-15μg/(kg·h),BIS值维持在50±5。
常规补液方案[4],输入液体总量=补偿性扩容量+生理需要量+术前缺失量+出血量+第三间隙丢失量,补偿性扩容量采用 6%羟乙基淀粉溶液(130/0.4)以2 ml/kg计算,出血量以2-3倍的液体补充,液体按晶/胶3∶1输入,失血量超过600 ml或者Hb低于70 g/L的,输注浓缩红细胞2-3 U,生理需要量与累计缺失量根据4-2-1法则以平衡液补充。诱导前补充术前缺失量的1/4和生理需要量,余量于插管后至术毕补充。
ART组根据血压变化趋势随时调节输液速度,血压低于基础值的10%时,加快输液速度,而血压高于10%时,减慢输液速度;CVP组维持CVP在8-10 mmHg,低于8 mmHg时,加快输液速度,高于10 mmHg,减慢输液速度;SVV组通过监测SVV和CI指导输液,维持 SVV在10%-12%,如果 SVV>12%,5 min内静脉输注6%羟乙基淀粉3 ml/kg后观察指标变化:如果SVV<10%,观察CI变化:①CI<2.5 L/(min·m2)时,分次静脉注射多巴胺5μg/kg直至 CI>2.5 L/(min·m2),本病例退出观察;②CI>2.5 L/(min·m2),则不予处理。
记录指标:患者的年龄、性别、体重、手术时间等一般资料,以及术中失血量,术前、术后(患者清醒,拔除喉罩时)患者的血液Hct、Hb、乳酸值,术中液体输入量、尿量和麻黄碱的总用量,桡动脉和深静脉置管成功的穿刺次数和穿刺部位发生血肿的例数。
1.3 统计学分析
2 结果
2.1 基本资料
三组患者的一般资料差异无统计学意义(P>0.05,见表1)。
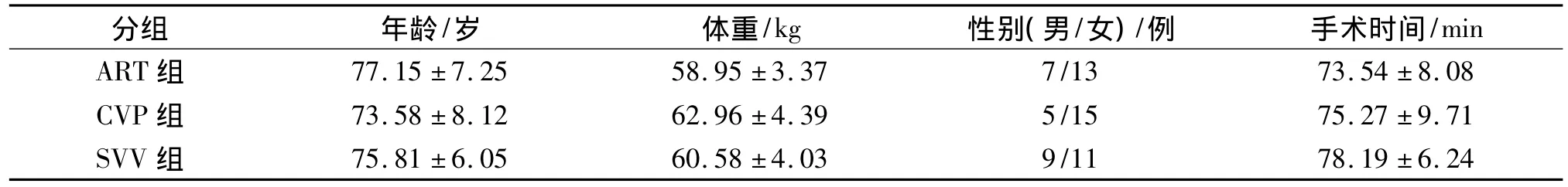
表1 三组患者一般情况比较 (n=20)Table 1 Comparison of general clinical data among three groups (n=20)
2.2 三组患者术中出血量、液体入量、尿量、麻黄素用量比较
三组间患者的出血量比较,差异无统计学意义(P>0.05,见表2)。与 ART组比较,SVV 组、CVP组的液体入量和尿量都较多,差异有统计学意义(P<0.01,见表2),增幅分别为 18%-24%、11%-14%;SVV组和CVP组术中麻黄素使用剂量显著少于ART组,差异有统计学意义(P<0.01,见表2)。SVV组的和CVP组液体入量和尿量略多与ART组,麻黄素使用剂量也较少,但差异无统计学意义(P>0.05,见表2)。
2.3 三组患者Hb、Hct和乳酸值比较
与术前比较,术后三组患者Hb、Hct均显著下降(P<0.01),乳酸值显著上升(P<0.01)。与ART组比较,SVV组和CVP组Hb、Hct下降显著,差异有统计学意义(P<0.01,见表3)。

表2 三组患者术中出血量、液体入量、尿量、麻黄素用量比较Table 2 Comparison of bleeding volume,fluid intake,urine output and ephedrine consumption among three groups
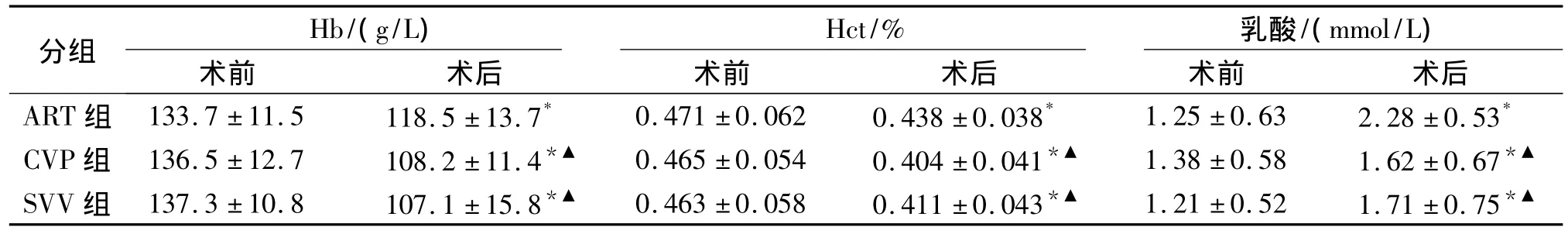
表3 三组患者血清指标比较 (n=20)Table 3 Comparison of Hb,Hct and lactate among three groups(n=20)
2.4 三组穿刺过程及结果
在桡动脉穿刺过程中,第一次穿刺成功57例,第二次穿刺成功3例(三组各1例),三组之间无显著差异。在中心静脉压置管过程中,右侧锁骨下穿刺入路16例,右侧颈内静脉入路4例,第一次穿刺成功16例,第二次穿刺成功3例,其中1例为右侧锁骨下穿刺置管失败后改为右侧颈内静脉穿刺置管,造成右侧锁骨下局部血肿。CVP组的操作次数远远多于ART组和SVV组。
3 讨论
股骨粗隆间骨折是老年人的常见骨折类型,占髋部骨折的21%-42%[5]。在病人条件允许的情况下,多选择神经阻滞麻醉或椎管内麻醉,但在病人服用抗凝药或不能配合的情况下,也只能选择全身麻醉。全身麻醉无疑对老年患者血流动力学的稳定有较大的影响,肺部感染、肺不张、支气管痉挛和呼吸衰竭的发生率显著增高[6]。中心静脉压是指通过中心静脉导管测量上腔静脉内的压力值,接近右心房的压力,能够直观反应心脏前负荷的变化情况,是较为常用的血流动力学监测指标。本研究中,在中心静脉压置管过程中,第一次穿刺成功16例,第二次穿刺成功3例,其中1例为右侧锁骨下穿刺置管失败后改为右侧颈内静脉穿刺置管,造成右侧锁骨下局部血肿。在中心静脉导管的置入、留置过程中可能发生的一系列并发症,限制了中心静脉压监测的应用。而SVV和中心静脉压相比,无疑损伤和风险都较小[2,3]。
SVV是一种新的血流动力学监测指标,所反映的是某一时间内左室每搏量的变异程度,在预测容量治疗反应方面的敏感性更高[7,8],它反映的是胸腔内压力变化引起的回心血量的改变,进而导致左室每搏量的变化,其机制是在正压机械通气时,胸腔内压力的变化导致每搏量在吸气时升高,呼气时每搏量下降,而在血容量不足时,在呼气时相对于吸气时的下降幅度增大,导致外周动脉压力波形出现改变,FloTrac/Vigileo分析系统根据外周动脉压力波形的变化计算出CI、SVV。
机械通气中潮气量大小、胸壁顺应性大小等因素都可能对SVV造成影响[9],严重的心律失常致使动脉波形变异较大,SVV的可信度减低。也有报道[10],在多发室性早搏的动物模型实验中,SVV能够预测容量反应性。本研究病例中,患者年龄较大,约70%的患者有不同程度的肺通气功能障碍,SVV组和CVP组的液体入量比对照组多18%-24%、尿量多11%-14%,乳酸值也保持在一个相对较低的水平,术中为维持血压平稳而使用的麻黄碱也相对较少。SVV组和CVP组都没有肺水肿、心衰等出现容量过多的并发症。
本研究结果提示,SVV监测在老年病人粗隆间骨折手术过程中,能够及时准确地预测容量反应性,有效地指导液体治疗,改善微循环,避免容量过多或容量不足等并发症的发生。
[1]Siemionow K,Cywinski J,Kusza K,etal.Intraoperative fluid therapy and pulmonary complications[J].Orthopedics,2012,35(2):184-191.
[2]Bacchi G,Buscaroli A,Fusari M,etal.The influence of intraoperative central venous pressure on delayed graft function in renal transplantation:a single-center experience[J].Transplant Proc,2010,42(9):3387-3391.
[3]Sivashanmugham T,Jahirdar SM,Parthasarathy S,etal.Predicting intraoperative cardiovascular complication in patients with anterior mediastinal mass-role of central venous pressure monitoring[J].J Anaesth,2013,57(4):406-408.
[4]庄心良,曾因明,陈伯奎.现在麻醉学[M].3版.北京:人民卫生出版社,2003:312-317.
[5]Woratanarat P,Kijkunastian C,Wajanavisit W,etal.A comparative study of risk factors of femoral neck and intertrochanteric fracture in Thai men [J].J Med Assoc Thai,2009,92(6):165-171.
[6]Canet J,Gallart L,Gomar C,etal.Prediction of postoperative pulmonary complications in a population-based surgical cohort[J].Anesthesiology,2010,113(6):1338-1350.
[7]Benes J,Chytra I,Altmann P,etal.Intraoperative fluid optimization using stroke volume variation in high risk surgical patients:results of prospective randomized study[J].Crit Care,2010,14(3):R118.
[8]Cavallaro F,Sandroni C,Antonelli M.Functional hemodynamic monitoring and dynamic indices of fluid responsiveness[J].Minerva Anestesiol,2008,74:123-135.
[9]Reuter DA,Bayerlein J,Goepfert MS,etal.Influence of tidal volume on left ventricular stroke volume variation measured by pulse contour analysis in mechanically ventilated patients[J].Intensive Care Med,2003,29:476-480.
[10]Maxime C,Nam PT,Max C,etal.Predicting fluid responsiveness with stroke volume variation despite multiple extrasystoles[J].Crit Care Med,2012,40(1),193-198.
