氟对大鼠肝组织中caspase-3和caspase-9基因表达的影响
2014-11-21刘茂林樊林花卫兵艳
刘茂林,樊林花,卫兵艳
(山西医科大学实验动物中心,太原 030001)
氟广泛存在于地球上,是机体必需的微量元素之一,适量的氟有利于维持机体钙磷代谢和保持神经兴奋的传导。但过多摄入可导致肝肾等多种组织器官的广泛损伤[1,2]。前期实验表明,过量氟化物导致大鼠肝细胞 DNA损伤,并可诱导细胞凋亡[3],本研究观察氟化物对 肝 组织 caspase-3、caspase-9基因表达水平,明确氟化物导致大鼠肝细胞DNA损伤并诱导细胞凋亡是否与caspase-3、caspase-9基因表达水平有关,进一步了解氟化物对肝组织损伤机制。
1 材料与方法
1.1 主要试剂和仪器
RNAiso Plus总RNA提取试剂(TaKaRa公司)、5×PrimeScript®RT Master Mix试剂盒(大连宝生物工程有限公司)、反转录SYBRPremix®Ex TaqTMII试剂盒9(大连宝生物工程有限公司)、DNA Marker(大连宝生物工程有限公司)、琼脂粉(西班牙)、高速冷冻离心机3-18K(美国 Sigma公司)、PTC-200PCR仪(美国Bio-Rad公司)、ABI 7300全自动荧光定量PCR(美国ABI公司)、可调微量移液器(德国eppendorf公司)。
1.2 动物分组、肝系数测定及标本的采集
清洁级雄性SD大鼠48只,体重(100±10)g,由山西医科大学实验动物中心提供,合格证号:SCXK(晋)2009-0001。将SD大鼠观察1周适应环境后,随机分为4组,每组12只,各组均饲喂大鼠正常饲料,对照组、低氟组、中氟组和高氟组分别自由饮用含0,50,100,200mg/L氟化钠去离子水。动物饲养于山西医科大学实验动物中心屏障环境[SYXK(晋)2009-0001],每月测定实验动物体重,观察体重变化,染毒120 d。染毒结束,称量最后一次体重,麻醉后经右心灌注生理盐水,冲洗肝内血液,快速对大鼠的肝组织进行取材,用滤纸吸干表面血液,称重,测定肝系数[肝系数=肝质量(g)/体质量(g)×100%]。将肝组织迅速放入液氮中速冻,然后转移至-80℃冰箱保存,以备实时荧光定量PCR检测。
1.3 肝组织中 caspase-3、caspase-9基因表达的实时荧光定量PCR检测
称取低温冻结的肝组织100 mg加液氮研磨成粉末状,按 RNAiso Plus试剂说明操作,提取总RNA,通过1.0%琼脂糖凝胶电泳进行肝组织总RNA质量鉴定,核酸分析仪测量其浓度,用反转录试剂盒将其反转录为cDNA。以β-actin作为内参照,caspase-3上游引物:5’-AGCCATGTACGTAGCCATCC-3’,下游引物:5’-GGCGCAAAGTGACTGGATGA-3’,产物长度147 bp;caspase-9上游引物:5’-CTGAGCCAGATGCTGTCCCATA-3’,下游引物:5’-GACACCATCCAAGGTCTCGATGTA-3’,产物长度176 bp;β-actin上游引物:5’-AGCCATGTACGTAGCCATCC-3’,下游引物:5’-ACCCTCATAGATGGGCACAG-3’,产物长度115 bp。然后进行扩增:95 ℃ 30 s;然后95 ℃ 5 s,60 ℃ 30 s,40个循环,添加溶解曲线,反应结束后,电脑自动输出溶解曲线及对应Q值(达到阈值循环数)和扩增曲线。取6μl PCR产物经2%琼脂糖进行凝胶电泳,采用凝胶成像系统观察,以进行PCR产物鉴定。
1.4 实验数据处理及分析
相对表达量比较采用2-ΔΔCt法分析,表示实验组目的基因的表达相对于对照组的变化倍数。ΔCt(染氟组)=Ct(目的基因)-Ct(内参基因);ΔCt(对照组)=Ct(目的基因)-Ct(内参基因);ΔΔCt=ΔCt(染氟组)-ΔCt(对照组)。目的基因的相对表达水平=2-ΔΔCt。
样品的阈值线设置相同,采用SPSS13.0统计软件计算重复样品间Ct均值及标准偏差,应用2-ΔΔCt法处理数据。
1.5 统计学分析
实验数据采用SPSS 16.0统计软件进行分析,组间比较采用单因素方差分析及LSD-t法检验。
2 结果
2.1 不同染氟时期大鼠的体重变化
从表1可知,染氟过程中各组大鼠生长发育良好,体重均明显增加。经统计分析,不同时期各染氟组体重与相应的对照组相比,差异无统计学意义,各染氟组之间体重两两比较差异也无统计学意义。
2.2 氟对各组大鼠肝脏脏器系数的影响
从表2可知,染氟组大鼠肝脏脏器系数与对照组相比,差异无统计学意义;各染氟组间比较差异也无统计学意义。
表1 不同染氟时期大鼠的体重变化(±s,g)Table 1 Changes of body weight of rats exposure to different concentrations of fluoride for different time(±s,g)
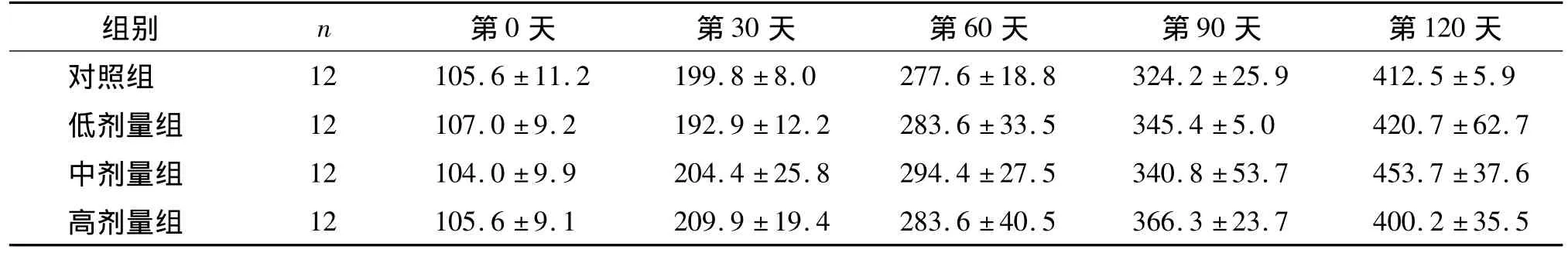
表1 不同染氟时期大鼠的体重变化(±s,g)Table 1 Changes of body weight of rats exposure to different concentrations of fluoride for different time(±s,g)
各染氟组与对照组比较,P>0.05
中剂量组 12 104.0±9.9 204.4±25.8 294.4±27.5 340.8±53.7 453.7±37.6高剂量组 12 105.6±9.1 209.9±19.4 283.6±40.5 366.3±23.7 400.2±35.5
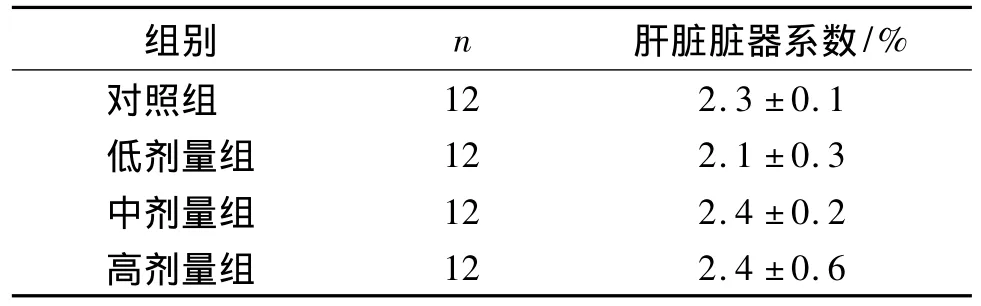
表2 各组染氟120 d大鼠肝脏脏器系数Table 2 Comparison of liver coefficient after exposure to different concentrations of fluoride for 120 d
2.3 肝脏组织总RNA的浓度和纯度
大鼠肝脏RNA经提取纯化后,在1.0%琼脂糖凝胶电泳进行快速分析(15 V/cm),从图可以看出,总RNA有明显三条带(5S,18S和28S),表明总RNA的完整性较好,基本无降解。SD大鼠肝组织总 RNA,吸光度 A260/A280均在 1.8-2.0 之间,表明总RNA的纯度达到了实验要求(见图1)。
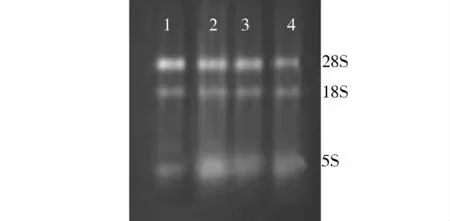
图1 总RNA电泳图Figure 1 Total RNA electrophoresis of rat liver tissues after exposure to different concentrations of fluoride
2.4 样品扩增动力学曲线和溶解曲线分析
实验组与对照组SYBR GreenⅠ荧光定量PCR溶解曲线所得的caspase-3、caspase-9扩增时的Tm值非常均匀,并且峰值单一(见图2),说明没有引物二聚体和非特异性条带形成。由扩增曲线看出扩增曲线间距非常均一,平行性较好(见图2),说明目的基因与内参基因扩增效率一致,符合在不制作标准曲线的情况下进行相对定量的条件。
2.5 目的基因PCR扩增产物的琼脂糖凝胶水平电泳检测
目的基因 PCR扩增后,琼脂糖凝胶电泳得caspase-3、caspase-9、β-actin 片段分别为 147 bp、176 bp、115 bp,确定为所需要的目的基因(见图3)。
2.6 氟对大鼠肝脏caspase-3基因和caspase-9基因表达的影响
相对定量分析表明,氟诱导大鼠肝脏细胞损伤,引起了caspase-3和caspase-9基因表达水平的改变(见表3),低、中、高剂量组caspase-3基因表达量分别是对照组的0.34±0.10、1.37±0.43 和2.27±0.73倍,其中高氟组表达显著增高(P<0.05);caspase-9的基因表达量分别是对照组的1.03±0.36、3.05±0.68 和 5.85±0.52倍,中氟组和高氟组表达显著高于对照组(P<0.05)。
3 讨论
caspase属于半胱氨酸蛋白酶家族,其家族成员大部分是凋亡的启动子或效应子,在细胞凋亡过程中发挥着重要作用[4]。目前研究者发现的有15种caspase,根据caspase在级联反应的上、下游所处位置和其功能的不同,把它分为三大类,第一类为凋亡始动子,它位于级联反应的上游,它们是包括caspase-2、caspase-8、caspase-9 等,能在其他蛋白参与下发生自我活化并激活下游的caspase。第二类是凋亡效应子,它位于级联反应的下游,分别是caspase-3、caspase-6、caspase-7,它们能被上游的始动子激活,而激活后的caspase作用于那些特异性底物上,使细胞发生形态学及生化等改变,最终导致细胞凋亡等其他改变。第三类包括caspase-1、caspase-4、caspase-5、caspase-13、caspase-14,此类 caspase 在细胞因子介导炎症反应中发挥着主要作用,其次还在死亡受体介导的细胞凋亡途径中起到辅助作用[5]。
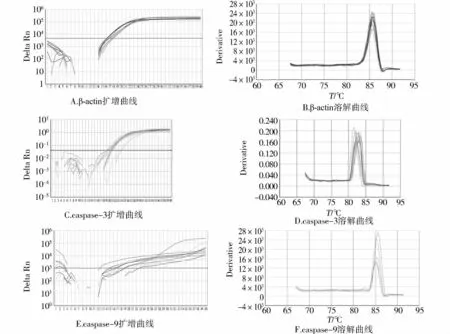
图2 β-actin、caspase-3、caspase-9荧光定量PCR扩增曲线(左)和溶解曲线(右)Fig 2 Amplification curve(left)and dissolution curve(right)of fluorescence quantitative PCR for the β-actin,caspase-3 and caspase-9
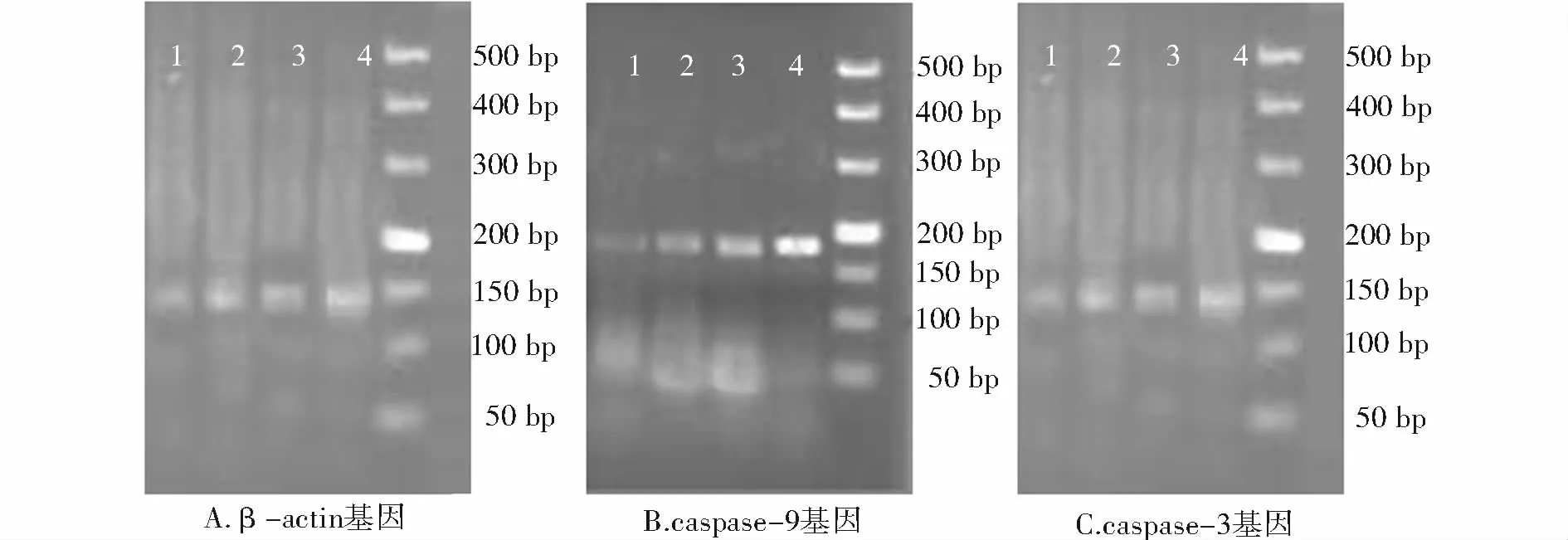
图3 RT-PCR产物检测Figure 3 RT-PCR product of caspase-3 and caspase-9
有研究表明,caspase酶原可以通过以下几种方式激活:自活化(autoactivation)、转活化(transactivation)和非caspase蛋白酶活化(activation by noncaspase proteinases);caspase酶原在某种条件下有自活化的潜能,比如这种酶原在高浓度时可以自活化[5],把 caspase-2的原域和 caspase-3酶原融合起来,大大增强了酶原的自活化和caspase-3诱导的凋亡[6,7]。caspase-9 能激活酶原 caspase-3 和 caspase-7,但不能激活caspase-6,caspase-3反过来可以再激活 caspase-9 及 caspase-8,这样形成正反馈[8],即活化的 caspase-9 激活 caspase-3[9]和 caspase-7,活化的caspase-3反过来又能激活caspase-9酶原,形成正反馈通路。
本实验采用实时荧光定量PCR技术对肝组织caspase-3 mRNA和caspase-9 mRNA表达进行检测发现,氟诱导大鼠肝脏细胞凋亡以及对肝细胞DNA损伤的同时,引起了caspase-3和caspase-9 mRNA表达水平的增高,低剂量的氟对caspase-3 mRNA表达量较caspase-9 mRNA影响不显著,中、高剂量的氟对caspase-3 mRNA和caspase-9 mRNA表达影响均很明显,呈上升趋势,特别是中、高剂量组的caspase-9 mRNA表达量分别是对照组的3.05±0.68、5.85±0.52倍。通过检测大鼠体重及肝脏脏器系数,染氟组与对照组相比,体重及肝脏脏器系数差异均无统计学意义,说明氟对体重及脏器系数无明显影响,可能是因为大鼠首次接触外来物质需要一个适应过程,氟在该过程中对机体体重及脏器系数的影响可能未显示出来。
综上所述,氟引起的 caspase-3 mRNA和caspase-9 mRNA表达较对照组增高,高剂量组caspase-3 mRNA和caspase-9 mRNA表达较中剂量组增高,中、高剂量的氟对 caspase-3 mRNA和caspase-9 mRNA表达影响更大。根据以上实验结果可以发现,低剂量氟进入大鼠肝组织内后,并不一定能立刻激活caspase-9,随着氟剂量的增大和染氟时间的延长,氟有可能引起一系列肝组织细胞因子的改变,激活caspase-9,进而激活caspase-3最终导致肝组织细胞的损伤。由此推测氟对肝细胞DNA损伤以及诱导细胞的凋亡,可能是通过激活caspase-3和caspase-9而促进了细胞DNA损伤和凋亡的发生,当然,氟对大鼠肝组织的损伤作用及机制复杂,还有待更进一步探索。
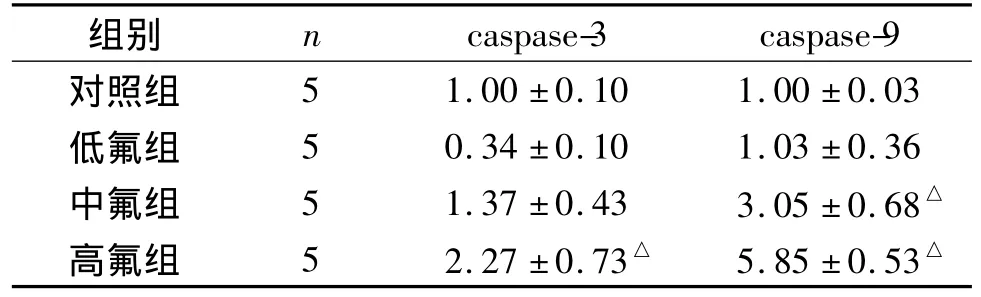
表3 不同染氟剂量大鼠肝组织caspase-3和caspase-9基因表达变化Table 3 Expression levels of caspase-3 and caspase-9 mRNA in liver tissue of rats exposed to different concentrations of fluoride
[1]黄德远,王丹,张秀慧,等.高摄吕燃煤型氟中毒大鼠肝损伤干预效果分析[J].中国公共卫生,2010,6(3):290-291.
[2]Liu YJ,Guan ZZ,Gao Q,etal.Increased level of apoptosis in rat brains and SH-SY5Y cells exposed to excessive fluoride a mechanism connected with activating JNK phosphorylation[J].Toxicol Lett,2011,204(2-3):183-189.
[3]刘茂林,宋国华,高继萍,等.氟对大鼠肝组织细胞凋亡与DNA损伤的影响[J].中国实验动物学报,2013,21(3):85-88.
[4]Blaszczyk I,Grucka-Mamczar E,Kasperczyk S,etal.Influence of fluoride on rat kidney antioxidant system:effects of methionine and vitamin E[J].Biol Trace Elem Res,2008,121(1):51-59.
[5]袁长青,丁振华.caspase的结构与功能[J].国外医学:分子生物学分册,2002,24(3):146-151.
[6]Srinivasula SM,Saleh A,Hedge R,etal.A conserved XIAP-interaction motif in caspase-9 and Smac/DIABLO mediates opposing effects on caspase activity and apoptosis[J].Nature,2001,409:112-116.
[7]崔恒敏,龚涛,陈涛,等.高氟对雏鸡肝细胞周期和凋亡影响的研究[C].重庆:中国畜牧兽医学会禽病学分会第十五次学术研讨会论文集,2010:1.
[8]Kitevska T,Spencer DMS,Christine J,etal.Caspase-2:controversial killer or checkpoint controller[J].Apoptosis,2009,14:829-848.
[9]宋利春,张鸿,刘艳艳.胰岛素样生长因子-1对大鼠缺血后caspase-3和caspase-9mRNA及蛋白表达的影响[J].中国老年学杂志,2013,28(10):952-954.
