终末期肾病慢性腹膜透析患儿贫血影响因素病例对照研究
2014-11-21刘海梅
李 群 徐 虹 孙 利 沈 茜 刘海梅 饶 佳 曹 琦
贫血是儿童慢性肾脏病(CKD)的常见并发症,与多种不良预后相关,不仅是肾移植后移植物存活与否的独立相关因素[1],也是影响住院率和病死率的重要危险因素[2],严重影响腹膜透析(腹透)患者的生活质量。因此改善腹透患儿的贫血状况尤为重要,虽然大部分透析患儿均接受铁剂、促红细胞生成素(EPO)治疗,然而改善贫血治疗的情况并不满意。国内外研究显示EPO剂量不足、铁剂治疗率低、继发性甲状旁腺功能亢进、感染、营养不良、腹透不充分和性别是成人血液净化患者贫血治疗达标率低的主要原因,而白蛋白(ALB)、前白蛋白、尿素清除指数、腹透频率是贫血的独立影响因素[3~6]。国外儿童透析资料也显示血清甲状旁腺激素(PTH)水平与Hb水平呈负相关[7],残肾功能与贫血的改善率呈正相关[8],而目前国内关于儿童慢性腹透贫血的相关因素分析鲜见。本文以病例对照研究为设计方案,以腹透有无贫血分为贫血组和非贫血组,复习文献检索腹透贫血的危险因素,回顾性采集并分析复旦大学附属儿科医院(我院)持续腹透患儿随访资料中的贫血危险因素,为临床改善腹透患儿贫血提供依据。
1 方法
1.1 纳入标准 ①2006年1月至2012年4月期间在我院肾脏风湿科登记行腹透治疗患儿;②随访时间≥12个月。1.2 排除标准 ①来我院腹透前曾在其他医院行血液透析或腹透者;②肾移植术后者。
1.3 腹透随访方案 在我院腹透后建立随访档案,要求每3个月来我院随访1次,并行随访指标的检查。随访指标包括,①基本情况:性别、开始腹透年龄和原发病;②体检项目:BMI、收缩压和舒张压;③实验室检查项目:SCr、BUN、Hb、ALB、血清全段甲状旁腺激素(iPTH)、总尿素清除率(Kt/V)、总肌酐清除率(CrCL)、残肾尿素清除率(Kt/V)、残肾CrCL和左室心肌质量指数(LVMI);④ACEI使用情况;⑤EPO、铁剂(元素铁)治疗剂量;⑥感染情况:腹膜炎、肺炎、泌尿道感染、导管出口/隧道感染和皮肤感染。
1.4 若干随访指标的定义 ①贫血诊断标准:依据2012年改善全球肾脏病预后组织(KDIGO)指南[9]:0.5~5岁Hb<110 g·L-1,~12岁 Hb<115 g·L-1,~15岁 Hb<120 g·L-1。②贫血程度分类[10]:Hb从正常下限至90 g·L-1为轻度,~60 g·L-1为中度,~30 g·L-1为重度,<30 g·L-1为极重度。③Kt/V、LVMI的计算方法参照文献[11],LVMI>38 g·m-2诊断为左心室肥厚。④腹膜炎诊断标准:腹透患儿满足以下2条,a.腹膜炎症状和体征;b.腹透液浑浊,WBC>100·mL-1,N>0.5;c.腹透液经革兰染色或培养证实有细菌存在。⑤霉菌性腹膜炎和结核性腹膜炎除满足腹膜炎诊断标准外,需找到霉菌和结核分枝杆菌[12]。⑥血压采用袖带加压法测量静息状态时上臂肱动脉血压值,测量方法参照文献[13];身高和体重测量方法参照文献[14],BMI=kg·m-2。
腹透开始前的基线随访指标以例数表现,腹透后随访指标中的计量计数指标(体检项目、实验室检查项目和感染情况)以例次表现。
1.5 分组规则 选取每3个月随访时间±3d时的Hb值判断贫血,如符合贫血诊断标准则该阶段随访指标纳入贫血组统计,反之纳入非贫血组统计。
1.6 腹透后随访中的干预 随访中常规予EPO、口服铁剂治疗。对于iPTH升高的患儿,骨化三醇的用法及剂量均参照2005年活性维生素D在慢性肾脏病继发性甲状旁腺功能亢进中合理应用的专家共识(修订版)[15]。
1.7 腹透方式 自动腹透模式,腹透液均为百特医疗用品
贸易上海有限公司生产。
1.8 统计学分析 数据采用SPSS 19.0软件进行分析处理。计量资料以±s表示,计数资料以百分比表示;计量资料单因素分析采用独立样本t检验比较各组间差异;计数资料采用χ2检验比较各组间差异;多因素分析采用Logistic回归分析。检验水准双侧α=0.05,(P<0.05)为差异有统计学意义。
2 结果
2.1 一般情况 符合本文纳入和排除标准的腹透患儿32例;年龄9个月至13岁10月,平均年龄(8.4±3.7)岁;男15例(46.9%),女17例;BMI(15.5±2.5)kg·m-1;ALB(37.6±7.6)g·L-1;iPTH(735±497)pg·mL-1;BUN(31.6 ±14.0)mmol·L-1;SCr(609 ±254)μmol·L-1。原发病分别为肾发育不良8例,慢性肾小球肾炎4例,Alport综合征、幼年肾单位肾痨、鳃耳肾综合征、Denys-Drash综合征、慢性间质性肾炎、先天性肾脏病、原发性肾病综合征激素耐药各1例,肾型过敏性紫癜和局灶节段增生性肾小球硬化(FSGS)各2例,原因不明9例。32例在随访过程中均接受常规EPO、口服铁剂治疗。32例均使用骨化三醇治疗,其中有5例在随访过程中因iPTH值控制在目标范围曾停用骨化三醇。
2.2 贫血的发病情况 腹透前30例(93.9%)符合贫血诊断标准,Hb(79.7 ±21.9)g·L-1,Hct(24.4 ±6.2)%;轻度贫血7例(23.3%),中度贫血17例(56.7%),重度贫血6例(20.0%)。腹透后共随访 120例次,8例次失访(6.3%);57例次(47.5%)符合贫血诊断标准,贫血组Hb和 Hct分别为(95.2±16.6)g·L-1和(30.6±10.5)%,轻度贫血38例次(66.7%),中度贫血18例次(31.6%),重度贫血1例次(1.8%)。腹透前后贫血患儿均未见极重度贫血。非贫血组Hb、Hct分别为 (136.9±17.2)g·L-1和(41.2±5.4)%。
2.3 单因素分析 表1显示,①基本情况:贫血组与非贫血组相比,腹透时年龄、性别差异无统计学意义((P>0.05));②体检项目:BMI、收缩压和舒张压两组差异无统计学意义((P>0.05));③实验室检查项目:随访12个月,贫血组血清iPTH水平高于非贫血组[(605±582)vs(386±434)pg·mL-1,P<0.05],且 iPTH 水平在 500~1 000 pg·mL-1患儿贫血的发生率高于<500 pg·mL-1者(17/27 vs 23/59,P<0.05),而血清 iPTH≥1 000 pg·mL-1者贫血的发生率与500~1 000和<500 pg·mL-1相比,差异均无统计学意义((P>0.05));贫血组残肾Kt/V值低于非贫血组((P<0.05)),左心室肥厚的发生率高于非贫血组(62.5%vs 35.1%,χ2=5.758,P=0.016),差异均有统计学意义;贫血组血清ALB、总 Kt/V、总 CrCL、残肾CrCL均低于非贫血组((P>0.05)),血 BUN、SCr均高于非贫血组((P>0.05)),差异均无统计学意义;④贫血组与非贫血组ACEI使用率差异无统计学意义((P>0.05));⑤EPO、铁剂治疗:贫血组元素铁剂量、EPO剂量均低于非贫血组((P<0.05)),差异均有统计学意义;⑥感染情况:感染发生率贫血组高于非贫血组(35.1%vs 19.0%,(P<0.05)),贫血组感染发生频次以腹膜炎最高(10例),依次为导管出口/隧道感染(5例)、泌尿道感染(2例)、肺炎(2例)和皮肤感染(1例),非贫血组感染发生频次分别为腹膜炎5例、导管出口/隧道感染2例、泌尿道感染4例和肺炎1例。
表1 单因素分析慢性腹透患儿贫血的相关因素±s,n(%)]Tab 1 Univariate analysis of factors related to children with anemia of chronic peritonealdialysis±s,n(%)]
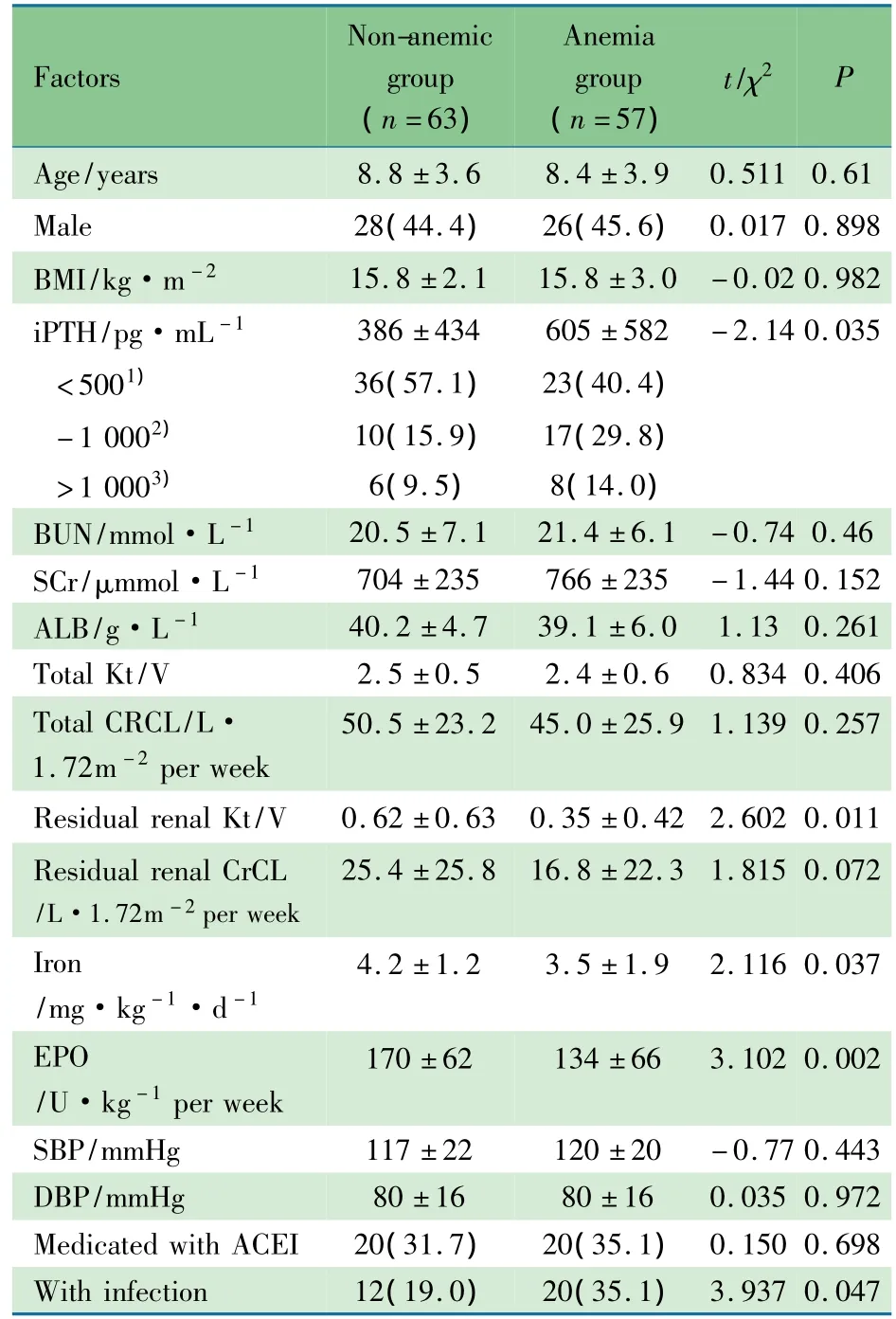
表1 单因素分析慢性腹透患儿贫血的相关因素±s,n(%)]Tab 1 Univariate analysis of factors related to children with anemia of chronic peritonealdialysis±s,n(%)]
Notes Incidence of anemia:1)iPTH <500 pg·mL-1vs 500-1 000 pg·mL-1,23/59 vs 17/27,χ2=4.281,P=0.039;2)iPTH 500-1 000 pg·mL-1vs > 1 000 pg·mL-1,23/59 vs 8/14,χ2=0.131,P=0.717;3)iPTH >1 000 pg·mL-1vs <500 pg·mL-1,8/14 vs 23/59,χ2=0.153,P=0.217
Factors Non-anemic group(n=63)Anemia group(n=57)t/χ2P 0.61 Male 28(44.4) 26(45.6)0.017 0.898 BMI/kg·m-2 15.8±2.1 15.8±3.0 -0.02 0.982 iPTH/pg·mL-1 386±434 605±582 -2.14 0.035<5001) 36(57.1) 23(40.4)-1 0002) 10(15.9) 17(29.8)>1 0003) 6(9.5) 8(14.0)BUN/mmol·L-1 20.5±7.1 21.4±6.1 -0.74 0.46 SCr/μmmol·L-1 704 ±235 766 ±235 -1.44 0.152 ALB/g·L-1 40.2±4.7 39.1±6.0 1.13 0.261Total Kt/V 2.5±0.5 2.4±0.6 0.834 0.406Total CRCL/L·1.72m-2per week Age/years 8.8±3.6 8.4±3.9 0.511 50.5±23.2 45.0±25.9 1.139 0.257 Residual renal Kt/V 0.62±0.63 0.35±0.42 2.602 0.011 Residual renal CrCL/L·1.72m-2per week 25.4±25.8 16.8±22.3 1.815 0.072 Iron/mg·kg-1·d-1 4.2±1.2 3.5±1.9 2.116 0.037 EPO/U·kg-1per week 170±62 134±66 3.102 0.002 0.047 SBP/mmHg 117±22 120±20 -0.77 0.443 DBP/mmHg 80±16 80±16 0.035 0.972 Medicated with ACEI 20(31.7) 20(35.1) 0.150 0.698 With infection 12(19.0) 20(35.1) 3.937
2.4 多因素Logistic回归分析 以是否贫血为因变量,iPTH、残肾Kt/V、感染、EPO及铁剂剂量为自变量进行多元逐步回归,结果显示仅iPTH(OR=1.001,95%CI:1.000~1.002,P=0.018)、残肾 Kt/V(OR=0.212,95%CI:0.068~0.664,P=0.008)、感染(OR=5.754,95%CI:1.745~18.972,P=0.004)与慢性腹透患儿的贫血相关,差异有统计学意义((P<0.05))。
3 讨论
肾性贫血是透析患者最常见的并发症之一,研究显示在开始透析时存在贫血的患儿(年龄<18岁)死亡风险可提高52%,最常见的原因为心肺疾病与感染性疾病[16]。2001年北美小儿肾脏协作组(NAPRTCS)年度汇报显示在长期透析患儿中,即使常规使用EPO治疗,透析6个月后仍有63%存在贫血[17]。本文对32例慢性腹透患儿的研究数据显示,在腹透开始前93.8%患儿存在贫血,腹透开始后随访12个月,共随访120例次,32例患儿虽均常规使用EPO及口服铁剂治疗,贫血程度虽较腹透前有所改善,但仍有47.5%例次发生贫血,贫血控制率仍不满意,提示贫血受许多因素影响。
本文资料单因素分析显示在终末期肾病患儿开始腹透后随访12个月,血清iPTH水平、感染、残肾Kt/V、EPO及铁剂剂量均与贫血相关;而腹透时年龄、性别、BMI、收缩压、舒张压、是否使用 ACEI、ALB、总 Kt/V、总 CrCL、残肾CrCL、BUN、SCr均与贫血无相关性。
血清PTH是CKD患者体内主要的内源性毒素之一,PTH升高致CKD患者多系统病变(如肾性骨病、心血管疾病、神经系统病变、贫血)等,严重影响患者的生活质量及生存时间,是导致其死亡的独立危险因素之一。国外研究[7]显示在透析患儿中血清iPTH水平与Hb水平呈负相关,血清iPTH<500 pg·mL-1患儿其平均Hb水平高于500~1 000 pg·mL-1、≥1 000 pg·mL-1者,且 iPTH 水平是Hb水平的独立相关因素。本研究也显示贫血组血清iPTH水平高于非贫血组,且血清iPTH水平在500~1 000 pg·mL-1患儿贫血的发生率显著高于 iPTH水平<500 pg·mL-1者((P<0.05)),但血清 iPTH水平≥1 000 pg·mL-1患儿贫血的发生率与iPTH水平在500~1 000 pg·mL-1及<500 pg·mL-1者相比均无显著性差异,提示在慢性腹透患儿中,血清iPTH水平应控制在500 pg·mL-1以下。高PTH血症导致贫血的机制尚不完全清楚,动物实验显示PTH升高可导致骨髓纤维化,使RBC生成减少,加重贫血[18];也有研究表明在CKD患者中血清 iPTH可增加RBC内钙离子浓度,引起RBC表面磷脂酰丝氨酸外翻增多(作为巨噬细胞识别的信号),被识别后的异常RBC在脾脏被清除,从而加速RBC凋亡加重肾性贫血[19]。此外,PTH也是导致EPO低反应性的相关因素[20]之一,致使贫血不能控制。
在CKD患儿中感染十分常见,而感染是炎症的重要原因之一,炎症导致RBC生成减少、破坏增加。炎症反应早期,由于炎症激活了网状内皮系统,巨噬细胞加快清除循环中抗体或免疫复合物包裹的RBC,Hb下降[21]。另外,在炎症的急性反应期,炎性因子如TNF-α、IL-1、IFN-γ可下调红系祖细胞上的EPO受体,降低其对于EPO的敏感性,使EPO升高迟缓,活性降低[22],导致贫血。研究表明在有感染病史的腹透患者中Hb水平明显低于无感染者[4]。本文结果也显示感染是腹透患儿贫血不能改善的影响因素之一。
本文资料还显示贫血组感染发生频次以腹膜炎最高,依次为导管出口/隧道感染、泌尿道感染、肺炎和皮肤感染。反复腹膜炎是腹透患者不能坚持透析的重要原因[23]。Sinangil等[24]对301例慢性腹透患者的回顾性研究发现,腹膜炎和导管出口处感染是其主要的感染并发症,且腹膜炎和败血症是有感染并发症患者死亡的主要原因。因此预防和控制感染尤其腹膜炎和导管出口/隧道感染是改善腹透患儿贫血的关键。由于儿童腹透大多由家庭成员居家操作,因此对家庭成员的无菌操作宣教及再培训尤为重要。
在慢性腹透患者中,残肾Kt/V主要反映残肾对尿素的周清除率,残肾CrCL主要反映残肾对肌酐的周清除率,两者在一定程度上可反映残肾功能。有研究表明,在长期血液透析患者中,残肾功能与贫血改善率显著正相关,保护血透患者的残肾功能可改善预后[8]。本研究显示贫血组CrCL有低于非贫血组的趋向,贫血组残肾Kt/V显著低于非贫血组,提示残肾功能好的患儿,腹透过程中贫血的发生率可能较低。因此,临床医生应尽力保护腹透患儿的残肾功能以提高贫血的改善。
慢性透析患者由于肾功能衰竭,EPO生成减少,加上铁缺乏[25],从而导致 RBC生成减少,导致贫血,故铁剂和EPO治疗是CKD贫血患者治疗中的一个重要组成部分[26,27]。国内资料[3]显示 EPO 治疗剂量不足和铁剂治疗率低是成人透析患者贫血不能改善的主要原因。本文单因素分析显示在终末期肾脏病患儿中,开始腹透后随访12个月,贫血组铁剂、EPO治疗剂量均低于非贫血组,但仍在治疗剂量范围内,提示在慢性腹透患者中,使用常规治疗量的EPO、口服铁剂治疗,仍有部分患者贫血不能得到改善,与国外研究[17]相符。
多因素分析显示,血清PTH水平、感染与贫血呈正相关,残肾Kt/V与贫血呈负相关,而铁剂及EPO治疗剂量与贫血无相关性。一般而言,EPO、铁剂疗效不佳的原因可能包括:①肠道血液丢失药物;②尿毒症时胃肠道铁吸收障碍和使用磷结合剂抑制了膳食中铁元素的吸收导致铁缺乏;③EPO治疗时机体对铁的需求增加导致功能性缺铁;④炎症反应[28]和PTH[20]导致 EPO 抵抗。故推测,在慢性腹透患儿存在感染、血清iPTH水平升高等情况下,其贫血的控制可能需要使用较常规剂量更大的EPO和铁剂剂量。应控制iPTH在目标范围、加强预防和控制感染、保护残肾功能及合理使用静脉铁剂等。另外,有关铁状态的评估指标随访缺失明显,尚不能对本研究对象的铁状态作出评估。
贫血可促进慢性腹透患者心血管疾病的发生与进展,严重影响患者的生存质量,国外多中心研究显示贫血是腹透患者左心室肥厚的危险因素[29],与左心功能不全相关。本文资料也显示贫血组左心室肥厚的发生率显著高于非贫血组,纠正贫血可减少腹透患儿心血管疾病的发生,改善患儿的生存质量。
[1]de Andrade LG, Abrao JM, Carvalho MF,et al.Anemia at one year is an independent risk factor of graft survival.Int Urol Nephrol, 2012,44(1):263-268
[2]Port FK,Pisoni RL,Bragg-Cresham JL,et al.DOPPS estimates of patient life years attributable to modifiable hemo dialysis practices in the United States.Blood Purif,2004,22(1):175-180
[3]Lin P(林攀),Liu ZH,Zou JZ, et al.A multicenter crosssectional survey of anemia in patients with dialysis:a survey in Shanghai.J Nephrol Dialy Transplant(肾脏病与透析肾移植杂志),2011,20(4):332-337
[4] Pérez-Flores I, Coronel F, Cigarrán S,et al.Relationship between residual renal function, inflammation, and anemia in peritoneal dialysis.Adv Perit Dial, 2007,23:140-143
[5]Neves PL, Trivino J, Casaubon F,et al.Elderly patients on chronic hemodialysis:effect of the secondary hyperparathyroidism on the hemoglobin level.Int Urol Nephrol,2002,34(1):147-149
[6]Yang FY(杨福燕),Wei CY, Pang JL.A cross-sectional survey and the analysis of related factors about anemia in patients with maintenance hemodialysis in Xinxiang District.International Journal of Transplantation and Hemopurification(国际移植与血液净化杂志),2012,5(10):33-38
[7]van Stralen KJ, Krischock L, Schaefer F, et al.Prevalence and Predictors of Sub-target Hb level in Children on Dialysis.Nephrol Dial Transplant, 2012 ,27(10):3950-3957
[8]Penne EL, van der Weerd NC, Grooteman MP,et al.Role of Residual Renal Function in Phosphate Control and Anemia Management in Chronic Hemodialysis Patients.Clin J Am Soc Nephrol,2011,6(2):281-289
[9] National Kidney Foundation.KDIGO Clinical Practice Guideline for Anemia in Chronic Kidney Disease.Chapter 1:Diagnosis and evaluation of anemia in CKD.Kidney Int Suppl,2012, (2):288-291
[10]沈晓明,王卫平,主编.儿科学.第7版.北京:人民卫生出版社,2011.348-349
[11] International Pediatric Dialysis Network.http://www.pedpd.org
[12]王海燕,主编.肾脏病学.第2版.北京:人民卫生出版社,1996.544-1 560
[13]欧阳钦,吕卓人.临床诊断学(全国高等医药院校7年制教材).北京:人民卫生出版社,2001,90-91
[14] WHO expert committee.Physical status,the use and interpretation of anthropometry.WHO:Geneva,1995,263-311,455
[15] Reasonable Application of Active Vitamin D Experts Cooperation Group(活性维生素D的合理应用专家协作组).General understanding on reasonable application of active vitamin D in hyperparathyroidism secondary to chronic kidney disease.Chin J Nephrol(中华肾脏病杂志),2005,21(11):698-699
[16]Warady BA, Ho M.Morbidity and mortality in children with anemia at initiation of dialysis.Pediatr Nephrol, 2003,18(10):1055-1062
[17]Neu AM,Ho PL,McDonald RA,et al.Chronic dialysis in children and adolescents:The 2001 NAPRTCS Annual Report.Pediatr Nephrol, 2002,17(8):656-663
[18]Lowry MB,Lotinun S,Leontovich AA,et al.Osteitis fibrosa is mediated by Platelet-Derived Growth Factor-A via a phosphoinositide 3-kinase-dependent signaling pathway in a rat model for chronic hyperparathyr-oidism.Endocrinology, 2008,149(11):5735-5746
[19]Mu L(穆霖),Fu SX.Effect of parathyroid hormone on renal anemia in patients with chronic kidney disease.Chin J Nephrol(中华肾脏病杂志),2011,27(4):266-270
[20]Drüeke TB, Eckardt KU.Role of secondary hyperparathyroidism in erythropoietin resistance of chronic renal failure patients.Nephrol Dial Transplant, 2002,17(S5):28-31[21]Chawla LS, Krishnan M.Causes and consequences of inflammation on anemia management in hemodialysis patients.Hemodial Int, 2009,13(2):222-234
[22]Guidi GC, Lechi Santonastaso C.Advancements in anemias related to chronic conditions.Clin Chem Lab Med, 2010,48(9):1217-1226
[23]Mizuno M, Ito Y, Tanaka A,et al.Peritonitis is still an important factor for withdrawal from peritoneal dialysis therapy in the Tokai area of Japan.Clin Exp Nephrol, 2011 ,15(5):727-737
[24]Sinangil A, Koc Y, Unsal A,et al.Effects of infectious complications on patients'survival in peritoneal dialysis.Eur Rev Med Pharmacol Sci, 2013 ,17(8):1064-1072
[25]Baracco R, Saadeh S, Valentini R, et al.Iron deficiency in children with early chronic kidney disease.Pediatr Nephrol,2011,26(11):2077-2080
[26]Post JB ,Wilkes BM,Michelis MF.Iron deficiency in patients with chronic kidney disease:potential role for intravenous iron therapy independent of erythropoietin.Int Urol Nephrol,2006,38(3-4):719-723
[27]Malyszko J, Malyszko JS, Pawlak K, et al.Hepcidin,iron status,and renal function in chronic renal failure,kidney transplantation ,and hemodialysis.Am J Hemstol,2006,81(11):832-837
[28]Costa E, Rocha S, Rocha-Pereira P,et al.Neutrophil activation and resistance to recombinant human erythropoietin therapy in hemodialysis patients.Am J Nephrol, 2008,28(6):935-940
[29]Moretta G, Locatelli AJ, Gadola L,et al.Riode La Plata study:a multicenter,cross-sectional study on cardiovascular risk factors and heart failure prevalence in peritoneal dialysis patients in Argentina and Uruguay.Kidney Int Suppl, 2008,(108):159-164
