姜黄素通过抑制NF-κB的活化增加胃癌细胞的放疗敏感性
2014-11-20闫国诚王双全
吴 宏,闫国诚,王双全,王 凯,张 毅
(1西电集团医院普外科,西安 710007;2西安交通大学第一附属医院病理科;*通讯作者,E-mail:wuhongg666@163.com)
胃癌是普外科常见肿瘤之一,胃癌的治疗除手术治疗外,放射治疗也是重要的治疗方法之一,但由于放疗耐受的发生,其治疗效果一直不甚理想。开发新的放疗增敏剂,提高患者放射治疗的疗效,成为当下研究的热点之一。中药因其作用广泛、毒副作用较低,成为放疗增敏剂的重要选择方向之一,因此,许多研究将目光投到了中药领域,其中就包括姜黄素[1-3]。
姜黄素是姜黄根茎中的主要有效成分,其为一种多元酚。既往研究发现其对肿瘤细胞具有抗增殖、促凋亡、抗血管生成和诱导细胞周期阻滞等多种功能[4-11]。也有研究发现其具有放疗增敏作用[3],但是其具体分子机制尚未明确。基于以上背景本实验选择观察姜黄素对胃癌细胞的放疗增敏作用,探讨其具体作用机制。
1 材料与方法
1.1 细胞及试剂
姜黄素购自美国Sigma公司,使用二甲基亚砜(DMSO)溶解制成10 mmol/L的储存液备用。人胃癌细胞株(BGC-823)为本实验室保有,细胞培养采用含10%胎牛血清的DMEM培养基,置于37℃,5%CO2培养箱中培养。兔抗人p65抗体,兔抗人p50抗体,兔抗人AKT抗体,兔抗人p-AKT抗体购自美国Cellsignal公司,抗β-actin抗体及羊抗人Histone H1购自美国Santa公司。
1.2 MTT实验检测姜黄素对胃癌细胞系BGC-823增殖的影响
利用MTT方法检测姜黄素对胃癌细胞系BGC-823增殖的影响。将细胞接种于96孔板中每孔接种细胞大约3×103个(细胞计数法),培养过夜,次日吸去细胞培养基,用含有不同浓度姜黄素(0,10,20,30,40,50,60 μmol/L)的培养基对细胞进行培养,48 h后利用MTT法检测。根据每组细胞数占DMSO干预组个数百分比对比实验结果。
1.3 克隆形成实验检测姜黄素对胃癌细胞放疗敏感性的影响
将胃癌细胞系BGC-823分为两组,对照组利用DMSO进行处理,实验组利用25μmol/L的姜黄素进行处理。4 h后室温条件下接受照射(放射量分别为0,2,4,6 Gy),然后吸弃细胞培养液,洗涤细胞两次,将细胞重悬后接种于60 mm培养皿,培养10-14 d后结晶紫染色后计数细胞克隆。
1.4 Western blot检测姜黄素对p65、p50、AKT 和p-AKT表达的影响
将胃癌细胞系BGC-823细胞分为三组0,25,50 μmol/L姜黄素干预组,每组都接受4 Gy的射线照射。处理方法同克隆形成实验。然后收集细胞按以下方法提取蛋白。
1.4.1 总蛋白提取 将1×106个单细胞悬液裂解于200μl细胞裂解液中,充分裂解后低温离心,上清即为细胞总蛋白。
1.4.2 胞核蛋白提取 方法参照试剂盒说明进行(南京凯基),具体如下:取培养细胞5×106-1×107个/ml,4 ℃离心,500×g,3 min 后收集细胞,弃去培养液,用预冷PBS洗涤两遍;移液枪尽可能取去上清,勿留残液,估计细胞压积PCV(离心后的紧实细胞体积);每20μl细胞压积中,加入200μl预冷的Buffer A,最大转速涡旋剧烈振荡15 s,置冰上10-15 min;加入11μl冷Buffer B,最大转速涡旋剧烈振荡5 s,置冰上1 min;再次最大转速涡旋剧烈振荡5 s后,4 ℃离心,16 000×g,5 min;尽快将上清转入另一预冷的洁净微量离心管,置于冰上,即得胞质蛋白;在离心沉淀物中加入100μl预冷的Buffer C,再次离心,即可得到胞核蛋白。蛋白采用BCA试剂盒进行定量。提取蛋白定量后每孔取50μg上样,其后进行凝胶电泳并转膜,5%脱脂牛奶封闭1 h,一抗(抗 p65 抗体 1∶500,抗 p50 抗体 1∶600,抗 AKT抗体1∶1 000,抗p-AKT 抗体1∶1 000,β-actin抗体1∶1 000,抗Histone H1 抗体1∶1 000)4 ℃孵育过夜,相应二抗常温孵育2 h,加入发光液用上海培清凝胶酶谱成像仪检测蛋白表达量。
1.5 统计学分析
2 结果
2.1 姜黄素对胃癌细胞系BGC-823细胞增殖能力的影响
随着姜黄素作用浓度的增加,姜黄素对胃癌细胞系BGC-823细胞的增殖的抑制作用逐渐增强,其作用表现出明确的剂量效应关系,在浓度高于40 μmol/L时,这种作用更为强烈,与空白对照浓度比较,差异有统计学意义(见图1)。
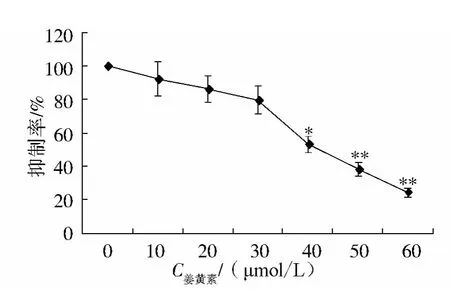
图1 姜黄素对胃癌细胞株系BGC-823增殖能力的抑制作用Figure 1 The anti-proliferative effect of curcumin on gastric cell lines BGC-823
2.2 姜黄素处理后细胞的放疗敏感性明显增加
根据MTT的相关结果,我们选用25μmol/L作为姜黄素的干预剂量(对细胞的增殖没有明显的抑制作用)。实验细胞分为两组:空白对照组(0 μmol/L)和姜黄素干预组。实验结果发现,经姜黄素处理后,空白对照组细胞存活率随放射剂量的增加逐渐降低,而姜黄素干预组随放射剂量的增加细胞存活率降低更加明显,且两组比较差异显著(P<0.05,见图2),即经姜黄素处理后,照射后细胞克隆形成能力明显降低,且随着照射剂量的增加这种抑制作用更为明显。
2.3 姜黄素抑制胃癌细胞系BGC-823中AKT的磷酸化水平及NF-κB的核内表达水平
Western印迹法结果表明胃癌细胞系BGC-823细胞核内p65和p50的表达水平明显降低(见图3A),利用Image J软件测量各组数据的灰度值并对数据进行处理后发现,差异具有统计学意义(见图3B)。这提示NF-κB在姜黄素干预后入核的量与空白对照组相比明显减低,姜黄素可能是通过抑制NF-κB的入核,从而阻断其对下游基因的表达的调控来发挥其在胃癌细胞自BGC-823中的作用的。
此外我们的研究还发现,与对照组相比,姜黄素干预后细胞内总的AKT没有变化,磷酸化的AKT明显减少,并随姜黄素浓度增加而减少(见图4A)。利用Image J软件测量各组数据的灰度值对各组p-AKT与AKT的比值占空白对照组百分比进行统计分析后发现,差异具有统计学意义(见图4B),随姜黄素浓度增加,磷酸化AKT百分比逐渐降低,提示,姜黄素可以抑制AKT的磷酸化。

图2 姜黄素对放射治疗后细胞的存活率影响Figure 2 Effect of curcumin on post-radiation cell clonogenic survival of gastric cells
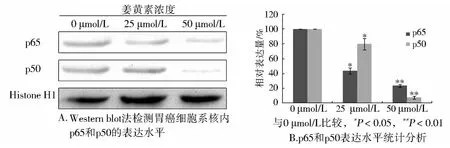
图3 照射后姜黄素抑制胃癌细胞系中p65和p50的核内表达水平Figure 3 Curcumin inhibited the expressions of p65 and p50 in the nucleus after irradition
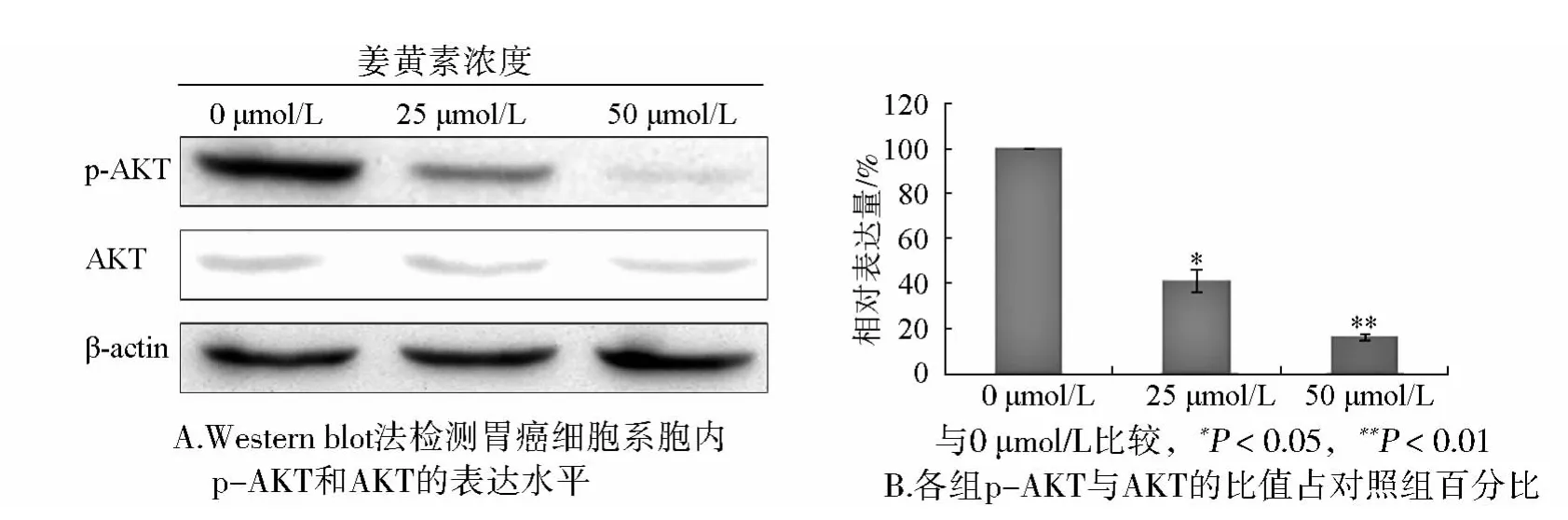
图4 姜黄素对照射后胃癌细胞系中p-AKT和AKT表达水平的影响Figure 4 Effect of curcumin on the phosphorylation level of AKT after irradition
3 讨论
胃癌是普外科最为常见的肿瘤之一,世界范围内占所有肿瘤总数的8%,占肿瘤致死总数的10%[12]。除外科手术治疗之外,放射治疗是胃癌术后重要的治疗方法之一,但并不是所有的患者都对放射治疗敏感,部分患者甚至出现明显的耐受。临床迫切需要解决这一难题,放疗增敏剂的获得便是解决这一问题的重要途径之一,目前中药放射敏感性的研究较少,探索中药在此方面的作用具有重要意义,姜黄素便是其中之一。在临床应用中姜黄素因为具有价格低廉、可口服且低毒性的特点,成为大家关注的焦点。研究发现姜黄素在达到12 mg/d的剂量时,人体仍可良好耐受,无明显的毒副作用出现[13]。也有研究发现姜黄素对结肠癌具有预防作用且有效剂量较低[14,15]。本实验观察姜黄素对胃癌细胞系BGC-823的放疗增敏作用,结果发现姜黄素能够抑制胃癌细胞株BGC-823的增殖,在低于增殖抑制浓度的剂量具有明显的放疗增敏作用。
既往研究发现,NF-κB的活化与放射引起的细胞凋亡密切相关[16]。由于肿瘤细胞的凋亡与其放疗敏感性密切相关,许多研究致力于明确NF-κB的活化与放疗增敏的关系,多数研究认为NF-κB的活化确与放疗增敏密切相关,抑制NF-κB的活性能够明显提高肿瘤细胞对放疗的敏感性[17-21]。姜黄素作用范围广泛,其对肿瘤细胞的作用涉及到多种分子及信号通路,我们推测其作用机制可能与NF-κB的活性改变相关,所以本实验将其列为研究的指标之一。实验结果表明,姜黄素能够明显抑制NF-κB的p65和p50亚基的入核,提示姜黄素可能是通过抑制NF-κB的入核进一步作用下游靶基因,增强胃癌细胞系BGC-823的放疗敏感性。
AKT信号通路是细胞内最为常见的细胞信号通路之一,其对细胞增殖、凋亡及侵袭转移等均具有调节作用。此外研究发现AKT信号通路与肿瘤的放疗增敏密切相关[22],也有研究显示,姜黄素对AKT信号通路的活性具有调节作用,姜黄素能够抑制细胞内AKT的磷酸化水平[23]。因此,我们推测姜黄素对胃癌细胞的放疗增敏作用可能与AKT信号通路相关。本研究证实,姜黄素可以明显抑制AKT信号通路的磷酸化水平。
综上,本研究发现姜黄素能够增强胃癌细胞系的放疗敏感性,而这种作用可能与其对NF-κB活性的抑制相关,而其对NF-κB活性的抑制可能与其对AKT的磷酸化水平的调节相关。本研究为姜黄素应用胃癌的增敏治疗提供了新的实验依据,为其在临床中的应用垫定了基础。
[1]Krishnan S,Janjan NA,Skibber JM,etal.Phase II study of capecitabine(Xeloda)and concomitant boost radiotherapy in patients with locally advanced rectal cancer[J].Int J Radiat Oncol Biol Phys,2006,66(3):762-771.
[2]Rodel C,Liersch T,Hermann RM,etal.Multicenter phase II trial of chemoradiation with oxaliplatin for rectal cancer[J].J Clin Oncol,2007,25(1):110-117.
[3]Sandur SK,Deorukhkar A,Pandey MK,etal.Curcumin modulates the radiosensitivity of colorectal cancer cells by suppressing constitutive and inducible NF-kappaB activity[J].Int JRadiat Oncol Biol Phys,2009,75(2):534-542.
[4]Tomita M,Kawakami H,Uchihara JN,etal.Curcumin(diferuloylmethane)inhibits constitutive active NF-κB,leading to suppression of cell growth of human T-cell leukemia virus type I-infected T-cell linesand primary adult T-cell leukemiacells[J].Int JCancer,2006,118(3):765-772.
[5]Shishodia S,Amin HM,Lai R,etal.Curcumin(diferuloylmethane)inhibits constitutive NF- κB activation,induces G1/S arrest,suppresses proliferation,and induces apoptosis in mantle cell lymphoma[J].Biochem Pharmacol,2005,70(5):700-713.
[6]Siwak DR,Shishodia S,Aggarwal BB,etal.Curcumin-induced antiproliferative and proapoptotic effects in melanoma cells are associated with suppression of IκB kinase and nuclear factorκB activity and are independent of the B-Raf/mitogen-activated/extracellular signal-regulated protein kinase pathway and the Akt pathway[J].Cancer,2005,104(4):879-890.
[7]Li L,Aggarwal BB,Shishodia S,etal.Nuclear factor-κB and IκB kinase are constitutively active in human pancreatic cells,and their down-regulation by curcumin(diferuloylmethane)is associated with the suppression of proliferation and the induction of apoptosis[J].Cancer,2004,101(10):2351-2362.
[8]Wei SC,Lin YS,Tsao PN,etal.Comparison of the anti-proliferation and apoptosis-induction activities of sulindac,celecoxib,curcumin,and nifedipine in mismatch repair-deficient cell lines[J].JFormos Med Assoc,2004,103(8):599-606.
[9]Bharti AC,Shishodia S,Reuben JM,etal.Nuclear factor-κB and STAT3 are constitutively active in CD138+cells derived from multiple myeloma patients,and suppression of these transcription factors leads to apoptosis[J].Blood,2004,103(8):3175-3184.
[10]Chan MM,Fong D,Soprano KJ,etal.Inhibition of growth and sensitization to cisplatin-mediated killing of ovarian cancer cells by polyphenolic chemopreventive agents[J].J Cell Physiol,2003,194(1):63-70.
[11]Mehta K,Pantazis P,McQueen T,etal.Antiproliferative effect of curcumin(diferuloylmethane)against human breast tumor cell lines[J].Anticancer Drugs,1997,8(5):470-481.
[12]Jemal A,Bray F,Center MM,etal.2011 Global cancer statistics[J].CA Cancer JClin,2012,61(8):69-90.
[13]Lao CD,Ruffin MTt,Normolle D,etal.Dose escalation of a curcuminoid formulation[J].BMC Complement Altern Med,2006,6(17):10-13.
[14]Cruz-Correa M,Shoskes DA,Sanchez P,etal.Combination treatment with curcumin and quercetin of adenomas in familial adenomatous polyposis[J].Clin Gastroenterol Hepatol,2006,4(8):1035-1038.
[15]Garcea G,Berry DP,Jones DJ,etal.Consumption of the putative chemopreventive agent curcumin by cancer patients:assessment of curcumin levels in the colorectum and their pharmacodynamic consequences[J].Cancer Epidemiol Biomarkers Prev,2005,14(1):120-125.
[16]Wang CY,Mayo MW,Baldwin ASJr.TNF-and cancer therapy-induced apoptosis:potentiation by inhibition of NF-κB[J].Science,1996,274(5288):784-787.
[17]Mukogawa T,Koyama F,Tachibana M,etal.Adenovirus-mediated gene transduction of truncated IκBα enhances radiosensitivity in human colon cancer cells[J].Cancer Sci,2003,94(8):745-750.
[18]Russo SM,Tepper JE,Baldwin ASJr,etal.Enhancement of radiosensitivity by proteasome inhibition:implications for a role of NF-κB[J].Int J Radiat Oncol Biol Phys,2001,50(1):183-193.
[19]Wang CY,Cusack JC Jr,Liu R,etal.Control of inducible chemoresistance:enhanced anti-tumor therapy through increased apoptosis by inhibition of NF-κB[J].Nat Med,1999,5(4):412-417.
[20]Yamagishi N,Miyakoshi J,Takebe H.Enhanced radiosensitivity by inhibition of nuclear factor kappa B activation in human malignant glioma cells[J].Int JRadiat Biol,1997,72(2):157-162.
[21]Kawamura I,Morishita R,Tsujimoto S,etal.Intravenous injection of oligodeoxynucleotides to the NF-κB binding site inhibits hepatic metastasis of M5076 reticulosarcoma in mice[J].Gene Ther,2001,8(12):905-912.
[22]Kumar A,Pandurangan AK,Lu F,etal.Chemopreventive sphingadienes downregulate Wnt signaling via a PP2A/Akt/GSK3β pathway in colon cancer[J].Carcinogenesis,2012,33(9):1726-1735.
[23]Hoppe JB,Coradini K,Frozza RL,etal.Free and nanoencapsulated curcumin suppressβ-amyloid-induced cognitive impairments in rats:Involvement of BDNF and Akt/GSK-3βsignaling pathway[J].Neurobiol Learn Mem,2013,106(C):134-144.
