逆水煤气变换催化剂的制备及反应性能
2014-11-18刘仲能王仰东杨为民
余 强,刘仲能,王仰东,杨为民
(中国石油化工股份有限公司上海石油化工研究院,上海201208)
二氧化碳是导致气候变暖的主要温室气体,同时也是非常丰富的碳资源,但是目前利用率仅有1%左右。随着CO2大量排放引起的温室效应日益严重,关于CO2的化学转化和利用也越来越受到重视[1]。Olah 曾提出,以可再生能源制氢,再利用CO2加氢合成甲醇的循环模式可作为应对后油气时代能源紧缺问题的一条解决途径[2]。CO2加氢制甲醇主要包括直接法和间接法两条路线[3,4]。直接法是指CO2直接加氢得到甲醇,该路线受热力学平衡限制,CO2转化率很难超过30%。间接法是指CO2先通过逆水煤气变换制CO(RWGS),再利用合成气加氢制甲醇,该路线可以打破热力学平衡限制,显著提高CO2转化率,使其接近平衡转化率[5]。基于RWGS 反应特点,韩国KIST 开发了一种合成甲醇的CAMERE 新工艺,可有效提高甲醇收率[6]。除了合成甲醇外,RWGS 可将大量温室气体转化成合成气,再利用合成气生产其它高附加值化工产品。另外,焦炉煤气中的大量循环氢通常作为弛放气放空,若通过RWGS 利用过量氢气来增产焦炉煤气制甲醇用合成气,可使单位甲醇产品量的焦炉气消耗降低20%~30%。RWGS 还可与乙苯脱氢制苯乙烯和低碳烷烃脱氢制烯烃进行反应耦合,可提高反应性能,显著降低能耗[7,8]。总的来说,RWGS 反应的应用领域广泛,但相关催化剂及工艺研究报道较少。
目前,RWGS 催化剂主要包括Cu 基催化剂(Cu-Zn/Al2O3,Cu-Fe/Al2O3,Cu/SiO2等)、氧化铈负载催化剂(Ni/CeO2)和贵金属催化剂(Rh/Al2O3,Pd-La2O3/MWCNT)等[9,10]。贵金属催化剂虽然具有较高的活性,但其成本较高。铜基催化剂广泛应用于水煤气变换和甲醇合成反应,近年来也被用于RWGS反应的研究,结果发现即使通过助剂改性或特殊制备方法,其活性和稳定性还是较差,难以满足工业化要求[11,12]。Ni/CeO2催化剂和K 改性Co-CeO2催化剂虽然在600 ℃时,CO 收率可达35%~38%,并且认为零价态的金属相为甲烷化副反应的活性中心,但催化剂较容易失活[13,14]。RWGS 反应通常处于高温水热强还原性的条件,现有的催化剂由于抗还原性和稳定性较差,从而导致其反应性能不佳。Jung等[15]采用共沉淀法制备了MnOx(x为1~2)和Al2O3,ZrO2,MgO 的复合氧化物用于RWGS 反应,显示出较好的性能。Mamedov 等[16]报道了采用含Mn 氧化物和选自La,Ce 和Ni 中的至少一种氧化物的RWGS 催化剂,Mn 基催化剂表现出良好的RWGS 活性,但并未给出相应的反应稳定性结果。本工作将首先对RWGS 反应进行热力学分析,然后采用浸渍法和共沉淀法制备Mn 基催化剂并进行了初步筛选。在此基础上,选取性能较好催化剂,考察了工艺条件对催化性能的影响。
1 实验部分
1.1 催化剂制备
浸渍法:ZnAl2O4采用固相反应法制备。将一定量的拟薄水铝石、硝酸锌溶液、胶溶剂、助挤剂经过混碾、捏合、挤条、干燥、焙烧等工序得到成型载体。配制含金属Mn 和辅助金属M1 或M2 的混合溶液对成型载体进行共浸渍,当浸渍平衡后,将剩余的液体除去,再进行干燥、焙烧等过程制备,标记为Cat-xx-imp。
沉淀法:将一定量的铝源或硅源用水稀释,在剧烈搅拌下,加入含Mn 的活性组分及助剂A 或B或C 的混合溶液,然后均匀滴加氨水,保持50~70 ℃进行共沉淀反应,静止老化、水洗、干燥和焙烧,最后添加成型助剂,压片制得催化剂,标记为Cat-xx-cp。
1.2 催化剂评价
在固定床反应器恒温段装填催化剂进行性能评价。催化剂在H2-N2气氛还原后,调节催化剂床层温度至所需温度,开启原料进行反应,反应后气体产物经冷却和气液分离后,进入Agilent 7890A 气相色谱仪在线分析,采用面积归一法定量,液体产物进行称重记录。在CO2加氢逆水煤气变换反应中,还存在甲烷化副反应(反应式2~3),主要反应如下:
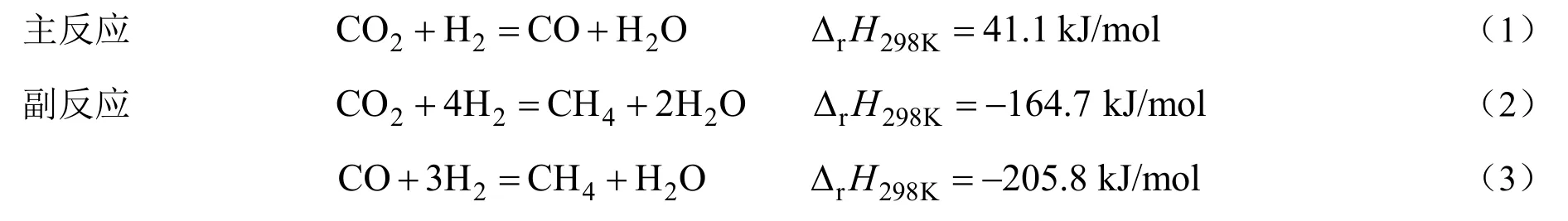
CO2转化率(XCO2)和CO(SCO)选择性计算公式如下:
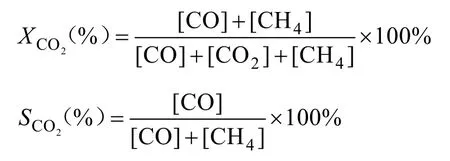
1.3 催化剂表征
采用德国Bruker 公司D8 Advance 型多晶粉末衍射仪(XRD)进行样品晶相分析,Cu Kα(λ=1.540 8 Å)为辐射源,管压为40 kV,管流为40 mA,扫描2θ为10~80 °。用美国Micromeritics 公司AutoChem 2920动态吸附仪(H2-TPR)分析催化剂还原能力,以体积分数为10%的H2-Ar 混合气为还原气,样品用量为50 mg,气体流速为50 mL/min,样品从室温以10 ℃/min 升至750 ℃。样品的比表面积和孔分布在美国Micromeritics 公司的Tristar 3000 物理吸附仪上测定,样品经过200 ℃抽真空处理2 h 后,用低温氮气(77 K)吸附测定。
2 结果与讨论
2.1 热力学分析
采用HSC chemistry 5.0 软件包对逆水煤气变换反应进行热力学计算,结果见图1。由图1可知,甲烷化副反应的ΔG小于0(T<600 ℃时),容易自发进行,而RWGS 主反应的ΔG大于0,不易自发进行。但RWGS 主反应是吸热反应(41 kJ/mol),高温有利,而且随着温度增加,其ΔG也在逐渐减少,同时高温有利于抑制甲烷化。表1给出了主副反应的平衡常数与温度的关系。从表1可看出,当温度低于500 ℃时,副反应的平衡常数远远大于主反应;当温度为500 ℃时,主反应的平衡常数仅为0.2,随着温度进一步增加,主反应的平衡常数逐渐增加,而副反应的平衡常数快速降低。因此,为了减少过高温度导致能耗增加和降低反应器材质要求,整个体系的反应温度选定为500~600 ℃。RWGS 是等体积反应,而甲烷化是体积缩小反应,低压有利于抑制甲烷化反应。依据上述分析,甲烷化反应比较容易发生,高温低压有利于RWGS 反应。

图1 主副反应的吉布斯自由能与温度的关系Fig.1 The relationship between Gibbs free energy and temperature for main and side reactions

表1 主副反应的平衡常数与温度的关系Table 1 The relationship between equilibrium constant and temperature for main and side reactions
2.2 催化剂初步筛选
铜基催化剂广泛应用于合成气加氢制甲醇和水煤气变换,其特点是反应温度较低(T<350 ℃),催化剂性能稳定性良好。但是RWGS 作为高温反应,铜基催化剂活性和稳定性较差。实验采用浸渍法和沉淀法制备了系列Mn 基催化剂,其反应性能见表2。

表2 不同催化剂的RWGS 反应性能Table 2 Catalytic performance of RWGS over different catalysts
由表2所示,共沉淀法制备的Mn 基催化剂Cat-04-cp 与Cat-05-cp 性能较好,CO 收率可达40%左右。下文的反应性能测试主要采用Cat-05-cp 催化剂。另外,Cu-Zn-Al 催化剂在反应初期选择性较高,但不到24 h 催化剂就发生失活,CO 选择性从80.0%降至46.3%,这也证实了铜基催化剂在高温还原性气氛中十分不稳定,易还原成金属铜而降低产物选择性,这与商业Fe2O3/Cr2O3催化剂失活原因类似[6,17]。
2.3 Cat-05-cp 催化剂反应条件优化
2.3.1 反应温度的影响
CO2是稳定的直线型分子,而温度是活化CO2的重要热力学因素。在系统压力0.5 MPa,气体空速6 000 h-1下,考察了不同入口温度对反应性能的影响,如图2所示。结果显示,随着反应温度的增加,CO2转化率逐渐增加,接近平衡转化率。同时,CO选择性也显著增加,这也与热力学分析结果一致。因此,在考虑能耗和对反应器材质要求的前提下,反应温度在550~600 ℃比较合适。
2.3.2 反应压力的影响
在反应温度600 ℃,氢碳体积比1.3 和气体空速12 000 h-1情况下,考察了系统压力对反应性能的影响,结果如图3所示。由图3可见,随着反应压力的升高,有利于体积缩小的甲烷化副反应,CO 选择性明显下降,而CO2转化率出现稍微下降。依据RWGS 的反应规律,低压可以获得较高的产物收率,所以系统压力低于0.5 MPa 比较合适。

图2 不同入口温度下的逆水煤气变换反应结果Fig.2 RWGS results under different inlet temperatures
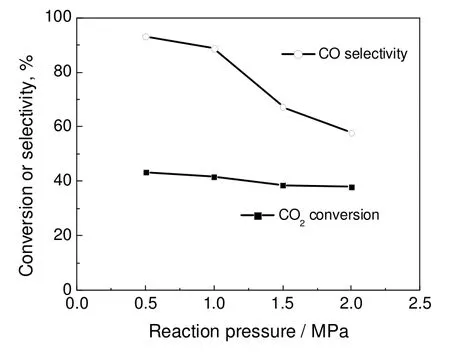
图3 不同压力下的RWGS 反应结果Fig.3 RWGS results under different reaction pressures
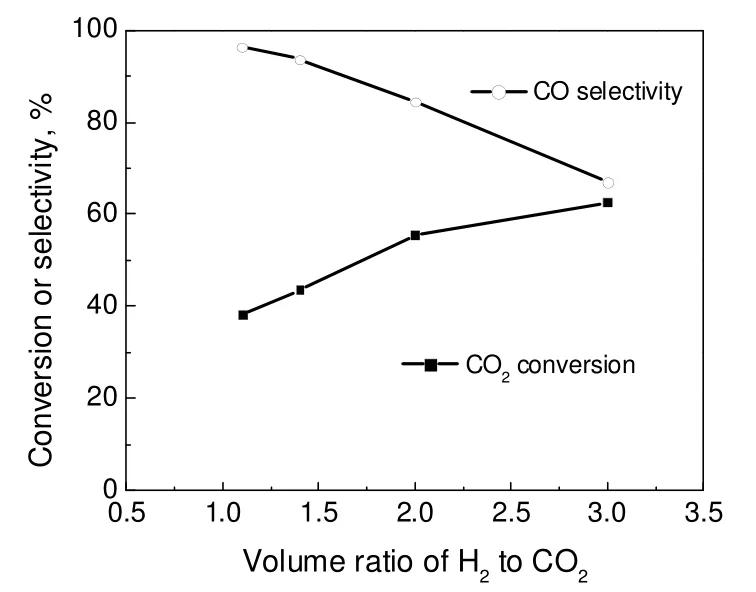
图4 不同H2/CO2 体积比时的RWGS 反应结果Fig.4 RWGS results under different H2/CO2 volume ratios
2.3.3 氢碳体积比的影响
在反应温度600 ℃,压力0.5 MPa 和气体空速12 000 h-1情况下,考察了H2/CO2体积比对反应性能的影响,结果见图4。由图4可知,随着H2/CO2体积比的增加,CO2转化率逐渐增加,然而过量H2解离导致容易发生甲烷化副反应,使CO 选择性逐渐降低。理论上,CO 和CO2发生甲烷化反应分别需要相对于CO2的3 倍和4 倍H2量,而RWGS 只需与CO2等物质的量的H2量。因此,为了获得较好的CO 收率,应选择接近理论比的H2/CO2体积比,适宜的H2/CO2体积比为1.0~1.5。
2.3.4 气体空速的影响
在反应温度600 ℃,压力0.5 Mpa,氢碳体积比1.3 情况下,考察了空速对反应性能的影响,结果见图5。由图5可知,气体空速对CO2转化率影响不大,基本维持在43%左右,而随着空速的增大,产物CO 在催化剂表面的停留时间缩短,抑制了进一步甲烷化反应,CO 选择性明显增大。当空速从2 000 h-1增至9 000 h-1时,CO 选择性从75%增至90%。在12 000 h-1时,CO 选择性达到94%,再增加空速,则出现下降趋势。文献[6]结果显示,ZnAl2O4催化剂在RWGS 中,空速从3 000 mL/(g-cat·h)增加到15 000 mL/(g-cat·h)时,CO2转化率逐渐增加。当空速进一步增加时,则CO2转化率出现下降。因此,合适的气体空速为10 000~15 000 h-1。
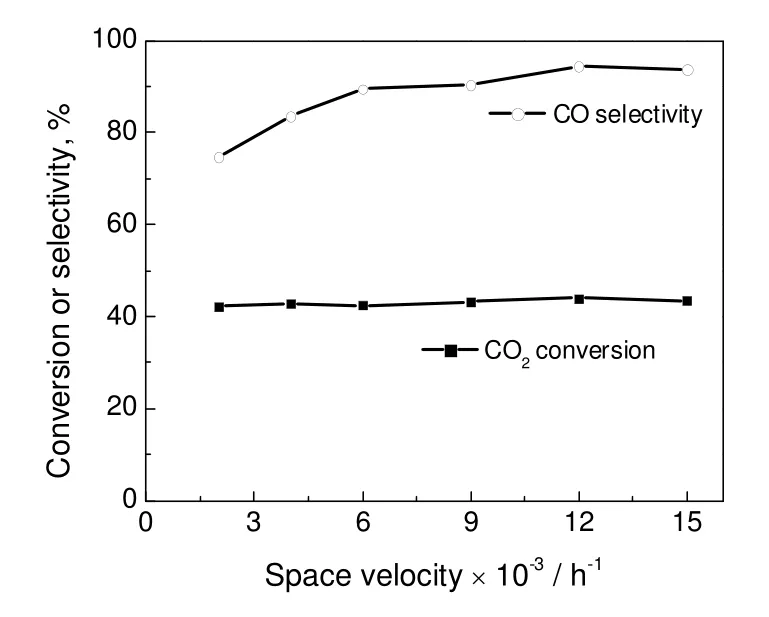
图5 气体空速对RWGS 反应性能的影响Fig.5 Effect of GHSV on the catalytic performance of RWGS

图6 Cat-05 催化剂的RWGS 反应稳定性试验Fig.6 Stability test of Cat-05 catalyst for RWGS reaction
2.4 催化剂稳定性
图6给出了500 h 催化剂稳定性实验结果。由图6中可知,CO2转化率维持在45%,CO 选择性一直稳定在90%左右,表明研制的Mn 基催化剂具有良好的活性和稳定性。常见的氧化物催化剂体系在RWGS 反应条件下通常具有较高的初活性,但是很容易快速失活,比如甲醇合成催化剂Cu-Zn-Al和高温变换催化剂Fe2O3/Cr2O3。这些催化剂失活原因主要是由于催化剂的抗还原性和水热稳定性差。
2.5 催化剂表征结果
为了分析Mn 基催化剂良好稳定性的原因,对其进行了晶相结构和还原性质等表征。由图7所示,新鲜催化剂未出现明显的晶相衍射峰,仅发现微弱且宽化的氧化铝衍射峰,这表明反应前的催化剂高度分散。反应后催化剂在30.2 °,35.4 °,43.7 °和62.6 °出现明显的衍射峰,主要归属为Mn 的尖晶石复合氧化物(CuMn2O4,AlMn2O4),与JCPDS 卡片数据的结果一致(JCPDS 01-073-1605,JCPDS 00-029-0881),这也表明这些晶相物种能够耐受住RWGS 的强还原性高温水热条件。依据相关文献报道[18],在水汽变换反应中,铜锰系高温变换催化剂的活性相为CuMn2O4尖晶石,并且通过优化Cu/Mn 比和共沉淀pH 等条件,可以减少杂晶生成,催化剂表现出高活性。结合XRD结果,推测锰尖晶石既是高温水汽变换的活性中心,也极有可能是RWGS 的活性中心。另外,在2θ为20.8 °,26.6 °和60.0 °处可观察到明显的石英SiO2的衍射峰(JCPDS 01-089-8935),这是由于样品中混入少量的石英细颗粒支撑填料。从H2-TPR 结果来看(图8),催化剂主要出现两个还原峰,240 ℃归属为未形成尖晶石的氧化铜物种的还原,480 ℃的还原峰面积比较小,归属为少量杂晶Mn 物种的还原。

图7 新鲜催化剂与反应后催化剂的XRD 图谱Fig.7 XRD patterns of fresh and used catalysts

图8 新鲜Cat-05 催化剂的H2-TPRFig.8 H2-TPR profile of the fresh Cat-05 catalyst
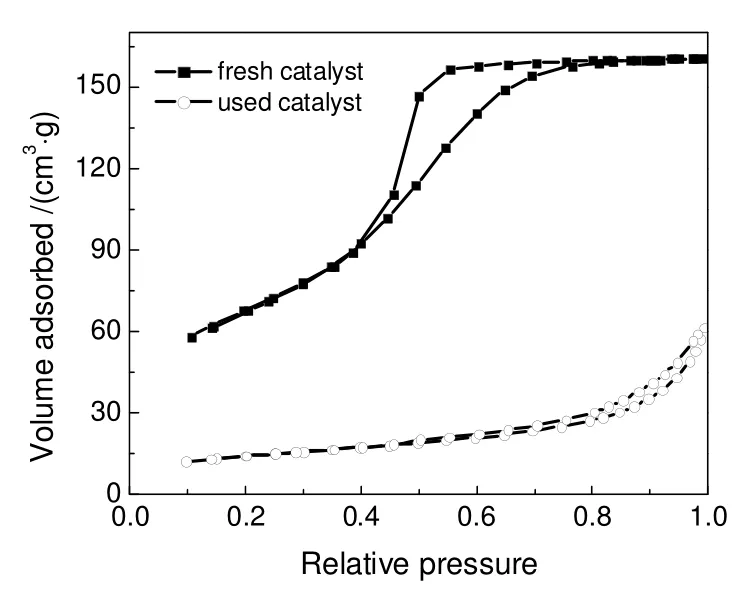
图9 催化剂Cat-05 的N2 吸附脱附等温线Fig.9 N2 adsorption-desorption isotherms of Cat-05 catalyst
图9所示,在N2吸脱附等温线中,对于新鲜催化剂随着相对压力的增加,吸附量也在逐渐增加,当P/P0增加到0.4 时,吸附支和脱附支分离,出现了明显的回滞环(P/P0=0.4~0.8),吸附等温线为典型的IV 型等温线,这是由于颗粒间堆积形成的间隙孔。而反应后催化剂的吸附支与脱附支基本重合,无明显的滞后环且吸附量明显降低,表明催化剂的孔结构发生明显变化。这也证实了XRD 结果,从无定型的新鲜催化剂,经过RWGS 反应,到产生大量致密结构的尖晶石相,这必然影响其孔结构。因此稳定的尖晶石活性相既可以作为活性中心,也可在RWGS 的高温水热环境下稳定运行不失活。
3 结 论
采用共沉淀法制备了Mn 基催化剂用于逆水煤气变换反应,并进行了工艺条件优化和稳定性评价。热力学分析结果表明,甲烷化副反应容易发生,高温低压有利于RWGS 反应。通过优化,RWGS 适宜条件为550~600 ℃,常压~0.5 MPa,氢碳体积比1~1.5,空速10 000~15 000 h-1。在入口温度580 ℃,压力0.5 MPa,氢碳体积比1.5 和气体空速6 000 h-1的条件下,CO2转化率45%,CO 选择性为90%,催化剂500 h 稳定性良好,这主要是由于形成了Mn 基尖晶石活性相。逆水煤气变换催化剂的抗还原性能和水热稳定性直接影响催化性能,在催化剂设计中,采用尖晶石活性相是一种有效提高催化剂的抗还原性和水热稳定性的手段。
[1]Tollefson J.World looks ahead post-copenhagen [J].Nature, 2009, 462(7276):966-967.
[2]Olah G A.Beyond oid and gas:the methanol economy [J].Angewandte Chemie-International Edition, 2005, 44(18):2636-2639.
[3]Wang W, Wang S P, Ma X B, et al.Recent advances in catalytic hydrogenation of carbon dioxide [J].Chemical Society Reviews, 2011,40(7):3703-3727.
[4]魏 伟, 孙予罕, 闻 霞, 等.二氧化碳资源化利用的机遇与挑战 [J].化工进展, 2011, 30(1):216-224.Wei Wei, Sun Yuhan, Wen Xia, et al.Opportunities and challenges of carbon dioxide utilization as a resource [J].Chemical Industry and Engineering Progress, 2011, 30(1):216-224.
[5]Joo O S, Jung K D, Moon I, et al.Carbon dioxide hydrogenation to form methanol via a reverse-water-gas-shift reaction (the CAMERE process) [J].Industrial &Engineering Chemical Research, 1999, 38(5):1808-1812.
[6]Joo O S, Jung K D, Jung Y S.CAMERE process for methanol synthesis from CO2hydrogenation [J].Studies in Surface Science and Catalysis, 2004, 153:67-72.
[7]Sun A L, Qin Z F, Chen S W, et al.Role of carbon dioxide in the ethylbenzene dehydrogenation coupled with reverse water-gas shift [J].Journal of Molecular Catalysis A:Chemical, 2004, 210(1-2):189-195.
[8]葛 欣.丙烷脱氢耦合逆水煤气变换制丙烯催化反应研究进展 [J].天然气化工, 2010, 35(5):61-66.Ge Xin.Studies on coupling of dehydrogenation of propane with reverse water-gas shift reaction for propylene synthesis [J].Natural Gas Chemical Industry, 2010, 35(5):61-66.
[9]Chen C S, Chen W H, Lin S S.Mechanism of CO formation in reverse water-gas shift reaction over Cu/Al2O3catalyst [J].Catalysis Letters, 2000, 68(1-2):45-48.
[10]张少星, 刘全生, 王路辉.逆水煤气变换反应催化剂的研究进展 [J].工业催化, 2006, 14(增刊):25-27.Zhang Shaoxing, Liu Quansheng, Wang Luhui.Research progress on reverse water gas shift reaction (RWGS) catalyst [J].Industrial Catalysis, 2006, 14(Supplement):25-27.
[11]Chen C S, Chen W H, Lin S S.Study of reverse water gas shift reaction by TPD, TPR and CO2hydrogenation over potassium-promoted Cu/SiO2catalyst [J].Applied Catalysis A:General, 2003, 238(1):55-67.
[12]Chen C S, Chen W H, Lin S S.Study of iron-promoted Cu/SiO2catalyst on high temperature reverse water gas shift reaction [J].Applied Catalysis A:General 2004, 257(1):97-106.
[13]Wang L H, Zhang S X, Liu Y.Reverse water gas shift reaction over Co-precipitated Ni-CeO2catalysts [J].Journal of Rare Earths, 2008,26(1):66-70.
[14]Wang L H, Liu H, Chen Y, et al.K-promoted Co-CeO2catalyst for the reverse water-gas shift reaction [J].Chemistry Letters, 2013,42(7):682-683.
[15]Jung K D, Joo O S, Oh J W, et al.Method for the production of dimethyl ether:WO, 2005026093 A1 [P].2005-03-24.
[16]Mamedov A M K, Al-Jodai A A M, Ahmed L C, et al.Catalytic hydrogenation of carbon dioxide into syngas mixture:WO, 2008131898 A1 [P].2008-11-06.
[17]Park S W, Joo O S, Jung K D, et al.ZnO/Cr2O3catalyst for reverse-water-gas-shift reaction of CAMERE process [J].Korean Journal of Chemical Engineering, 2000, 17(6):719-722.
[18]何润霞, 刘全生, 王东升, 等.铜锰系高温变换催化剂制备、表征与催化性能 [J].内蒙古工业大学学报, 2005, 24(3):165-169.He Runxia, Liu Quansheng, Wang Dongsheng, et al.Preparation, characterization and catalytic performance of copper-manganese shift catalyst [J].Journal of Inner Mongolia Polytechnic University, 2005, 24(3):165-169.
