电石渣与氯化铵反应特性研究
2014-11-18李汉川唐盛伟
李汉川,张 涛,唐盛伟
(四川大学化学工程学院,四川 成都 610065)
氯化铵是联碱企业生产纯碱的副产品。我国氯化铵主要以氮肥形式消耗,但氯化铵作为氮肥只利用了其中的氮元素,有价值的氯元素却没有加以利用,还对土壤造成不良的影响[1],而氯又是化学工业产品中重要的元素。因此妥善处理好氯化铵,既是解除纯碱工业的瓶颈问题,又是可持续发展的资源综合利用问题。
随着我国电石工业的快速发展,大量的电石渣堆积,不但占用大量土地,且对土壤有严重的侵蚀作用,属较难处理的工业废弃物[2]。电石渣的主要成分为Ca(OH)2,目前工业上电石渣主要用于免烧砖[3]和水泥的制备[4]、化工行业[5]及三废处理[6]等,但全国电石渣的利用率却还不到30%[5],电石渣的资源化利用是一个亟待解决的问题。
工业上氨碱法采用石灰石煅烧制备的石灰乳与氯化铵反应使氨得到循环,但由于所得氯化钙溶液浓度太低,很难加以利用。目前,利用石灰乳分解氯化铵的主要方法是索尔维法和日本旭硝子公司的新旭法(NA 法)。索尔维法利用纯碱生产中产生的氯化铵溶液与石灰乳混合,然后将氨气蒸出。新旭法利用纯碱的副产氯化铵和石灰乳在溶液中进行反应,同时蒸出氨气。石灰乳来源为石灰石煅烧,所需能耗较大,同时放出大量二氧化碳,环境效应差。另一方面,氯化氨与石灰乳混合反应体系含水率较高,在后续蒸氨过程中蒸汽消耗量大、能耗高,而所得氯化钙溶液浓度低,很难加以利用,导致大量氯化钙废液的产生。每处理1 t 氯化铵,索尔维法产生约10 t 氯化钙废液,新旭法产生约4 t 氯化钙废液[7]。该两种工艺路线回收了氮元素,未能实现对其中氯、钙元素的有效利用,还产生了废液或者废渣。
目前涉及氯化铵与电石渣的研究主要在于利用氯化铵提取其电石渣中的钙以制备高纯碳酸钙、硫酸钙等[5,8]。如李晨[9]等研究了不同浓度的氯化铵溶液等条件对电石渣中钙的提取率的影响,可实现较高钙提取率。本研究采用电石渣与氯化铵反应,期望在实现氨有效回收的同时实现副产氯化钙,或者通过氯化钙制备高纯碳酸钙、硫酸钙等化学品[5,8],以提高该过程的经济性,降低废物排放。为实现电石渣的资源化利用提供一种潜在的途径。
1 实验部分
1.1 电石渣的分析
宜宾天原集团股份有限公司提供的电石渣于105 ℃下干燥2 h,研磨后筛分,将粒径小于0.30 mm的粉渣留存备用,并对电石渣的成分进行分析[10]。XRF-1800 型X 射线荧光光谱(XRF)对筛分粉渣进行的元素分析结果见表1。

表1 电石渣的元素分析Table 1 Elemental analysis results of carbide slag
采用DX-2007 型X 射线衍射仪(XRD)对预处理后的粉渣进行矿物组成表征,结果如图1所示。图1表明,本研究中的电石渣以Ca(OH)2为主晶相,其它矿物组成含量较少。
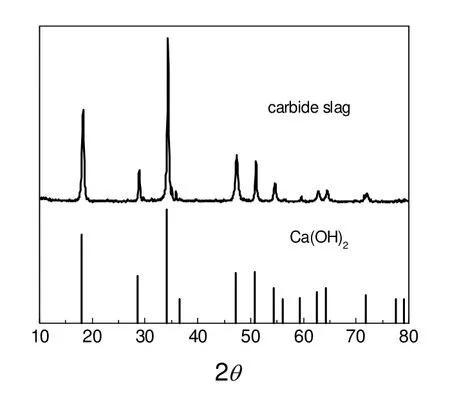
图1 电石渣的XRD 图谱Fig.1 X-ray diffraction patterns of the carbide slag

图2 电石渣的DSC/TG 分析Fig.2 DSC/TG analysis of the carbide slag
采用DTG-60A 型同步差热分析仪对预处理后的粉渣进行了热失重分析,结果如图2所示。图2表明,电石渣的第一个失重值在123.37 ℃,这是电石渣脱结晶水所致;第二个失重值在435.70 ℃,失重率18.62%,是电石渣中的Ca(OH)2分解成CaO 造成;第三个失重值在625.98 ℃,失重率4.44%,是电石渣中的CaCO3分解成了CaO[10]。上述分析与表征的结果表明,电石渣中的主要成分为Ca(OH)2,含量为80.96%,并含有一定量的CaCO3、Al2O3、SiO2和Fe2O3等矿物杂质。
1.2 实验方法
反应采用间歇操作方式在一个500 mL 三口烧瓶中进行,反应温度通过恒温水浴控制,搅拌速度通过磁力搅拌控制器进行调节,三口烧瓶连接具有压力控制装置的二级吸收装置,压力控制装置通过真空泵、缓冲瓶与精密压力表配合控制,控制缓冲瓶阀门开度来调节与稳定吸收装置内的压力,达到操作条件要求。
根据实验所需的含水质量分率配制电石渣料浆,检查吸收装置气密性及压力控制装置后,将上述浆料加入三口烧瓶中后置于恒温水浴锅中加热至设定温度,用水作为吸收液进行二级吸收,将氯化铵加入到烧瓶中,然后搅拌进行反应。反应一定时间后,采用20 ℃的冷水浴终止反应。
采用甲醛法[11]分析测定反应器和吸收瓶中氨的浓度。氨回收率定义如下:

2 实验结果与讨论
电石渣中的氢氧化钙与氯化铵进行反应生产氨和氯化钙,由于反应物氯化铵和生成的氯化钙溶解度都较大,基本完全溶解在水溶液中。其反应按如下反应式进行:

电石渣中的氢氧化钙在水中的溶解度较小,其溶解度受其溶度积制约,但反应生成的氨在水中有较大溶解度,因此需要不断将氨从反应过程中移出才能使反应趋向完全。而溶于水的氨易与反应产物氯化钙生成络合物,因此如何提高氨的逸出程度即氨回收率对该反应过程至关重要。
2.1 不同反应时间下的氨回收率
在常压下,反应温度80 ℃,体系含水质量分率52%,NH4Cl/电石渣的质量比1.2(根据电石渣中Ca(OH)2含量和氯化铵纯度计算得到的理论化学计量质量比为1.25)的条件下,考察了不同反应时间下的氨回收率,结果如图3所示。实验过程中发现,加入氯化铵5 s 左右,即产生大量气泡,表明反应进行的速率较快。由图3可以发现,氨逸出率的变化可以明显分为两个阶段。反应时间小于8 min时,氨回收率随着反应时间的增加急剧增大,说明在此反应时间内,NH4Cl 同Ca(OH)2不断反应,反应生成的氨除在浆料中部分溶解外,还有一定的气氨迅速逸出;反应时间达到8 min 后,吸收瓶中基本观察不到气泡产生,实验测得的氨回收率的增加速率也明显变缓,主要是溶解于液相中的氨逐渐逸出所致,表明此时体系已基本无氨继续生成,反应已基本完全。综合考虑氨回收率和今后工业应用的生产效率,在后续实验中反应时间采用20 min。

图3 不同反应时间下的氨回收率Fig.3 Yield of NH3 under different reaction times

图4 NH4Cl/电石渣质量比对氨回收率的影响Fig.4 Effects of the mass ratio of NH4Cl/carbide slag on yield of NH3
2.2 NH4Cl/电石渣质量比对氨回收率的影响
在常压,反应温度80 ℃,反应时间20 min,体系含水质量分率52%的条件下,NH4Cl/电石渣的质量比对氨回收率的影响结果如图4所示。由图4可知,在NH4Cl/电石渣的质量比为1.8~1.2 时,随着质量比的降低(通过增加电石渣的用量),使参与反应的NH4Cl 的比例不断增加,反应量不断增加,产物氨逐渐增加,氨的回收率急剧增加。根据电石渣中Ca(OH)2组分的含量,理论的计量比是1.25,当质量比达到1.2 时,电石渣已过量。从图4可以看出,即使加大电石渣的量,氨的回收率也几乎没有变化,表明此时体系中的NH4Cl 已基本反应完全,无氨继续生成。假定氯化铵完全反应,气氨在液相中的量按相应条件下水溶液饱和溶解度计算,则其理论氨逸出率大约为44%。实验得到的氨回收率明显低于该值,这主要是由于体系中存在氯化钙,反应生成的钙离子可以与氨络合生成配合物[12],从而抑制了氨逸出吸收,造成氨回收率较低。在后续实验中NH4Cl/电石渣的质量比采用1.2。
2.3 体系含水量对氨回收率的影响
常压下,反应温度80 ℃,反应时间20 min,NH4Cl/电石渣的质量比1.2,反应体系含水率对氨回收率的影响如图5所示。由图5表明,随着含水量的增加,氨回收率呈现先增大后减小的趋势,当含水率为65%左右时氨回收率最高为28%。因为溶液中存在氨的气液溶解平衡和钙离子与氨的配位平衡[12],在含水率较低范围内,氨的溶解平衡处于饱和状态,氨浓度和钙离子浓度都较高,有利于生产钙氨络合物,从而氨回收率较低,随着含水率增加,反应体系中氨浓度和钙离子浓度都降低,生产的钙氨络合物的量降低,氨回收率逐渐升高。当水含量增加到一定程度,溶解的氨量逐渐增加,造成氨回收率急剧下降。
工业上石灰乳回收氨过程一般采用74%的相对含水率进行反应,得到的氨回收率为17.18%,电石渣在相同的实验条件下得到的氨回收率与氨碱法工艺的氨回收率基本一致。但在此条件下,反应终点时废液含水量较大,一方面,造成后续蒸氨过程中蒸汽消耗巨大,能耗增高,另一方面,废液中氯化钙浓度远低于饱和浓度,加大了制备无水氯化钙的难度。按本研究的结果,含水率可降低至65 %,有利于节汽、节水、强化装置能力和增浓废液CaCl2浓度等。在后续实验中含水率采用65%。
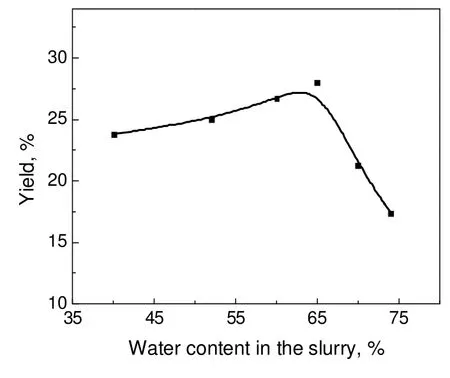
图5 体系含水率对氨回收率的影响Fig.5 Effects of water content in the slurry on yield of NH3

图6 反应温度对氨回收率的影响Fig.6 Effects of reaction temperature on yield of NH3
2.4 反应温度对氨回收率的影响
在常压下,反应时间20 min,体系含水质量分率65%,NH4Cl/电石渣的质量比1.2 条件下,改变反应温度测定的氨回收率见图6。图6表明,随着温度的增加,氨的回收率先不变后急剧增加,在60~70 ℃,氨的回收率几乎接近于零,这是因为在此温度反应速率很慢,同时气氨在浆料中的溶解度较大,反应中所产生的氨几乎全部溶解在浆料中无法逸出;而当反应温度升高至70~90 ℃反应体系中氨的溶解度降低,导致大量氨逸出吸收,氨的回收率急剧上升。随着温度的进一步升高,水蒸汽压增大,在氨逸出的同时会带出一定量的水蒸汽。综合考虑氨的回收率、生产能耗及经济效率等因素,在后续实验中反应温度采用80 ℃。
2.5 体系压力对氨回收率的影响
固定反应温度为80 ℃,反应时间为20 min,体系含水率为65%,NH4Cl/电石渣的质量比为1.2,改变反应真空度得到的氨回收率结果如图7所示。由图7可知,随着真空度的增加,氨的回收率逐渐增加。在一定的温度和压力下,氨在气相中的平衡分压与其在溶液中的摩尔浓度成正比,若增大体系的真空度,氨的气相分压降低,浆料中的氨将解析随逸出,氨的回收率增加。
目前传统氨碱法的氨回收工艺过程也采用真空条件操作,石灰乳与氯化铵于预灰桶中反应后进行蒸氨,废液氨的最低浓度可降低50%,废液温度和塔顶出气温度也下降,且浆料的蒸汽能耗减少[7]。本研究在真空条件下操作也具备这些工业优点,但真空度过大,设备生产强度降低,设备投资过大,所以采取真空度为0.02 MPa 较为适宜。

图7 真空度对氨回收率的影响Fig.7 Effect of vacuum degree on yield of NH3
3 结 论
本研究在低真空条件下采用电石渣与氯化铵反应回收氨。在反应温度80 ℃、反应时间为20 min、体系真空度0.02 MPa、浆液含水质量分率65%和NH4Cl/电石渣的质量比为1.2 的较优反应条件下,氨的回收率可达到57.7%。与现有工业生产条件(反应温度100 ℃、反应时间30 min、常压、含水量74%、石灰乳过量)相比较,体系含水率可降低46.1%,回收率可提高40.5%。研究所得的新工艺既得到较高氨的回收率,且降低反应体系的水含量,从而进一步降低了后续蒸氨过程的能耗。
[1]唐盛伟, 周 飞, 梁 斌, 等.一种利用氯化铵和电石渣生成氨气和氯化钙的工艺:中国, 201210424926 [P].2012-10-31.
[2]邓 琪, 王 琪, 黄启飞, 等.层次分析法评价电石渣资源化利用途径的研究 [J].现代化工, 2010, 30(2):85-90.Deng Qi, Wang Qi, Huang Qifei, et al.Analytic hierarchy process evaluation of ways for carbide slag utilization [J].Modern Chemical Industry, 2010, 30(2):85-90.
[3]李忠金, 谌 天, 谢 琴.环保高压免烧电石渣砖及其制造方法:中国, 200510020443 [P].2005-09-28.
[4]包先法.电石渣生产水泥熟料的工艺 [J].中国氯碱, 2006, (12):35-40.Bao Xianfa.Process of cement clinker by carbide slag [J].China Chlor-Alkali, 2006, (12):35-40.
[5]卢忠远, 康 明, 姜彩荣, 等.利用电石渣制备多种晶形碳酸钙的研究 [J].环境科学, 2006, 27(4):775-779.Lu Zhongyuan, Kang Ming, Jiang Cairong, et al.Calcium carbide of different crystal formation synthesized by calcium carbide residue [J].Environmental Science, 2006, 27(4):775-779.
[6]刘春英.工业废弃物--电石渣的国内现状及其资源化方向 [J].水泥技术, 2006, (6):60-62.Liu Chunying.Current state and reservation direction of industry wastes-calcium carbide sludge [J].Cement Technology, 2006,(6):60-62.
[7]周光耀, 王 楚, 李恒志, 等.纯碱工学 [M].北京:化学工业出版社, 2003:4-121.
[8]Kasikowski.T, Buczkowski R, Dejewska B, et al.Utilization of distiller waste from ammonia-soda processing [J].Journal of Cleaner Production, 2004, (12):759-769.
[9]李 晨, 张 雷, 张宏勋, 等.电石渣合成高纯碳酸钙的研究 [J].无机盐工业, 2011, 43(4):52-54.Li Chen, Zhang Lei, Zhang Hongxun, et al.Studies on synthesis of high purity calcium carbonate with calcium carbide residue [J].Inorganic Chemicals Industry, 2011, 43(4):52-54.
[10]董永刚, 曹碱新, 刘 飞, 等.电石渣理化性质的分析与表征 [J].环境科学与技术, 2008,31(9):95-98.Dong Yong-gang, Cao Jianxin, Liu Fei, et al.Analysis and characterization of physiochemical property of carbide slag [J].Environmental Science &Technology, 2008, 31(9):95-98.
[11]GB/T3600-2000, 肥料中氨态氮含量的测定—甲醛法 [S].
[12]黄雪莉, 吕秉玲.10 ℃下K+, Ca2+//Cl-, SO42-, 36%NH3-H2O 体系相图的研究 [J].高等化学工程学报, 2005, 19(5):691-694.Huang Xueli, Lv Bingling.Study on the phase diagram of K+, Ca2+//Cl-, SO42-, 36%NH3-H2O system at 10 ℃ [J].Journal of Chemical Engineering of Chinese Universities, 2005, 19(5):691-694.
