新疆地区帕金森病遗传易感性与COMT和CYP 1A1基因多态性相互关系的研究
2014-11-17宋秋霞张晓莺李燕云
宋秋霞, 张晓莺, 李燕云
PD是一种严重影响中老年人生活质量的神经系统变性疾病,多数学者认为其是遗传和环境因素共同作用所致的。机体解毒系统的遗传差异可影响个体对PD的易患性,即当机体存在与解毒系统酶体系有关的遗传缺陷时,该机体对外界毒素的敏感性增强,在诱发条件下易患PD[1]。选择性的黑质多巴胺能神经元变性导致多巴胺(Dopamine,DA)减少或代谢异常是PD的核心,人们一直怀疑内源性DA对神经元有毒性作用,参与了PD的病理生理过程,而COMT正是催化DA降解的主要代谢酶[2,3]。PD的发生也可能与机体内参与易患环境毒素代谢酶的变异相关。CYP1A1是体内重要的一项代谢酶,在各种内外源性神经毒素体内代谢解毒过程中起重要作用。
目前,以上两个基因的部分位点多态性已被证实可能与散发性 PD 的发生相关[4~9],且研究[10~12]发现二者均可通过与其它易患基因或者多态位点的相互作用导致PD患病风险增加。本研究中,我们选择主要参与机体内、外源性毒素代谢的COMT基因和CYP1A1基因为新疆地区PD患者的遗传学标记,分析其基因多态性在新疆地区同一研究对象中的分布特点,以探索两者的独立、联合作用与PD遗传易感性的关系。
1 对象与方法
1.1 研究对象 (1)PD组:2008年1月 ~2011年4月在新疆南、北疆收集的维吾尔族、汉族散发性PD患者,共237例。包括维吾尔族92例(男57例,女35例),年龄31~93岁,平均(65.30±10.23)岁;汉族145例(男89例,女56例),年龄31~90岁,平均(68.60±10.16)岁;均符合英国 PD协会脑库诊断标准[13]。(2)对照组:来自同一时期新疆南、北疆收集的非脑部器质性疾病,无锥体外系疾病史、无神经系统变性病、精神疾患及家族史,在性别、年龄、民族及文化上与PD组匹配的健康维吾尔族、汉族,共247例,包括维吾尔族104例(男60例,女 44例),年龄 33~99岁,平均(67.06±10.28)岁;汉族143例(男73例,女70例),年龄 35~89岁,平均(66.84 ±11.15)岁。两组性别、年龄分布无统计学差异。该项研究的所有受检者均签署知情同意书。
1.2 DNA制备 取受检者外周静脉血2 ml,EDTA抗凝,-40℃保存。使用天根生化科技公司血液基因组DNA提取试剂盒提取基因组DNA,-80℃保存。
1.3 COMT基因G1947A多态性分析 用上游引物:5’-TCGTGGACGCCGTGATTCAGG-3’,下游引物:5’-AGGTCTGACAACGGGTCAGGC-3’进 行PCR。PCR体积25μl,条件:94℃ 5 min,再94℃30 s,64 ℃ 30 s,72 ℃ 30 s,共28 个循环后,72 ℃ 5 min终止反应。扩增片段长度217bp(2%琼脂糖凝胶电泳验证)。取PCR产物10μl加入10 U NIaⅢ内切酶及其缓冲液内,于37℃水浴中反应1 h后,用8%聚丙烯酰胺凝胶电泳并在紫外灯下分析结果,可见基因型:野生型G/G(81、136bp两个片段),突变纯合型A/A(40、81、96bp 3个片段),突变杂合型 G/A(40、81、96、136bp 4 个片段)。
1.4 CYP 1A1基因Msp I多态性分析 用上游引物:5’-CAGTGAAGAGGTGTAGCCGCT-3’,下游引物:5’-TAGGAGTCTTGT CTCATGCCT-3’进行PCR。PCR体积25μl,条件:97℃ 7 min,再95℃50 s,60 ℃ 50 s,72 ℃ 1 min,共30 个循环后,72 ℃10 min终止反应。扩增片段长度340bp(2%琼脂糖凝胶电泳验证)。取PCR产物7μl加入10 U Msp I内切酶及其缓冲液内,于37℃水浴中反应1 h后,用8%聚丙烯酰胺凝胶电泳并在紫外灯下分析结果,可见基因型:野生型T/T(340bp 1个片段),突变纯合型C/C(200bp、140bp 2个片段),杂合型T/C(340bp、200bp、140bp 3 个片段)。
1.5 统计学方法 应用SPSS 13.0统计软件包进行数据处理。按共显性等位基因特性计算各组等位基因和基因型频率。吻合度检验Hardy-Weinberg(H-W)遗传平衡定律。χ2检验分析各组基因多态性分布的差异。通过比值比(OR)的计算,对PD与各基因多态进行关联分析,用χ2检验计算OR与1之间差异的显著水平,计算病因分数(attributable fraction,AF)和人群病因分数(attributable fraction of population,AFP)或预防分数(preventive fraction,PF)和人群预防分数(preventive fraction of population,PFP)。显著性水平 a=0.05。
2 结果
2.1 COMT基因G1947A多态性的分布比较
吻合度检验表明:PD组和对照组COMT基因基因型观察值和期望值检测均符合H-W遗传平衡(PD组:P=0.893;对照组:P=0.90)。χ2检验结果示:在总体样本中、维吾尔族、汉族、男性、女性、年龄≥60岁的PD组与对照组间PD组与对照组间COMT基因基因型频率、等位基因频率分布的,差异均无统计学意义(均P>0.05)(见表1)。
2.2 CYP 1A1基因Msp I多态性的分布比较
吻合度检验表明:PD组和对照组CYP 1A1基因基因型观察值与期望值检测均符合H-W平衡(PD组:P=0.988;对照组:P=0.211)。χ2检验结果示:在总体样本中、维吾尔族、汉族、男性、女性、年龄≥60岁的PD组与对照组间CYP 1A1基因基因型频率、等位基因频率分布的,差异均无统计学意义(均P >0.05)(见表2)。
2.3 COMT基因与CYP 1A1基因间的协同作用分析。
2.3.1 维吾尔族人群中,按 COMT基因 G/G基因型分组后,CYP 1A1基因多态性和PD的相关性分析χ2检验结果表明:在新疆维吾尔族人群中,携带COMT基因G/G基因型者,其CYP 1A1基因等位基因频率在PD组与对照组间的分布无统计学差异(P=0.123),基因型频率分布有统计学差异(P=0.020)。相关分析显示:COMT G/G基因型和CYP 1A1 T/T基因型的协同作用与新疆维吾尔族人群中 PD的发生存在正关联(OR=3.288,AF=0.696,AF P=0.426),即同时携带 COMT G/G 基因型和CYP 1A1 T/T基因型可使新疆维吾尔族个体发生PD的风险增加3.288倍,同时携带有COMT G/G基因型和CYP 1A1 T/T基因型的维吾尔族人群中有69.6% 患 PD,维吾尔族人群的 PD中有42.6% 同时携带有COMT G/G基因型和CYP 1A1 T/T基因型;而COMT G/G基因型和CYP 1A1 T/C基因型的协同作用与新疆维吾尔族人群中PD的发生存在负关联(OR=0.245,PF=0.755,PF P=0.472),即同时携带COMT G/G基因型和CYP 1A1 T/C基因型可使新疆维吾尔族个体PD的发生风险降低0.245倍(见表3)。
2.3.2 年龄≥60岁人群中,按COMT基因G/G基因型分组后,CYP 1A1基因多态性和PD的相关性分析χ2检验结果表明:在新疆年龄≥60岁人群中,携带COMT基因G/G基因型者,其CYP 1A1基因等位基因频率在PD组与对照组间的分布无统计学差异(P=0.585),基因型频率分布存在统计学差异(P=0.026)。相关分析显示:COMT G/G基因型和CYP 1A1 T/C基因型的协同作用与新疆地区年龄≥60岁人群中PD的发生存在负关联(OR=0.451,PF=0.549,PF P=0.350),即同时携带 COMT G/G 基因型和CYP 1A1 T/C基因型可使新疆地区年龄≥60岁个体PD的发生风险降低0.451倍(见表4)。
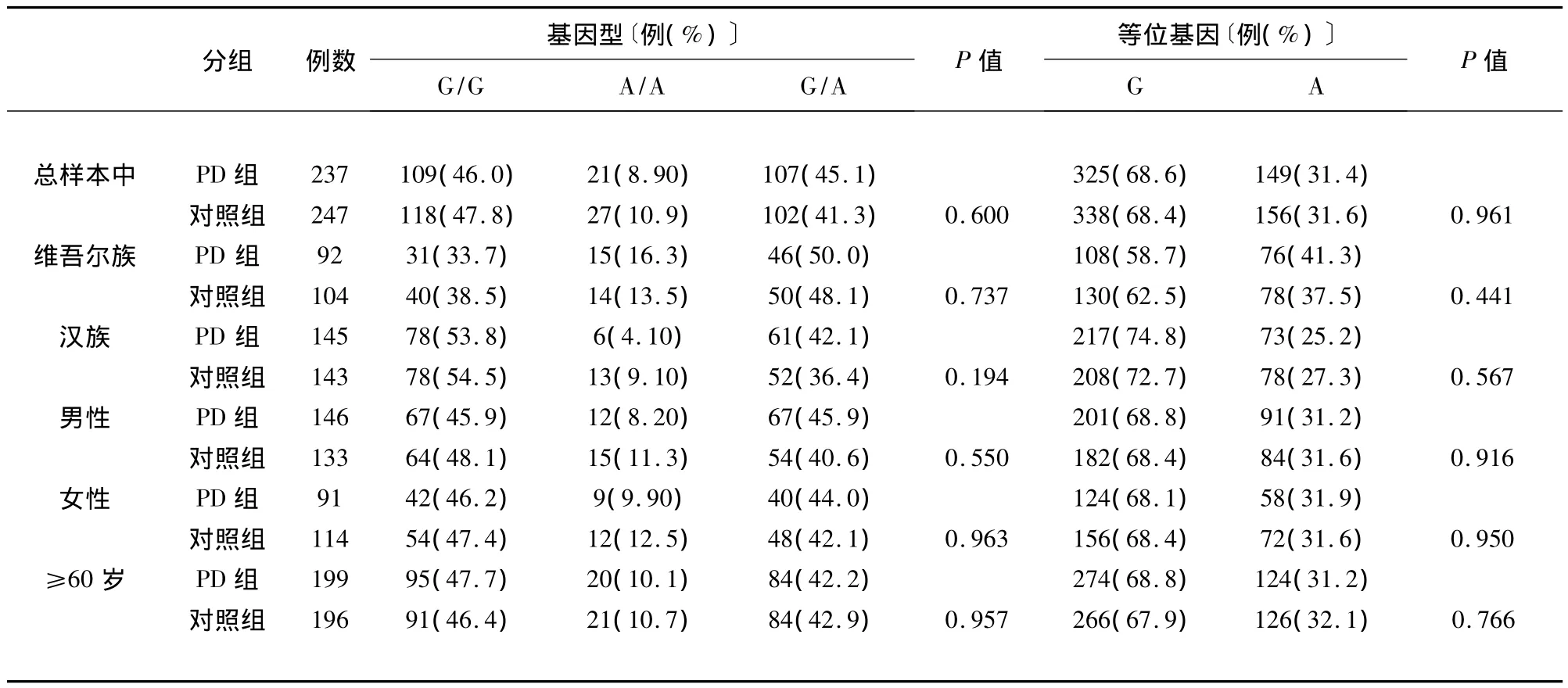
表1 COMT基因G1947A多态性的分布比较结果

表2 CYP 1A1基因Msp I多态性的分布比较结果
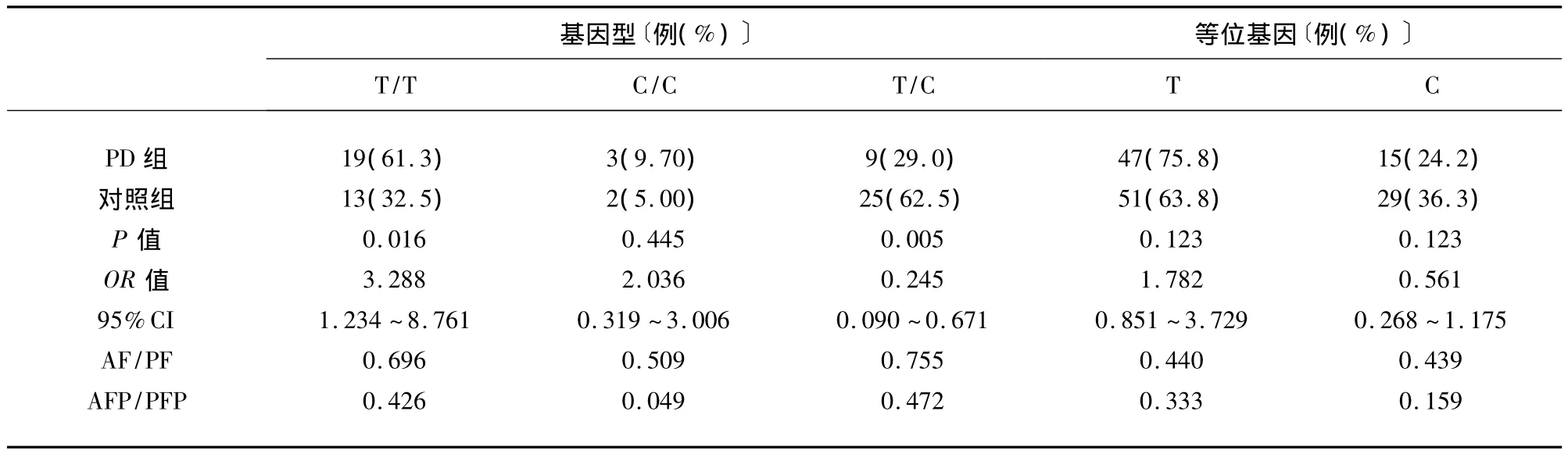
表3 维吾尔族人群中,按COMT基因G/G基因型分组后CYP 1A1基因多态性和PD的相关性分析
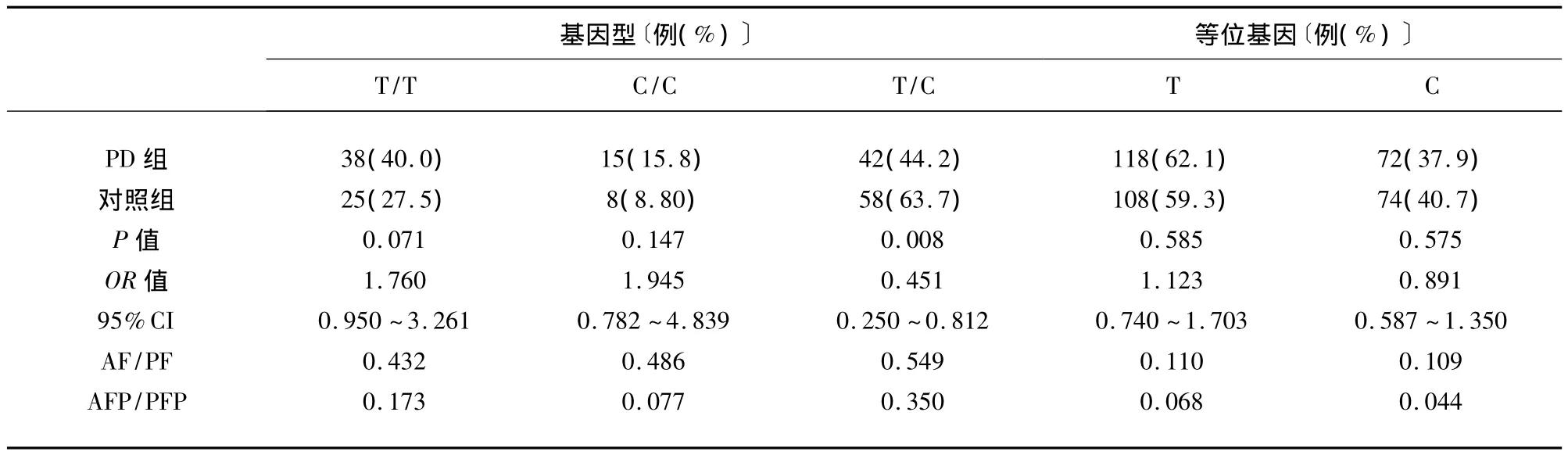
表4 在年龄≥60岁人群中,按COMT基因G/G基因型分组后,CYP 1A1基因多态性和PD的相关性分析
3 讨论
COMT基因第4外显子的第1947核苷酸存在G/A多态性造成氨基酸Val108 Met突变,该多态可改变COMT的活性,其中Val(G)的活性比Met(A)高3~4倍。不同活性的基因型对体内DA的代谢影响不同。Bishop等[14]发现人体内Val等位基因数量越多,其体内DA降解越快,而 Met等位基因则相反。Honea等[15]发现COMT基因Val等位基因者的整个脑容积较其他型有明显减少,并提示COMT基因多态性对脑灰质的影响可能与DA水平改变引起的神经毒性有关。同时,COMT酶选择性抑制剂在治疗PD中有益,提示COMT在PD的病理生理过程中可能发挥作用。我们的研究结果显示新疆地区COMT基因 G/A多态性与PD的危险性无关。Boudikova等[16]的研究发现女性红细胞和肝脏中COMT酶活性较男性低20% ~30%;而 Gulderberg等[17]报道从出生到成年,大鼠肝脏中COMT酶活性将增加10倍,提示性别、年龄对COMT酶活性有一定的影响,故我们进一步按照性别、年龄进行分组,发现无论是在男性人群、女性人群,还是在年龄≥60岁人群中,都不存在COMT基因G/A多态与PD相关。我们的研究结果与针对中国人群的徐玲等[18]和 Xie等[19]、针对芬兰人群的 Eerola J等[20]发现的COMT基因G/A多态与PD的遗传易感性不存在相关性的结论基本一致,而与针对中国人群的邵明等[4]和张莉等[5]、针对日本人群的 Yoritaka A 等[6]和Kunugi H等[7]的研究所发现的COMT G/A多态与PD的发生具有明确相关性的结论不同。
CYP1A1基因定位于15q22-q24,是细胞色素P450家族成员之一,是外源性化学物质在体内代谢的重要的一相酶之一,可催化多种外源性和内源性复合物降解。Morse等[21]研究发现在脑膜和脑室周围组织(如脉络膜丛、松果体等)有CYP1A1酶的分布,发挥其对渗入的外源性毒物的代谢和解毒作用。CYP1A1基因3’端多a信号下游第264个碱基T基换为C,形成 MspⅠ酶切位点。Takakubo等[8]对日本散发性PD患者的研究发现,C基因型的存在使PD的危险度提高了2.34倍。而我们的研究发现,其与新疆地区PD的易患性无关。CYP 1A1也是雌激素代谢相关酶,提示其活性受性别、年龄因素的影响,故我们进一步按照性别、年龄进行分组,发现无论是在男性人群、女性人群,还是在年龄≥60岁人群中,都不存在CYP1A1基因MspⅠ多态性与PD的相关。这与我国刘平等[22]的研究结论基本一致,而与王建等[9]的研究不同,其发现CYP1A1基因MspⅠ多态性与早发型PD的易感性相关。
PD的发生和发展是极其复杂的过程,它很可能是一种由多基因决定和受多种环境因素影响的疾病。已经有研究发现COMT基因多态性可能与单胺氧化酶 B(monoamine oxidase B,MAOB)基因[10]、多巴胺β羟化酶(dopamine beta hydroxylase,DBH)基因[11]多态性间的协同作用增加PD的发生危险,而CYP 1A1基因多态性也可通过与N-乙酰转移酶2(n-acetyltransferase 2 gene,NAT2)基因[12]多态性间的共同作用增加PD个体的易患性。本研究中,我们发现,当COMT基因、CYP 1A1基因单独作用时,其多态性均与PD的遗传易感性不相关。而当我们将二者综合起来分析时,发现COMT G/G基因型和CYP 1A1 T/T基因型间的协同作用可使新疆维吾尔族人群中PD的发生风险增加3.288倍,而COMT G/G基因型与CYP 1A1 T/C基因型间的协同作用可分别使新疆维吾尔族人群中、年龄≥60岁人群中PD的发生风险下降0.245倍和0.451倍。我们并不能解释我们的研究结果,最主要的原因可能是PD是多位点基因及环境因素相互作用的结果,一种基因或者两种基因的联合作用并不能完全决定PD的发生发展,另一原因是不同民族PD的易感基因不同。
PD的病因复杂,至今尚没有一种理论能够解释其病因,通过多种相邻位点的基因或作用相关蛋白的编码基因的联合分析,才能找到疾病发生的关键所在。酶的活性并不完全取决于基因结构,基因转录调控和底物对酶的诱导活性都将对其产生一定的影响,因此,某一基因突变的存在以及多个基因之间的相互作用,都可能影响疾病的发生和发展进程。我们的结果从另一个侧面阐明了PD的遗传异质性和病因的复杂性。深入探讨相关基因多态性、相关基因-环境因素的联合检测,提高个体PD易患性的预测水平,这些都还须进一步研究。
[1]陈 彪.决定帕金森病易感性的遗传因素[J].中华神经科杂志,1997,30:315-317.
[2]Dfivila R,Zumfixraga M,Basterreche N,et al.Influence of the catechol-O-methyltransferase Vall08/158Met polymorphism on the plasma concentration of catecholamine metabolites and on clinical features in type Ibipolar disorder-a preliminary report[J].JAffect Disord,2006,92:277-281.
[3]Palma PN,Rodrigues ML,Archer M,et al.Comparative study of orthoand meta-nitrated inhibitors of catechol-O-methyltransferase:interactions with the active site and regioselectivity of O-methylation[J].Mol Pharmacol,2006,70:143-153.
[4]邵 明,刘焯霖,陶恩祥,等.儿茶酚氧位甲基转移酶基因多态性与帕金森病遗传易感性的关系探讨[J].中华神经科杂志,2000,33:17-19.
[5]张 莉,邵 明,徐群渊,等.多巴胺突触前膜转运载体基因多态性与帕金森病[J].中华医学遗传学杂志,2001,18:431-434.
[6]Yoritaka A,Hattori N,Yoshino H,et al.Catechol-O-methyltransferase genotype and susceptibility to Parkinson’s disease in Japan.Short communication[J].J Neural Transm,1997,104:1313-1317.
[7]Kunugi H,Nanko S,Ueki A,et al.High and low activity alleles of catechol-O-methyltransferase gene:ethnic difference and possible association with Parkinson’s disease[J].Neurosci Lett,1997,221:202-204.
[8]Takakubo F,Yamamoto M,Ogawa N,et al.Genetic association between cytochrome P450 1A1 gene and susceptibility to Parkinson’s disease[J].JNeural Transm Gen Sect,1996,103:843-849.
[9]王 建,刘焯霖,陈 彪,等.细胞色素P450酶基因多志性与帕金森的关系[J].中华医学杂志,2000,80:585.
[10]Biaecka M,Drodzik M,Honczarenko K,et al.Catechol-O-Methyltransferase and monoamine oxidase B genes and susceptibility to sporadic Parkinson’s disease in a Polish population[J].Eur Neurol,2005,53:68-73 .
[11]赵晓萍,徐 涛,张薇薇,等.帕金森病遗传易感性与儿茶酚胺氧位甲基转移酶和多巴胺β羟化酶基因多态协同作用的关系[J].中国临床康复,2005,9:45-47.
[12]刘 平,刘焯霖,杨静芳,等.早发性帕金森病与细胞色素P4501A1和N-乙酰基转移酶2基因多态性及个体易感危险性[J].中国临床康复,2004,4:621-623.
[13]Hughes AJ,Daniel SE,Kilford L,et al.Accuracy of clinical diagnosis of idiopathic Parkinson's disease:a clinic-pathological study of 100 cases[J].J Neurol Neurosurg Psychiatry,1992,55:181-184.
[14]Bishop SJ,Fossella J,Croucher CJ,et al.COMTval158met gene type affects recruitment of neural mechanisms supporting fluid intelligence[J].Cerebral Cortex,2008,18:2132-2140.
[15]Honea R,Verchinski BA,Pezawas L,et al.Impact of interacting functional variants in COMT on regional gray matter volume in human brain[J].NeuroImage,2009,45:44-511.
[16]Boudikova B,Szumlanski C,Mehdak B,et al.Human liver catechol-O-methyltransferase pharmacogenetics[J].Clin Pharmacol Ther,1990,48:381-389.
[17]Gulderberg HC,Marsden CA.Catechol-O-methyltransferase:pharmacological aspects and physiological role[J].Pharmacol Rev,1975,27:135-206.
[18]徐 玲,郝怡鑫,谢惠君,等.上海地区汉族人群儿茶酚氧位甲基转移酶基因G/A多态性与帕金森病的相关性研究[J].中华医学遗传学杂志,2002,19:440-441.
[19]Xie J,Ho SL,Li LS,et al.G/A1947 polymorphism in catechol-O-methyltransferase(COMT)gene in Parkinson’s disease[J].Mov Disord,1997,12:426-427.
[20]Eerola J,Launes J,Hellstrom O,et al.Apolipoprotein E(APOE),PARKIN and catechol-O-methyltransferase(COMT)genes and susceptibility to sporadic Parkinson’s disease in Finland[J].Neurosci Lett,2002,330:296-298.
[21]Morse D,Stein AP,Thomas PE,et al.Distribution and induction of cytochrome P450 1A1 and 1A2 in rat brain[J].Toxicol Appl Pharmacol,1998,152:232-239.
[22]刘 平,刘振华,邵 明,等.中国北方汉族人细胞色素P4501A1基因多态性与早发性帕金森病关系的研究[J].中华医学遗传学杂志,2001,18(4):283.
