慢性酒精中毒对清醒大鼠相关脑区部分氨基酸含量变化的影响
2014-11-17郑雪梅许银花金东春崔松彪
郑雪梅, 许银花, 金东春, 崔松彪, 吴 光
酒精的主要成分为乙醇,为亲神经物质,是目前最常见的神经毒性药物。乙醇摄入体内后分布于所有的组织和体液中,对其可产生多方面的破坏作用。对乙醇成瘾是酒精中毒的一个主要特征,长期反复饮酒可产生慢性中毒。
本实验采用慢性酒精中毒大鼠自由饮模型,利用高效液相色谱法及脑内微透析采样技术在大鼠清醒状态下测定慢性酒精中毒时苍白球腹侧核和中脑腹侧被盖区细胞外液中部分氨基酸类神经递质的含量,观察慢性酒精中毒时苍白球腹侧核和中脑腹侧被盖区氨基酸含量变化的影响。
1 材料与方法
1.1 动物模型制备 实验选用成年Wistar雄性大鼠40只,体质量(370±30)g,随机分成对照组、6%酒精组、8%酒精组、12%酒精组,每组各10只,由延边大学医学部实验动物科提供。模型组大鼠单笼饲养,连续自由饮含低浓度乙醇(6%、8%、12%)的水溶液4 m,建立慢性酒精中毒动物模型。适应阶段,按酒精浓度从低到高,经过7 d达到设计酒精浓度:6%酒精组每2 d递增1.5%(1.5%→3%→4.5%→6%),以后维持在6%的水平至造模结束;8%酒精组每2d递增2%(2%→4%→6%→8%),以后维持在8%的水平至造模结束;12%酒精组每2 d递增3%(3%→6%→9%→12%),以后维持在12%的水平至造模结束。模型组以含各浓度乙醇的水溶液作为大鼠唯一饮水来源,24 h自由饮,任意进食。造模期间大鼠死亡率为0%,对照组大鼠皮毛光泽,行动灵活,食量及大便正常,模型组大鼠在造模期间出现行动迟缓、睡眠多、情绪不稳等症状,进食量少于对照组,体质量增长较对照组缓慢,12%酒精组的变化尤为显著。
1.2 手术方法 大鼠称重,用10%水合氯醛(300 mg/kg)腹腔麻醉,俯卧位固定于大鼠立体脑定位仪上,大鼠牙槽低于耳内切线3.3 mm。参照Bliss[1]等的方法进行脑部定位。根据 Paxinos和Watson[2]图谱,将透析探针套管插入到苍白球腹侧核(VP)(前囟后0.26 mm,旁开2.5 mm,颅骨下8.4 mm)、中脑腹侧被盖区(VTA)(前囟后6.04 mm,旁开0.5 mm,颅骨下8.7 mm)。术后,待动物状态恢复正常时,将透析导管(作用透析膜1.0 mm)插入透析套管内,待收集灌流液。
1.3 脑部微量透析及样本收集 动物术后当天微量透析探针连接微量泵,以1.5μl/min速度向大鼠VP区灌流Ringer’s液,稳定30 min,同时经样本收集器连续收集样本3管,每管收集10 min,收集量为15μl。随后收集VP区样本,并使用相同方法收集VTA区样本,再次收集灌流液3管,-80℃冰箱中冷冻保存,以备进行氨基酸含量的分析。
1.4 氨基酸含量分析方法 参照Jin等方法[3]配制衍生剂1溶液和衍生剂2溶液。取收集好的样本12μl和4 mmol/L的OPA溶液在室温下反应2.5 min,抽取反应液10μl,注入到生物活性物质微量分析系统(日本Eicom公司产)。以0.5 ml/min速度通过高效液相分离柱(SC-50DS)和电化学检测器(ECD-300)测定样本中氨基酸的含量。每次样本分析均以稀释的氨基酸标准液(2 ml)作为基础。
1.5 统计学方法 数据以均值±标准差(χ±s)表示,用SPSS11.5统计软件包进行了t检验,P<0.05有统计学意义。
2 结果
2.1 慢性酒精中毒对大鼠VP区氨基酸的影响 与正常组相比,6%酒精组大鼠细胞外液Gly、Tau、Ala含量增高(P<0.05);12%酒精组大鼠细胞外液Gln、Asp含量明显减少(P<0.01)(见表1)。
2.2 慢性酒精中毒对大鼠VTA区的氨基酸的影响 与正常组相比,6%酒精组大鼠细胞外液Asp含量明显增高(P<0.01);12%和8%酒精组大鼠细胞外液 Asp、Glu、Ala、Gly、Gln 含量均增高,而 Tau含量在VTA区无明显变化(见表2)。

表1 VP区氨基酸的变化(χ ± s,n=10)
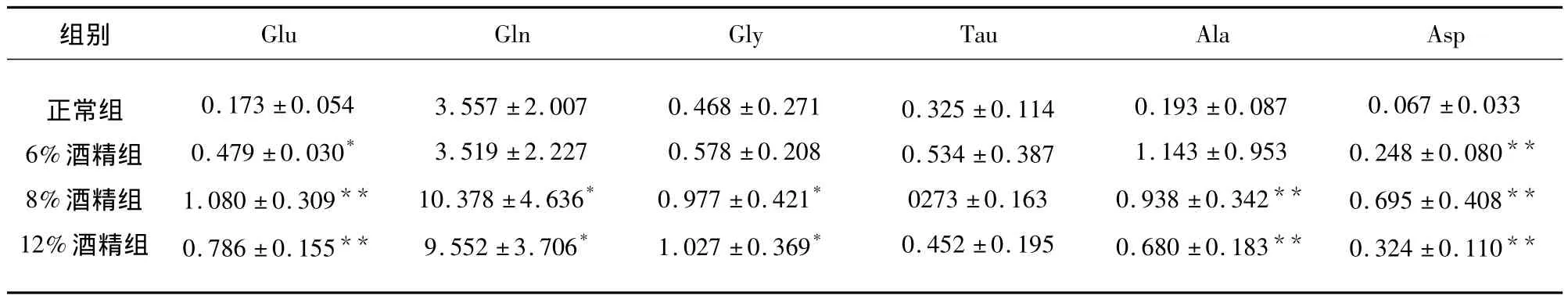
表2 VTA区氨基酸的变化(χ ± s,n=10)
3 讨论
中脑-边缘系统多巴胺神经元与乙醇依赖的关系极为密切,多巴胺参与奖赏和增强等神经机制,乙醇则优先增强脑区多巴胺释放[4]。现在更多的研究发现该神经通路还与成瘾渴求和复发有关。VTA多巴胺神经元投射到边缘系统有关脑区的通路,成为中脑-边缘多巴胺系统,中脑-边缘系统中多巴胺奖赏回路中主要组成部分中一些神经元可投射到苍白球(VP)或通过VP投射到其它脑区[5],故本实验测定清醒自由状态下的慢性酒精中毒大鼠VP区及VTA区细胞外液中的部分氨基酸类神经递质含量的变化。
既往研究神经递质的变化多采用离体匀浆法分析,测定出来的是一种静态的、混杂的结果,它代表细胞内和细胞外的物质含量总和。但目前多利用比较先进的对神经细胞间隙(细胞外液)进行动态检测来测定神经递质含量的变化,即脑内微透析取样技术。所谓脑内微透析取样技术是一种连续灌注并采集活体动物特定脑区内灌流液的新方法,其优点是透析液中不含有大分子物质,如蛋白质、酶等等,取样无需匀浆,避免了复杂的采样前处理过程,可真实代表取样位点目标化合物的浓度;并且对脑组织的损伤非常轻微,因此广泛应用于定量分析大脑细胞外液中的各种神经递质的浓度变化[6],微透析取样技术和微量化学分析技术结合可精确测定动物在清醒状态下的特定脑区的神经递质浓度变化情况。
神经元之间的信息交流主要是通过化学传递来完成,中枢神经系统内大部分信息交流是以神经递质释放、与受体结合而引发生理效应的方式来进行。氨基酸是中枢神经系统数量最多、分布最广的神经递质,它们不仅具有代谢作用,还作为神经递质对维持正常的脑功能起着重要作用,根据作用可分为两大类,即兴奋性氨基酸递质,如谷氨酸、天冬氨酸;抑制性氨基酸递质,为甘氨酸、谷氨酰胺、丙氨酸、牛磺酸等等。近年来通过很多研究发现,脑缺血时细胞外液兴奋性和抑制性氨基酸递质均增高。兴奋性氨基酸是一种神经毒素,在细胞外液堆积产生兴奋毒性作用,脑缺血时抑制性氨基酸递质释放也反应性上升以维持兴奋性和抑制性氨基酸递质的动态平衡[7],以此对抗兴奋性氨基酸的毒性作用。本实验研究结果显示,长期低浓度给予酒精时,VTA区兴奋性氨基酸和抑制性氨基酸均增高,如12%和8%酒精组大鼠细胞外液 Asp、Glu、Ala、Gly、Gln含量均增高,故我们可推测慢性酒精中毒时大鼠VTA区中有两类不同氨基酸神经递质共同参与,这一结果与许银花[8]等研究的急性酒精中毒时大鼠海马 DG区Asp、Glu和Gly含量增加的结果类似,但6%酒精组仅使兴奋性氨基酸如Asp、Glu含量增高,这可能与大鼠饮酒量、饮酒时间及饮酒浓度有关。VP区6%酒精组大鼠细胞外液 Gly、Tau、Ala含量增高;而12%酒精组大鼠细胞外液Asp、Gln含量明显减少,这可能破坏了氨基酸的动态平衡,Faigold等研究证实长期反复饮酒可导致脑内兴奋性氨基酸和抑制性氨基酸的失衡[9],故对机体产生不良影响。
综上所述,慢性酒精中毒与苍白球腹侧核区Gly、Tau、Ala含量增加有关;与苍白球腹侧核区Gln、Asp含量减少有关;并且与中脑腹侧被盖区Asp、Glu、Ala、Gly、Gln含量增加有关。本实验应用慢性酒精中毒大鼠自由饮模型,选用了与多巴胺能神经元功能关系密切的VP及VTA区,研究长期饮酒后脑内部分氨基酸类神经递质含量变化,为临床预防乙醇对人体的损害提供理论依据和实验基础。
[1]Bliss TV,Lomo T.Longlasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path[J].JPhysiol,1973,232(2):331-356.
[2]Paxinos G,Waston C.The rat brain in stereotaxic coordinates[M].New York:Academic Press,1986.60-69.
[3]Jin QH,Ueda Y,Ishizuka Y,et al.Cardiovascular changes induced ba central hypertonic saline are acconmpanied by glutamate elease in aweke rats[J].Am J Physiol Regul Integr Comp Physiol,2001,281(4):1224-1231.
[4]Blandina P,Goldfarb J,Craddock-Royal B,et al.Release of endogenous dopamine by stimulation of 5-hydro-xytryptamine 3 recepters in rat striatum[J].JPharmacol Exp Ther,1989,251:803-809.
[5]王惠玲,赵 晏.阿片类药物依赖与中脑-边缘多巴胺系统回路[J].中国药物依赖性杂志,2003,12(1):2-5.
[6]李范珠,冯 健.脑微透析技术及其在脑内药动学中的应用[J].中国药学杂志,2006,41:405-407.
[7]Xu XH,Zheng XX,Zhou Q,et al.Inhibition of excitatory amino acid efflux contributes to protective effects of puerarin against cerebral ischemia in rats[J].Biomed Environ Sci,2007,20(4):336-342.
[8]许银花,崔松彪,吴 光,等.急性酒精中毒对清醒大鼠海马DG区部分氨基酸递质含量的影响[J].中风与神经疾病杂志,2009,26(4):464-466.
[9]Faigold CL,Gouemo NP,Riaz A.Ethanol and neurotrans mitter interactions-from molecular to integrative effects[J].Prog Neurobiol,1998,55:509-535.
