P38MAPK、Nox1及ROSmRNA在早发型重度子痫前期患者胎盘组织中的表达及意义
2014-11-12刘国成袁晓兰赵莉娜袁嘉莹
刘国成 袁晓兰 赵莉娜 袁嘉莹
普遍认为早发型重度子痫前期母亲患病率是晚发型的2倍,围产儿患病率是晚发型的4倍。其特点是发病早、病情重,常伴有严重的母体并发症,导致严重不良妊娠结局。研究发现早发型重度子痫前期存在胎盘形态学异常,而晚发型胎盘形态学无明显变化,认为早发型重度子痫前期为胎盘病[1]。其真正病因和发病机制至今仍不清楚,脂质氧化和过氧化代谢异常是目前探究的热点。本研究应用RT-PCR及免疫组化方法检测胎盘组织中Nox1、P38MAPK、ROSmPNA表达水平,旨在探讨脂质代谢在早发型重度子痫前期发病机制中的作用。
1 材料与方法
1.1 研究对象
选择我院2010年9月~2012年10月住院分娩的患者。研究组中早发型﹤32周重度子痫前期32例,孕周27~32周,平均孕周(30.7±0.2)周,晚发型重度子痫前期患者30例,孕周33~37周,平均孕周(35.6±0.4)周;随机选择同期分娩的正常孕妇35例作为对照组,平均年龄(27.9±8.2)岁,平均孕周(38.7±0.6)周,重度子痫前期的诊断标准参考《妇产科学》(7版)[2]。研究组及对照组年龄及孕龄无显著差异(p>0.05),研究组均以剖宫产分娩,均无原发性高血压、心脏病、糖尿病及肝肾并发症,无其他妊娠合并症。
1.2 试验方法
1.2.1 标本制备 胎盘娩出后,无菌剪取胎盘脐带根部附着区母体面中央1.0 cm×1.0 cm×0.6 cm大小无钙化、无出血坏死的胎盘组织两块,一份用无菌生理盐水(含0.1%DEPC水)漂洗,去除血液,置于经DEPC水处理并消毒的冻存管中,于-80℃冰箱保存待行RT-PCR检测;另一份取材后即以4%多聚甲醛固定,常规脱水,浸蜡,包埋,4um切片(每例5张),载玻片经清洁处理,APES包被待测。
1.2.2 HE染色 ①切片经二甲苯脱蜡,8 min×2次,酒精梯度为100%、95%、80%、75% 脱蜡各4 min,0.01 mol/L PBS漂洗6 min×3次;②伊红染色5 min,蒸馏水冲洗5 min;③苏木素复染5 min,蒸馏水冲洗3 min;④1%盐酸酒精分化30 s;⑤酒精梯度75%、80%、95%、100%脱水各4 min,二甲苯透明8 min×2次,晾干,中性树胶封片。
1.2.3 免疫组织化学 链霉素亲和生物素-过氧化物酶法(SP法),严格按照试剂盒说明操作。SP试剂盒购置XX生物工程有限公司。
1.2.4 结果分析 以PBS为阴性对照,细胞膜或细胞浆内出现棕黄色颗粒为阳性,无着色或与背景一致为阴性;采用自动医学彩色图像分析系统进行图像分析,每张切片随机选择3个高倍镜视野,分别计算扫描面积及平均光密度,平均光密度值代表阳性表达强度。
1.2.5 RT-PCR 引物购置上海生物工程技术服务有限公司。从Genebank中获取Nox1、P38MAPK、ROS的基因序列,设计引为为:上游 5'-CCAGTGTGTGAGGGGAGCA-3';下游5'-TCCAGAGATGAGTGGCTTTTGA -3';上游5'-GCCAGAAGGTCCCAAACAAC-3';下游5'-CAGCCAGCAGATAGCAAATGTC-3';内参GAPDH的引物为:上游 5'-GAAGGTGAAGGTCGGAGT-3';下游 5'-GAAGATGGTGATGGGATTTC-3'。步骤为①总 RNA提取,按照说明书进行,②总RNA测定 取2 μl RNA加入198 μl DEPC水中稀释混匀,分别置于紫外分光光度计波长260 nm和280 nm处测量OD260/OD280比值及OD260值。空白对照为200 μl DEPC的水。RNA浓度=OD260×40×100/1 000=OD 260×4(μg/ml)。依照说明书进行逆转录合成cDNA。循环反应为:95℃预变性5 min,反应条件为:95℃变性30 s,退火30 s,72℃延伸30 s,循环 35次,72℃充分延伸7 min。以目的基因PCR扩增片段灰度与相应内参扩增片段灰度的比值作为其mRNA表达水平的参数。
1.3 统计学方法
应用SPSS11.5软件进行统计学处理,两组间比较采用t检验,多组比较用方差分析,指标间相关性用Spearman等级相关检验,p<0.05为差异有统计学意义。
2 结果
2.1 孕妇胎盘组织Nox1、P38MAPK、ROS表达水平
见图 1。由图 1可以看见重度子痫前期 Nox1、P38MAPK、ROS阳性表达。免疫化学检测:A为重度子痫前期组Nox1阳性染色,B为正常组Nox1、P38MAPK、ROS染色,C为重度子痫前期组P38MAPK阳性染色,D为重度子痫前期ROS阳性染色。(均为×400视野)。

图1 孕妇胎盘组织Nox1、P38MAPK、ROS表达水平
2.2 孕妇胎盘组织Nox1、P38MAPK表达水平
见表1。由表1可以看出,早发型及晚发型患者胎盘组织中Nox1、P38MAPK表达水平均明显高于正常孕组,而且早发型重度子痫前期组Nox1、P38MAPK表达水平显著高于晚发型重度子痫前期组,p<0.05。
2.3 孕妇胎盘组织Nox1、ROS表达水平
见表2。由表2可以看出,早发型及晚发型患者胎盘组织中Nox1、ROS表达水平均明显高于正常孕组,而且早发型重度子痫前期组Nox1、ROS表达水平显著高于晚发型重度子痫前期组,p<0.05。
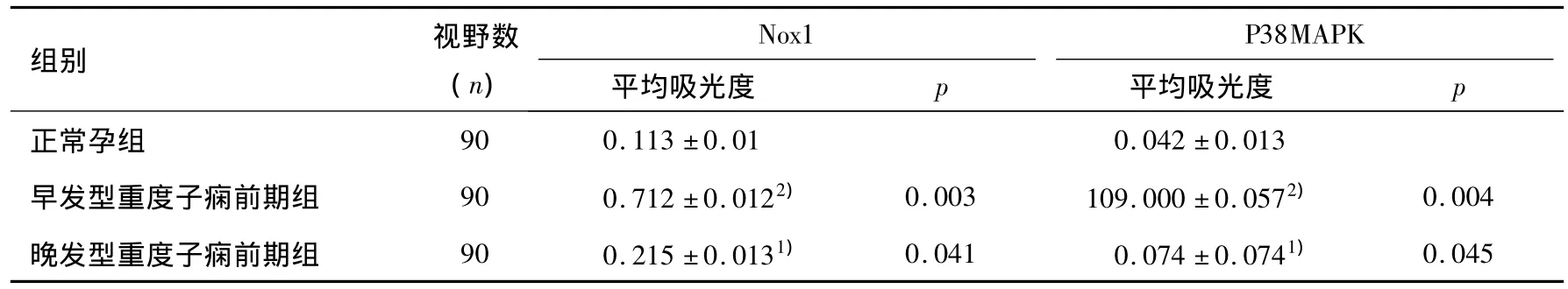
表1 各组孕妇胎盘组织中Nox1、P38MAPK水平比较
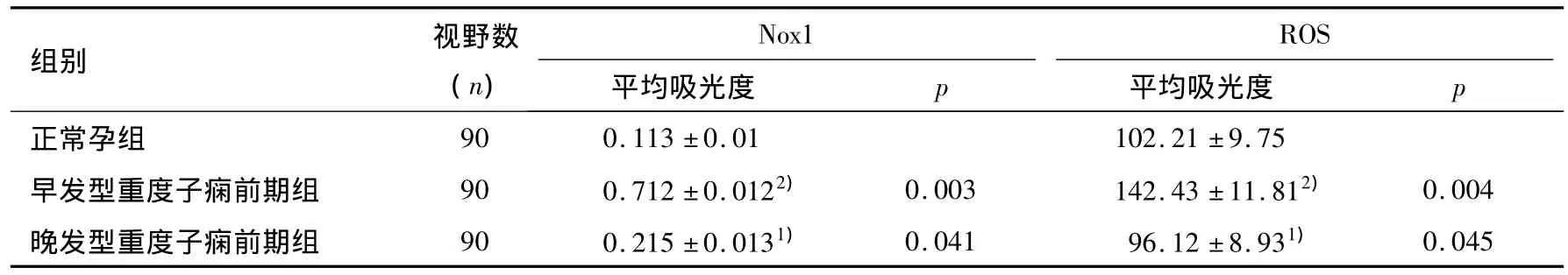
表2 各组孕妇胎盘组织中Nox1、ROS水平比较
3 讨论
子痫前期是妊娠期特发的全身性疾病,迄今为止仍是我国孕产妇及围产儿死亡的重要原因之一。目前认为,脂质代谢异常导致血管内皮细胞损伤是其发生的关键环节,但其机制目前仍未完全阐明。p38 MAPK作为丝氨酸/苏氨酸激酶家族的成员之一,在胎盘组织中有广泛表达,未活化时位于细胞质中,其丝氨酸/苏氨酸残基可被磷酸化而激活并迅速转运至核内,作用于相应靶点。研究证实在子痫前期发生过程中,有些氧化应激产物可以激活p38MAPK的磷酸化,导致内皮细胞功能紊乱及全身炎症反应[3]。有学者发现子痫前期合并溶血、肝酶升高、血小板降低(HELLP)综合征患者的胎盘组织存在明显的p38MAPK的活化[4]。本资料显示,研究组胎盘组织中滋养细胞增生细胞、合体结节细胞、纤维素样坏死细胞均明显高于正常孕者,而且早发型重度子痫前期组显著高于晚发型重度子痫前期组;研究组胎盘组织中Nox1、P38MAPK表达水平均明显高于对照组。提示,P38MAPK在早发型重度子痫前期发病中起着重要作用,推测P38MAPK在早发型重度子痫前期脂质代谢异常及血管内皮细胞损伤途径中扮演关键角色。
目前研究发现NADPH氧化酶家族包括Nox1、Nox2、Nox3、Nox4 和 Nox5 和二元氧化酶(dualoxidase,Duox)。Nox1主要分布在人类的结肠、前列腺、子宫、胎盘、血管平滑肌细胞、成纤维细胞等组织和细胞中[5]。动物实验证实Nox1参与血管生长、重塑,在高血压和动脉粥样硬化等血管性疾病发生中发挥重要作用,并且此作用受P38MAPK因子调节[6]。本资料显示Nox1蛋白主要表达于合体滋养细胞、血管内皮细胞、蜕膜细胞的细胞浆内,且早发型重度子痫前期患者Nox1及ROS表达水平显著高于晚发型组,而且二者具有正相关性。活性氧簇作为氧化应激的中心环节,类似于第二信使的信号分子,激活许多氧化还原敏感性信号通路,ROS是调节血管结构和功能状态的重要信号分子,血管内皮细胞、平滑肌细胞和动脉外膜细胞等均可产生ROS,ROS过多与炎性反应、动脉粥样硬化、糖尿病、高血压和肿瘤的发生密切相关[7]。有研究认为妊娠早期ROS表达异常,可导致胎盘病理改变,与子痫前期发展相关。本研究证实早发型重度子痫前期组胎盘组织中ROS表达显著高于晚发型组及对照组,ROS表达增加与Nox1表达呈正相关,说明由P38MAPK介导的P38MAPK-Nox1-ROS途径可能在早发型重度子痫前期的发病机制中起重要作用。也提示Nox1在早发型重度子痫前期脂质代谢中起重要作用,可能是早发型重度子痫前期发病的预测指标,有待于进一步研究。
近年研究发现早发型重度子痫前期与晚发型重度子痫前期不仅是发病时间上存在差异,在发病机制、临床靶器官损害、临床治疗及预后等方面都有明显不同[8]。人体蜕膜组织是母胎界面重要组成部分,与胎儿滋养层直接接触,有参与母胎免疫耐受形成及维持妊娠的功能。本组资料证实,早发型重度子痫前期组胎盘组织中 Nox1、ROS、P38MAPK均呈高表达状态,而且有些发生在临床症状出现前,进一步说明早发型重度子痫前期的发生与发展与脂质代谢异常密不可分。
[1]YONG H Y,KIM IY,KIM J S,et al.ErbB2 - enhanced invasiveness of H-Ras MCF1OA breast cells requires MMP-13 and uPA upregulation via p38MAPK signaling[J].Int J Oncol,2010,36:501-507.
[2]乐 杰.妇产科学[M].7版.北京:人民卫生出版社,2008:92-99.
[3]MORISSETTE M,AL SWEIDI S,CALLIER S,et al.Estrogen and SERM neur oprotection in animal model of Parkinson's disease[J].Mol Cell Endocrinol,2008,290(1 -2):60 -69.
[4]CORRADETTI A,SACCUCCI F,EMANUELLI M,et a1.The role of p38alpha mitogen-activated protein kinase gene in the HELLP syndrome[J].Cell Stress Chaperones,2010,15:95 -100.
[5]ROLANDL,GAGNE A,BE1ANGER M C,et al.Existence of compensatory efense mechanisms against oxidative stress and hypertension in preeclampsia[J].Hypertens Pregnancy,2010,29:21 - 37.
[6]IONGY,LIEBERMANN D A,TRONT J S,et al.GADD45 alpha in stress Signaling regulates sFh - 1 expression in preeclampsia[J].Jcell Physiol,2009,220:632 -639.
[7]CINDROVA DAVIES T.Gabor Than Award Lecture 2008:pre -eclampsia-from placental oxidative stress to maternal endothelial dysfunction[J].Placenta,2009,30:55 -65.
[8]KIM E K,CHOI E J.Pathological roles of MAPK signaling pathways in human diseases.Bioehim Biophys Acta[J].2010,1802:396-405.
