553例次异基因造血干细胞移植受者全血环孢素浓度监测结果分析
2014-11-08张善堂唐丽琴苏汉中
邱 蕾,张善堂,唐丽琴,童 彤,苏汉中
(1.安徽中医药大学药学院,安徽合肥 230031;2.安徽省立医院药剂科,安徽合肥 230001)
造血干细胞移植(hematopoietic stem cell transplantation,HSCT)是治疗血液系统恶性疾病、骨髓衰竭和一些遗传性疾病的有效方法,移植物抗宿主病(graft-versus-host disease,GVHD)及同种异体排斥反应作为重要的并发症,显著影响着HSCT移植的成功率。环孢素A(Cyclosporine A,CsA)作为一种强效免疫抑制剂,广泛应用于心、肝、肾等各种器官移植,使器官移植的成功率大大提高[1]。CsA单独使用或与其他免疫抑制剂联用也已成为国内外预防异基因造血干细胞移植GVHD、确保移植物植入的常规方案[2]。CsA为脂溶性药物,分子量大,其吸收主要受胆汁、食物和食物中脂肪含量的影响,体内药动学过程个体差异大,血药浓度不稳定[3],而CsA血药浓度与临床疗效密切相关,若浓度过低,将达不到预防GVHD的作用,可能导致排斥反应的发生,造成移植失败的严重后果;若浓度过高,则有可能产生肝毒性、肾毒性、神经系统毒性等不良反应。因此,临床使用中面临的主要问题是如何确定一个合适的给药剂量,产生最佳免疫抑制的同时又不出现中毒[4]。为此,CsA血药浓度监测在肝、肾移植术后抗排异反应中已经广泛开展,临床医生在药物的用法用量方面也积累了丰富的经验,全血中CsA谷浓度(C0)和服药后2 h血药浓度(C2)的最佳范围也已达成了一定的共识,而allo-HSCT术后CsA治疗的目标血药浓度能否沿用其他实体器官移植的结果尚有待进一步探讨。本文通过对本院进行allo-HSCT的79例患者553次CsA血药浓度监测资料进行初步分析,旨在探讨CsA的最佳谷浓度,为临床用药提供依据,并进一步明确治疗药物监测对于CsA合理应用的临床意义。
1 资料与方法
1.1 临床资料 2007年1月—2009年12月在本院进行造血干细胞移植术的患者79例,其中男性52例,女性27例,年龄3~62岁,平均年龄23.4岁。原发病分类见表1。
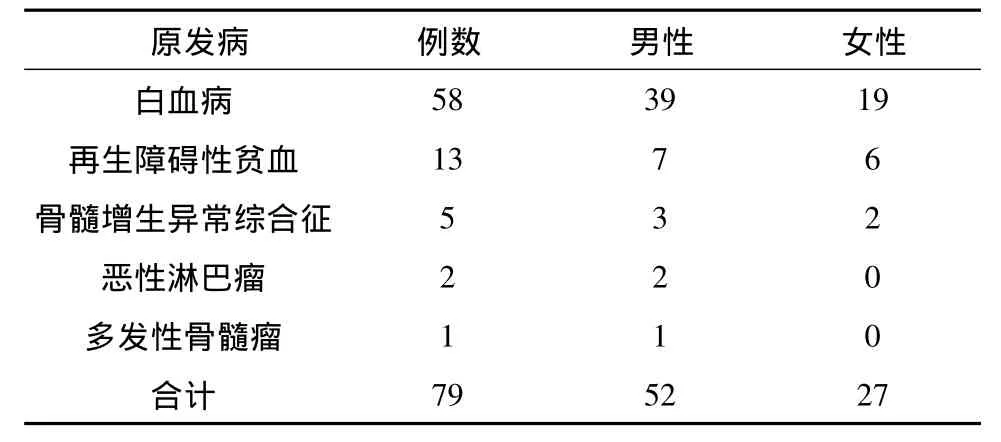
表1 研究对象的原发病分类/例
预处理方案包括:(1)环磷酰胺(CTX)50 mg·d-1,共4 d,抗胸腺细胞球蛋白(ATG)20 mg·kg-1,共3 d,12例;(2)羟基脲(HU)40 mg·kg-1每天 2次,阿糖胞苷(Ara-c)2 g·m-2共1次,白消安1 mg·kg-1,口服,每天4次,共4 d,环磷酰胺(CTX)60 mg·kg-1·d-1×2 d,有45 例;(3)全身照射(TBI)300 Gy,每天2次,共2 d。环磷酰胺(CTX)60 mg·kg-1·d-1×2 d,阿糖胞苷(Ara-c)2 g·m-2共 2 d,有22例。
免疫抑制剂方案为CsA+霉酚酸酯(MMF),具体为:CsA 3 mg·kg-1·d-1,静滴,-1 d ~ +30 d,+30 d后改为口服;MMF 15~20 mg·kg-1·d-1,+1 d~ +20 d,口服。
1.2 CsA血药浓度测定 患者使用CsA 3 d后,常规监测血药浓度,每周监测一次。静脉24 h恒速给药者,取样时间不限;口服给药者,于服药前10 min内取外周静脉血约1 mL,置肝素于抗凝管中,充分混匀,立即送检,监测CsA谷浓度,所取血样当天完成检测。CsA全血浓度测定采用荧光偏振免疫法进行(AxSYM全自动免疫分析仪及CsA全血试剂盒均为美国雅培公司产品)。
1.3 急性GVHD分级及肝肾毒性指征 急性GVHD分级参照西雅图会议制定的标准[5]。肝脏毒性指征为术前肝功能正常,服用CsA后出现胆红素和转氨酶升高,经减药和对症治疗后,肝功能恢复正常;肾毒性指征为尿量减少,血尿素氮(BUN)、血清肌酐(Cr)升高,经减药或停药并给予治疗后,肾功能亦恢复正常。
2 结果
2.1 CsA血药浓度监测结果 79例异基因造血干细胞移植受者术后9 w内553次CsA血药浓度连续监测结果见表2。术后1~4 w CsA血药浓度呈上升趋势,第4周后CsA血药浓度逐渐降低。
表2 造血干细胞移植受者术后9 w CsA血药浓度变化(±s)
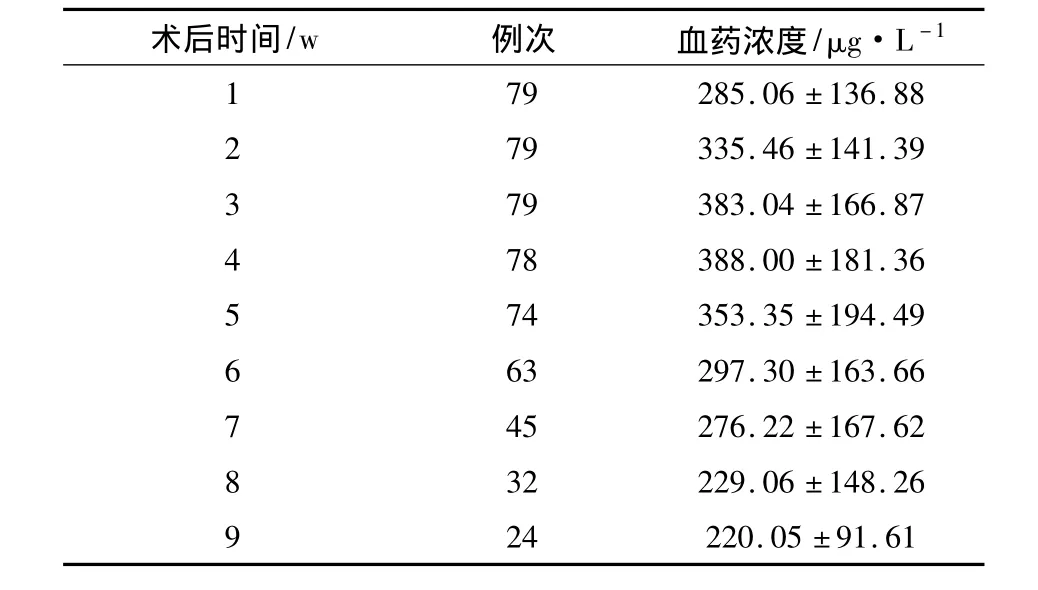
表2 造血干细胞移植受者术后9 w CsA血药浓度变化(±s)
1 79 285.06±136.88 2 79 335.46±141.39 3 79 383.04±166.87 4 78 388.00±181.36 5 74 353.35±194.49 6 63 297.30±163.66 7 45 276.22±167.62 32 229.06±148.26 24 220.05±91.61 8 9
2.2 CsA全血稳态浓度测定值的分布 对79例异基因造血干细胞移植受者,在术后9 w内动态监测CsA血药浓度,共553例次。监测结果浓度分布见表3,多数测定结果位于150~600 μg·L-1范围内,而超过有效浓度上限的例次也较多。
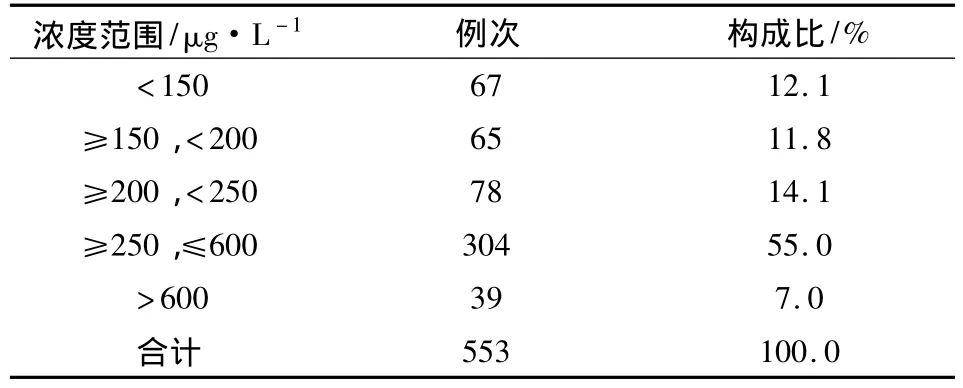
表3 553例次CsA全血药物浓度分布情况
在CsA血药浓度>600 μg·L-1的39例次中,有36例次(19例患者)是术后第2~5周内测定的结果,其中5例出现牙龈出血、恶心呕吐的症状,2例患者分别为3岁、4岁儿童,首次及第2、3周所测CsA血药浓度结果均>300 μg·L-1,减少剂量后第4周所测浓度分别为87.2、89.6 μg·L-1;CsA 血药浓度<150 μg·L-1的 67例次(32例患者)中,23例为术后第5~9周测定的结果,用药剂量有所减少,其中6例患者,晨起后发现牙龈肿胀出血明显,皮肤伴有出血点并四肢酸痛,怀疑急性移植物抗宿主病,增加CsA用量同时给予糖皮质激素冲击治疗,情况好转。
2.3 CsA给药剂量与首次血药浓度的关系 79例患者共测定CsA浓度553次,其中术后第1周内测定 79例次,CsA 浓度 <150 μg·L-1有 11次(13.9%),150 ~200 μg·L-1有 12 次(15.2%),200 ~250 μg·L-1有 16 次(20.3%),250 ~600 μg·L-1有37 次(46.8%),高于 600 μg·L-1有 3 次(3.8%)。术后第1周用药,剂量与浓度的关系见图1。
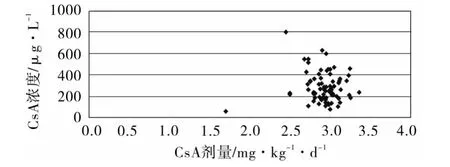
图1 术后9 w内CsA用量与血药浓度的关系
2.4 CsA血药浓度与临床生化指标相关性分析553例次CsA血药浓度与血清肌酐(Cr)、尿素氮(BUN)、直接胆红素(DBIL)、间接胆红素(TBIL)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、血糖浓度(GLU)、血清镁(Mg)、总蛋白(TP)、白蛋白(ALB)、红细胞压积(HCT)、中性粒细胞(ANC)、血小板(PLT)等临床生化指标的相关性分析结果见表4。表4显示除与间接胆红素、血清镁等有一定相关性外,CsA血药浓度与其他临床指标相关性不明显。
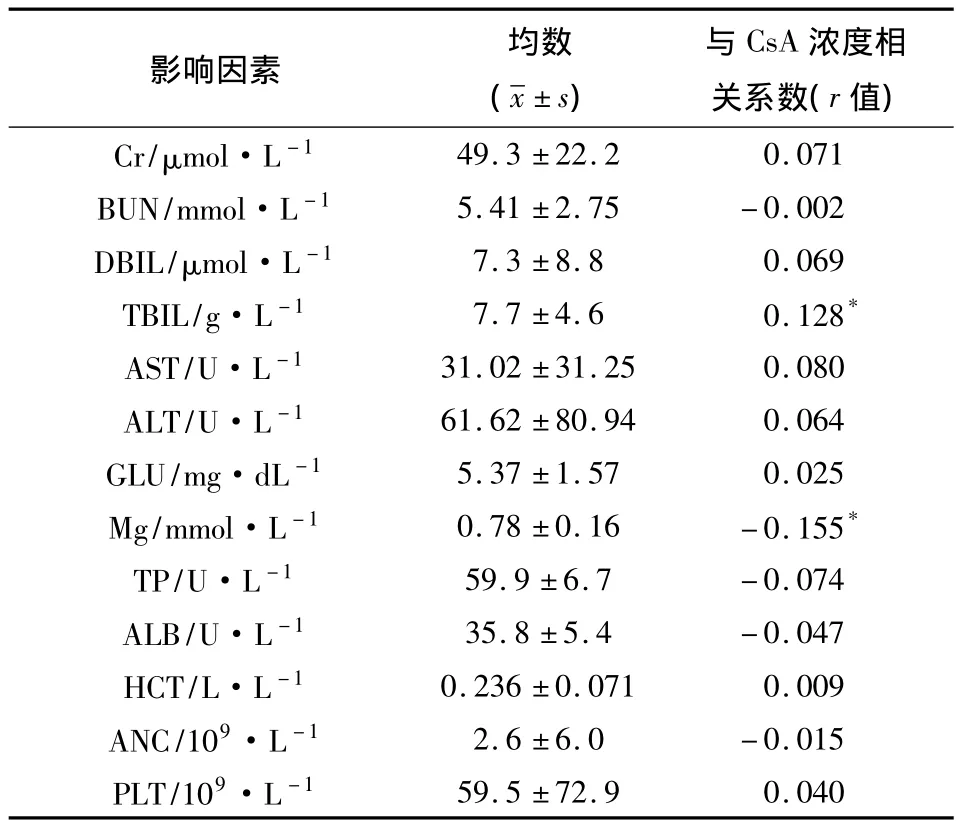
表4 临床生化指标与CsA血药浓度的相关性
3 讨论
allo-HSCT是治疗恶性血液病、造血衰竭性疾病和某些先天性代谢性疾病的有效方法。影响allo-HSCT疗效的因素很多,其中移植物抗宿主病(GVHD)是影响造血干细胞移植预后的主要因素之一。GVHD具有严重的免疫抑制和自体免疫特征,其临床表现多样,主要累及皮肤,消化系统(胃肠道、肝脏等),肺及免疫系统,可表现为硬皮病、干燥综合征、慢性腹泻等症。Allo-HSCT中,供受者配型不合、性别不同、无血缘关系、预处理强度加强、具妊娠史的女性作为供者以及CsA及MTX用量不足等均为急性GVHD高危因素[6]。
CsA用于allo-HSCT始于20世纪70年代末,可以预防allo-HSCT后GVHD的发生。但CsA有肝肾、神经系统及心血管系统不良作用,尤其以肝肾毒性最为常见。近几年来,CsA谷浓度与急性GVHD的关系越来越引起学者们的重视。在造血干细胞移植术后早期,主要防治同种异体排斥反应,而后期主要防治移植物抗宿主病并可能伴有同种异体排斥反应。对于不同原发病的造血干细胞移植术后移植物抗宿主病及同种异体排斥反应所需的CsA有效谷浓度暂无明确浓度范围的报道,研究对象不同,所得到的结果略有差异。对于再生障碍性贫血术后CsA血药浓度的研究,有学者认为最佳稳态治疗窗为 150 ~300 μg·L-1[7]。1995 年 Mueller[8]等报道,肝移植患者移植后CsA血药浓度维持在100~400 μg·L-1时,不良反应发生率较低,植活时CsA谷浓度<100 μg·L-1组急性GVHD发生率高,本组结果与其基本一致。GVHD及同种异体排斥反应作为重要的并发症,显著影响着HSCT移植的成功率[9]。CsA的有效浓度与并发症程度有显著相关性。
目前临床上常用的治疗方案为CsA+霉酚酸酯(MMF)+短程甲氨蝶呤(MTX)+抗胸腺细胞球蛋白(ATG)四联疗法,该方案包括CsA 3 mg·kg-1·d-1+MMF 15 ~20 mg·kg-1·d-1+MTX 10 mg·m-2+ATG 3 ~5 mg·kg-1·d-1,CsA 在移植 -1 d开始24 h静脉滴注,使CsA浓度维持在200~400 μg·L-1,1 个月后改成口服 6 mg·kg-1·d-1维持治疗,根据GVHD的出现及疾病复发的危险度,每周递减5% ~10%。MMF从移植+1 d给药至+20 d或外周白细胞正常。MMF与CsA对排异有协同作用,二者联用可以减少CsA的用量并减少CsA引起的肝肾毒性。现今CsA+MMF疗法已广泛肝、肾、心等器官移植。79例异基因造血干细胞移植受者术后9 w内CsA血药浓度连续监测结果表明,术后1~4 w CsA血药浓度呈上升趋势,第4周后CsA血药浓度逐渐降低。CsA浓度的降低与临床个体的给药方案及人体的耐受性有一定的关系,给药剂量随术后时间的延长而相应减少。由于器官移植病人用药期较长,用药量不足会影响疗效,出现排斥反应,而药物剂量过大又易于导致毒性反应。因此,如何调整其用量,实现给药个体化一直是CsA临床应用中关键的问题。最初各中心均采用经验主义的固定剂量(mg·kg-1),然而由于该药的治疗窗较窄,且对肝、肾毒性反应及药代动力学参数个体差异较大,固定剂量方案常可导致免疫抑制不足或药物中毒反应。仅凭移植医生的临床经验判断调整用药剂量的直观方法远不足以解决如此复杂的问题,所以CsA的合理应用仍是一个重要的研究课题[10]。
由于CsA具有生物利用度和药物动力学的个体差异及同一个体在不同时期的差异性很大,不同患者对 CsA敏感性和耐受性也存在区别[11]。因此,为维持病人最佳免疫水平,在治疗过程中监测CsA浓度,了解CsA血药浓度波动与临床用药方案及患者部分生化指标的相关性,并据此调整给药方案、个体化用药,可减少因CsA浓度过高所致肝肾毒性或因浓度过低而导致的急性排宿主反应(GVHD)的发生,具有非常重要的临床意义[9]。
研究表明,测定CsA浓度的影响因素主要有:(1)检测样品的影响:用肝素作抗凝剂,以全血作样本比用血浆或血清容易得到稳定可靠的测定结果,且采血时间相对固定,一般于每日清晨给药前或给药后12 h采血;(2)监测方法的影响:CsA的清除率除受检测样品的影响外,还受测定方法的影响,荧光偏振免疫(FPIA)法的测定值受代谢产物交叉反应的影响,可能致使结果偏高。因此,在评价CsA血药浓度时应考虑到所采用的检测方法;(3)其他因素的影响:CsA浓度因患者更换药物的生产厂家、剂型、批号而产生波动;甚至还受性别、年龄、体重的影响,但身高、糖尿病却对 CsA浓度影响不大[12]。
本研究中4例发生急性肾功能衰竭时所测CsA浓度均大于600 μg·L-1,经停药及对症处理后,肾功能恢复,显示CsA肝肾损害的发生率随其浓度升高而增加,经减量或停药后,肝肾功能均可恢复。
因此,在治疗过程中监测 CsA浓度,减少因CsA浓度过高所致肝肾毒性或因浓度过低而导致的急性排宿主反应(GVHD)的发生,选择适合患者本人的治疗方案是至关重要的;同时为减少因CsA浓度过高所致不良反应或过低所致GVHD的发生有着重要的临床意义。
本文结果显示:当 CsA浓度 <150 μg·L-1时急性GVHD的发生率高;反之,当CsA浓度>600 μg·L-1时则肝肾不良反应的发生率增高。故我们认为将CsA浓度维持在150~600 μg·L-1较为适宜,可以保持疗效的同时又降低肝肾不良反应的发生率。同时根据本组病例的数据观察并通过数据处理,可知CsA血药浓度与间接胆红素及血清镁相关性显著,与其他指标的显著性均不明显。因此在临床用药时密切关注指标高低,以使CsA的有效浓度达到理想值,并使毒性、不良反应降到最低。
[1] 吴俊珠,金 拓.环孢菌素A安全应用及药动学研究新进展[J].中国药房,2007,18(8):634-637.
[2] 张 鹏,鹿全意,王 昭,等.环孢素A、甲氨喋呤、霉酚酸酯联合抗胸腺细胞球蛋白预防HLA不全相合移植的移植物抗宿主病[J].福建医科大学学报,2006,40(6):594-596.
[3] 叶卫东,王 雪,刘巧玲.环孢霉素A在服药患者血浆中的分布[J].安徽医药,2012,16(11):1653-1654.
[4] 童 彤,唐丽琴,张善堂,等.同种异基因肾移植患者全血中环孢素A浓度监测结果初步分析[J].安徽医药,2013,17(6):1059-1061.
[5] Thomas ED.Hematopoietic cell transplantation[M].2nd ed.Malden:Blackwell Science Inc,1999:515-536.
[6] 裴云萍,方 芸,王 羽,等.造血干细胞移植受者环孢素A血药浓度监测指标研究[J].中国药房,2008,19(8):584-585.
[7] 张雯雯,张 华,薛 领,等.再生障碍性贫血患儿的环孢素群体药动学研究[J].药学服务与研究,2012,12(3):212-216.
[8] Mueller EA,Kallay Z,Richard F,et al.Bile-independent absorption of cyclosporine from a microemulsion formulation in liver transplant patients[J].Brief Communications,1995,60(5):515-517.
[9] 梁立艳,张 莉,井丽萍,等.环孢素血药浓度水平对重型再生障碍性贫血患者免疫抑制治疗近期疗效的影响[J].中华血液学杂志,2011,32(11):766-771.
[10]耿浴尘.肾移植术后监测环孢素A血药浓度峰值的(C2)的临床意义[J].中国现代药物应用,2012,6(9):91-92.
[11]李 琴,李晓宇,刘皋林.药物相互作用对免疫抑制剂合理用药的影响[J].中国临床药理学杂志,2011,27(8):629-633.
[12]董卫华,寇媛媛,黄泰康,等.再生障碍性贫血患者环孢素A血药浓度的监测[J].西北药学杂志,2013,28(1):78-79.
