铁皮石斛谷氨酸脱羧酶基因的分离与生物信息学分析
2014-11-01张岗胡本祥李依民张大为郭顺星
张岗,胡本祥,李依民,张大为,郭顺星
铁皮石斛谷氨酸脱羧酶基因的分离与生物信息学分析
张岗,胡本祥,李依民,张大为,郭顺星
712046 西安,陕西中医学院药学院/陕西省中药基础与新药研究重点实验室(张岗、胡本祥、李依民);100193 北京,中国医学科学院北京协和医学院药用植物研究所(张岗、张大为、郭顺星)
分离珍稀濒危兰科药用铁皮石斛谷氨酸脱羧酶(GAD)基因并进行生物信息学和表达分析。
采用 RT-PCR 和 RACE 技术获基因 cDNA 全长;利用生物信息学软件分析蛋白理化性质、结构域和三维建模等分子特性;用 DNASTAR 6.0 和 MEGA 4.0 分别进行氨基酸多序列比对和进化树分析;借助实时定量 PCR 检测基因表达。
分离到基因,cDNA 全长 1795 bp,编码一条由 498 个氨基酸组成的多肽,分子量55.90 kD,等电点 5.32;DoGAD 蛋白不含跨膜域或信号肽,具有谷氨酸脱羧酶和磷酸吡哆醛依赖的脱羧酶结构域(17-443、37-381);DoGAD 与植物 GADs 蛋白一致性为 69.5% ~ 78.8%,隶属于 GADs 分子进化树的植物类群;转录本在石斛叶和茎中相对表达量较高,分别为根中的 5.16 和 3.92 倍。
成功克隆得到铁皮石斛谷氨酸脱羧酶基因全长,的表达特征暗示其可能在铁皮石斛叶和茎中发挥重要的调控作用。
铁皮石斛; 谷氨酸脱羧酶; γ-氨基丁酸; 计算生物学; 基因克隆
谷氨酸脱羧酶(glutamate decarboxylase,GAD)是生物体中普遍存在的一类胞内酶,主要分布于细胞质中,以磷酸吡哆醛为辅因子催化谷氨酸转化为一种四碳非蛋白质氨基酸,即 γ-氨基丁酸(γ-amino butyric acid,GABA)[1]。GABA 被证实是哺乳动物中枢系统中一种重要的抑制性神经递质,具有降血压、调节内分泌、健脑安神等多种生理功效;GABA 在植物细胞逆境防御、氮素储存、激素合成以及生长发育等过程中起重要作用[1]。在食品科学领域,GABA 正在作为新资源食品获得广泛关注[2]。
基因现已从矮牵牛[3]、拟南芥[4]、水稻[5]、烟草[6]、香蕉[7]和人参[8]等多种植物中获得克隆和鉴定。植物 GAD 蛋白 C 末端普遍含有一个钙调蛋白(calmodulin,CaM)结合域,能够与 CaM 结合增加酶活。植物受低温、高温、高盐或伤害等外源环境因子刺激时,胞内产生 Ca2+峰,进而结合 CaM 活化 GAD 蛋白,最终导致胞内积累大量GABA。拟南芥 GAD1 和 GAD2 酶活受 Ca2+/CaM 处理分别上调 35 倍和 13 倍,2基因受外源 NH4Cl、NH4NO3、谷氨酸等营养物处理诱导,参与调控植物氮代谢[4]。香蕉1 基因的表达与果实成熟及乙烯生物合成密切相关[7]。人参基因响应高盐、高温、H2O2等处理,可能在非生物逆境胁迫反应中起作用[8]。因此,GAD 介导的 GABA 合成途径对调节植物体的生长发育和非生物逆境胁迫等生命活动至关重要。
铁皮石斛(Kimura et Migo)为兰科(Orchidaceae)石斛属()多年生草本植物,是石斛属药用植物中最为珍稀名贵的种。石斛属植物主要含有多糖、芪类、酚类、氨基酸等活性成分,具有重要的药理作用[9]。GABA 在石斛药理功效方面的作用尚不清楚。前期,我们利用 SSH 技术富集铁皮石斛种子共生萌发差异表达基因[10],分离得到一条 587 bp 的表达序列标签(expression sequence tag,EST),与蓖麻()(GenBank 注册号 XM_002528469)相似性较高(66%)。鉴于GAD 介导的 GABA 合成途径在植物细胞生理代谢中的重要作用,该 EST 可能在铁皮石斛细胞生理代谢中起作用。本研究利用 RACE 克隆基因全长并进行特征分析,旨为揭示其在铁皮石斛细胞生理代谢中的生物学功能提供依据。
1 材料与方法
1.1 材料
1.1.1 植物材料和取样 野生铁皮石斛采自云南西双版纳。幼嫩石斛小苗处于营养生长阶段,无花蕾,株高约(10 ± 2)cm,取其根、茎、叶等样品,液氮速冻后置–80 ℃保存备用。
1.1.2 主要试剂 EASYspin 植物 RNA 快速提取试剂盒为 Aidlab 公司产品;M-MLV 逆转录试剂盒为美国 Promega 公司产品;SMARTerTMRACE cDNA Amplification Kit 和Advatange®2 Polymerase Mix 为日本 Clotech公司产品;胶回收试剂盒为 TianGen 公司产品;pMD18-T 载体、SYBR®PremixTMMaster Mix 和ROX 为日本Takara 公司产品;琼脂糖购自美国Sigma 公司;其他化学试剂均购自美国 Gibco 公司。
1.1.3 实验仪器 NanoDropTM2000 分光光度计为美国 Thermo Fisher 公司产品;PTC-200 型 PCR 仪为美国 Bio-Rad 公司产品;琼脂糖电泳系统为北京六一公司产品;Gene GENIUS BIO IMAGING System 凝胶成像系统为Synegene 公司产品;荧光定量 PCR 仪和ABI PRISM 7500 SDS 软件为美国 Applied Biosystems 公司产品。
1.2 方法
1.2.1 RNA 提取和 cDNA 合成 按照 EASYspin 植物 RNA 快速提取试剂盒操作说明制备各样品总 RNA,NanoDropTM2000 分光光度计分析 RNA 质量、纯度,琼脂糖凝胶电泳检测完整性。按照M-MLV 逆转录试剂盒操作说明,反转录合成cDNA 第一链,–20 ℃保存备用。
1.2.2 5'-RACE 和 RT-PCR 验证 根据原始 EST序列,设计两条 5'-RACE 引物:DoGAD-R1 5' GCC GTCGTTACCGCTTATCT 3';DoGAD-R2 5' GCTTC TGCTAAAGTCTTCCCTG 3',按照 SMARTerTMRACE cDNA Amplification Kit 说明书,分别与 Nested Universal Primer A(NUP)引物组合进行两次巢式 5'-RACE。两次 PCR 反应体系均为 25 μl。第一次 PCR 体系包括10 × Advantage®2 PCR buffer 2.5 μl,10 mmol/L dNTPs 0.5 μl,DoGAD-R1(10 µmol/L)0.5 μl,10 × NUP 0.5 μl,5'-RACE ready cDNA 1.0 μl,50 × Advatange®2 Polymerase Mix(5 U/L)0.5 μl,ddH2O 19.5 μl;反第二次 PCR 分别以0.5 μl DoGAD-R2(10 µmol/L)和1.0 μl 第一次 PCR 产物作为下游引物和反应模板外,其余组分与第一次 PCR 体系的保持一致。PCR 程序为:95 ℃ 3 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,共 32 个循环;72 ℃ 7 min,4 ℃保温。PCR 产物经 1.5% 琼脂糖凝胶电泳,以胶回收试剂盒纯化目的条带,连接至pMD18-T 载体,转化大肠杆菌JM109 感受态细胞,随机挑选3 个克隆送上海生工测序。所获 cDNA 序列与原 EST 拼接,设计跨开放阅读框(open reading frame,ORF)引物DoGAD-S1:5' TCTTGAGGTTGAGGGCGA 3',DoGAD-AS1 5' TACTTACTCTCCCTATGACAAAC AG 3',进行全长基因 RT-PCR 验证。
1.2.3 序列分析 使用一系列网络在线工具进行基因核酸及编码蛋白的生物信息学序列分析。利用NCBI 的BLASTx(http://www.ncbi.nlm. nih.gov/blast/)和 ORF Finder(http://www.ncbi.nlh. nih.gov/gorf/gorf.html)分析cDNA 序列;用ExPASy Proteomics Server 的InterProScan(http://www.ebi. ac.uk/cgi-bin/iprscan/)和 PROSITE SCAN(http:// npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_proscan.html)分析DoGAD 蛋白质的结构域和基元;Protparam(http://web.expasy.org/protparam/)和 SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/secpred_ sopma.pl)分析蛋白质理化性质和二级结构;采用SWISS-MODEL(http://swissmodel. expasy.org/)进行蛋白质三维建模分析;SignalP 4.0(http://www.cbs. dtu.dk/services/SignalP/)和TMpred(http://www.ch. embnet.org/software/TMPRED_form. html)预测蛋白质信号肽和跨膜区域;PSORT(http://psort.ims.u- tokyo.ac.jp/form.html)进行蛋白质亚细胞定位分析。采用 DNASTAR 6.0 进行氨基酸序列比对分析;借助MEGA 4.0 构建系统进化树。
1.2.4 实时定量 PCR 分析 分别用2 μg 根、茎、叶样品总RNA 反转录合成cDNA,1作为内参基因[11],qPCR 分析基因的组织表达模式。qPCR 引物DoGAD-S2 5' TCAAAAGA CAGTGGAATGCCC3' 和DoGAD-AS2 5'TGCCG TCGTTACCGCTTAT3' 的扩增产物长 297 bp。用 PRISM 7500 实时荧光定量 PCR 仪进行qPCR。反应体系 25 μl,包括 2 × SYBR®PremixTMMaster Mix 12.5 μl,正反向引物(10 μmol/L)0.5 μl,ROX 0.5 μl,cDNA 2 μl,ddH2O 9 μl。每个反应重复 3 次,包括不加模板的对照,实验重复 3 次。PCR 程序为:95 ℃ 30 s,95 ℃10 s,60 ℃ 45 s,40 个循环,反应结束绘制熔解曲线。根据ABI PRISM 7500 SDS 软件生成的循环阈值(cycle threshold,CT),用 2-ΔΔCT方法[12]计算相对表达量。
2 结果
2.1 DoGAD 基因克隆和全长验证
经过两次巢式 5'-RACE 反应,扩增产生长度约为 1500 bp 的目标条带(图 1),克隆、测序获得 1412 bp 的序列,拼接得到一条 1795 bp 的 cDNA。BLASTx 分析表明其与 GenBank 中已注册的多种植物谷氨酸脱羧酶基因有很高的相似性(73% ~ 80%),定名为(GenBank 注册号 KF876841)。基因的开放阅读框长 1497 bp,5'-UTR 长 128 bp,3'-UTR 长 142 bp,具有真核生物 polyA 尾巴,起始密码子附近碱基序列 AATATGG 遵循 KOZAK 规则,即 A/GNNA TGG[13]。使用 DoGAD-S1/AS1 引物,RT-PCR 扩增产生单一条带(图 1),克隆、测序获得 1584 bp 的序列包含完整 ORF,与拼接序列一致,进而说明已成功获得基因全长。

kb M 1 2 M 2.001.000.750.500.250.10
Figure 1 Clone of the full length cDNA ofgene in
2.2 DoGAD 基因的编码蛋白理化特性分析
Protparam 预测基因编码蛋白分子式 C2516H3943N661O742S18,分子量为 55.90 kD,等电点 5.32;DoGAD 蛋白带负电残基(Asp + Glu)为 67,带正电残基(Arg + Lys)为 55。该蛋白不稳定系数为 38.27,脂肪系数为 92.59,亲水性系数为–0.144。SOPMA 分析结果表明 DoGAD 蛋白二级结构有 204 个 α 螺旋(alpha helix,40.96%)和 78 个 β 转角(beta turn,7.43%),两者被 78 个延伸链(extended strand,15.66%)连接,还包含 179 个随机卷曲(random coil,35.94%)。
2.3 DoGAD 蛋白结构域、定位和跨膜区分析
InterProScan 分析显示,基因编码蛋白含有保守的谷氨酸脱羧酶结构域(17-443)和磷酸吡哆醛依赖的脱羧酶结构域(37-381)。PROSITE SCAN 分析结果表明,DoGAD 蛋白包括 1 个cAMP/cGMP 依赖蛋白激酶磷酸化位点(491-494)、2 个 N 糖基化位点(272-275、317-320)、2 个蛋白激酶 C 磷酸化位点(361-363、394-396)、7 个酪蛋白激酶 II 磷酸化位点(66-69、68-71、292-295、387-390、428-431、462-465、472-475)、4 个酪氨酸激酶磷酸化位点(182-188、145-152、82-90、144-152)和 6 个 N-豆蔻酰化位点(122-127、125-130、211-216、279-284、357-362、463-468),这些保守基元可能对蛋白结构和功能有重要作用。SignalP 4.0 和TMpred 分析DoGAD 蛋白不含信号肽和跨膜域。PSORT 预测DoGAD 蛋白定位于线粒体基质的可能性较高,为 48%,过氧化物酶体次之为 34.5%,定位于细胞核、线粒体内膜的几率分别为 30% 和 18.8%。
2.4 DoGAD 编码蛋白三维建模
在 SWISS-MODEL 依据保守结构域作图工具中,以拟南芥谷氨酸脱羧酶 AtGAD1(PDB No.: 3HBX)A 链为模板[14],对 DoGAD 蛋白进行三维结构建模(图2),结果显示 DoGAD 与该蛋白有 84.86% 的序列相似性,空间结构类似。

图 2 基于 SWISS-MODEL 的 DoGAD 蛋白三维建模
Figure 2 Three-dimensional structure of the deduced DoGAD protein using SWISS-MODEL
2.5 DoGAD 与植物 GADs 蛋白的氨基酸序列比对分析
运用 DNAStar 6.0 中的 MegAlign 程序,对 DoGAD 蛋白与 6 条植物 GAD 蛋白进行多序列比对(图 3)。结果表明,DoGAD 与人参PgGAD(ADB82905)的一致性最高为 78.8%,拟南芥 AtGAD1(NP_197235)次之,为 78.5%,与水稻OsGAD1(BAB32870)、AtGAD2(NP_001117556)、蒺藜苜蓿 MtGAD(XP_003600653)和OsGAD2(BAB32869)等蛋白的一致性分别为 78.1%、77.1%、77.1% 和 69.5%。同时,DoGAD蛋白与其他植物 GADs 有相似的保守区域及活性位点(图 3A,242-293),包含磷酸吡哆醛结合位点(图 3B,274-277)以及由 32 个氨基酸组成的钙调蛋白结合 C 末端延伸区域。

Figure 3 Multiple sequence alignment of DoGAD and GADs proteins from other plants (A: The active domain of GADs; B: The consensus motif for the binding of pyridoxal 5-phophate; C: The C-termial peptide extension)

图 4 DoGAD 与不同物种 GADs 蛋白的进化树分析
Figure 4 Phylogenetic tree of DoGAD with GADs from other species
2.6 DoGAD 基因编码蛋白的系统进化树分析
为分析基因编码蛋白的进化关系,从 GenBank 数据库中选取来自微生物、动物和植物中具有代表性的 13 个物种 GADs 蛋白序列,利用 MEGA 4.0 构建 DoGAD 蛋白的系统进化树。图 4 结果表明,17 条 GADs 被聚成动物、微生物和植物三大类群;铁皮石斛 DoGAD 蛋白隶属于植物类群,符合植物自然进化过程。
2.7 基因表达模式分析
分别提取石斛根、茎、叶等样品总 RNA,利用 qPCR 技术检测基因的组织表达模式。图 5 结果表明,基因转录本在 3 种组织中为组成型表达,但相对表达量存在明显差异。以根为校正样本,基因转录本在叶中的表达量最高,为根中的 5.16 倍,茎中表达量为根中的 3.92 倍。
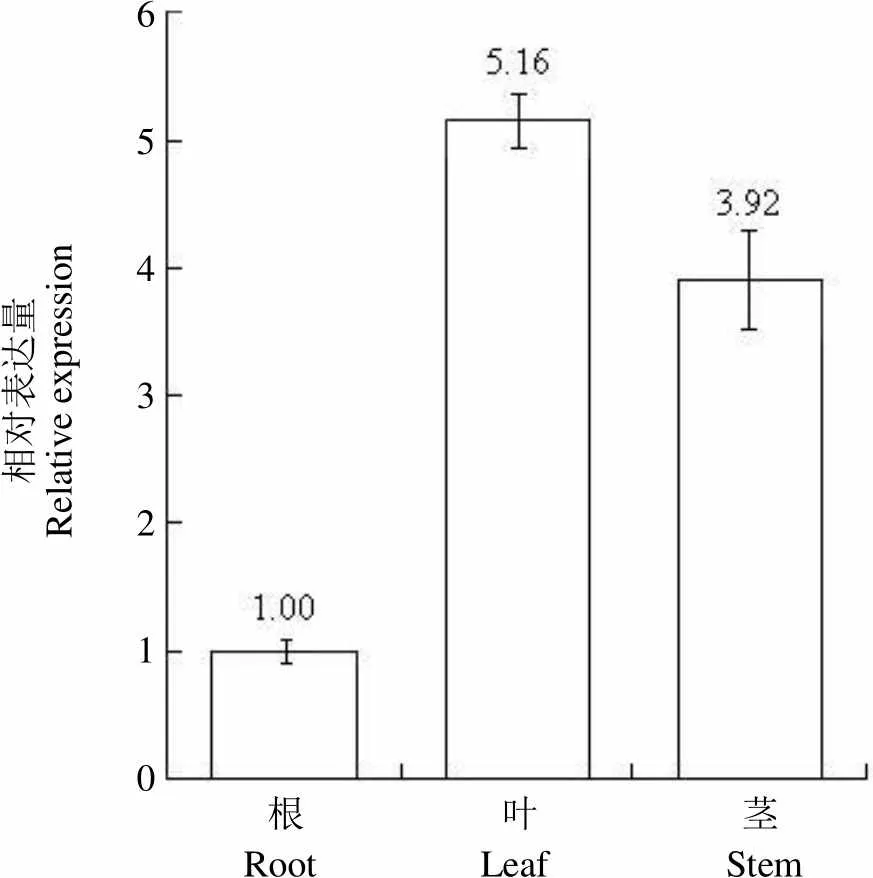
相对表达量Relative expression6543210 根 叶 茎 Root Leaf Stem
Figure 5 Tissue-specific expression pattern ofgeneusing qPCR analysis
3 讨论
通过指导 GABA 的合成代谢调控植物体生长发育、抗病以及非生物逆境胁迫等多种生命活动过程。基因特性已在矮牵牛[3]、拟南芥[4]、水稻[5]和烟草[6]中深入报道,药用植物中仅有人参[8]的相关分析。植物一般呈多基因家族,序列比对显示拟南芥基因组中有 5 个成员[15],烟草和水稻中有 2 个[6, 8],人参以多拷贝形式存在[8]。本研究首次从珍稀濒危药用铁皮石斛中分离到一个基因,编码蛋白具有谷氨酸脱羧酶的保守结构域。DoGAD 与多种植物GADs 蛋白序列相似性较高,二级结构与西洋参、矮牵牛和拟南芥等植物的类似[8],三维结构和AtGAD1 蛋白 A 链晶体结构类似[14],隶属于 GADs 蛋白进化树三大类群的植物类群。这些结果说明是编码铁皮石斛谷氨酸脱羧酶的新基因。
结构域和基元是决定蛋白质生物学功能的重要因素。DoGAD 蛋白的 SGHK 基序符合植物GADs 磷酸吡哆醛结合位点的序列特征 Ser-X-X- Lys[8],赋予其结合磷酸吡哆醛的特性。DoGAD 羧基端具有CaM 结合域,且其中包含对CaM 结合至关重要的色氨酸残基[16](第 484 位的 W),说明该蛋白是Ca2+/CaM 依赖的 GAD,与几乎所有植物 GADs 的研究结果一致[3-8],有别于Ca2+/CaM 不依赖的OsGAD2,因 OsGAD2 的 CaM 结合域存在较多氨基酸变异[5]。DoGAD 蛋白不含分泌或跨膜肽段,说明其为胞内蛋白,在植物细胞内起作用。植物 GADs 介导的 GABA 合成途径在细胞质中进行[1],PSORT 关于 DoGAD 的亚细胞定位预测与此并不一致,尚有待于进一步实验分析。
基因表达研究表明基因普遍存在于多种植物组织中,在植物发育、外界刺激及果实成熟等不同的生理过程中差异表达。本研究 qPCR 分析显示,基因为组成型表达,在石斛叶和茎中相对表达量较高,暗示其可能主要调控叶和茎中 GABA 的合成。在半夏[17]、炒稻芽和炒麦芽[18]等中药材中,GABA 是一种主要的活性成分,其合成代谢可能与 GAD 基因表达调控密切相关。GABA 作为重要的神经中枢调节物质,已经在医药和食品领域展现了广阔的应用前景。后续随着基因功能的解析、GABA 合成代谢及其药理活性关系的阐明,将有利于通过遗传工程改良铁皮石斛种质,进而为石斛属植物的资源开发与利用奠定物质基础。
[1] Bouché N, Fromm H. GABA in plants: just a metabolite? Trends Plant Sci, 2004, 9(3):110-115.
[2] Liang HY, Deng LK, Lin HL, et al. Research progress of new resource food— γ-amino butyric acid (GABA). Food Res Devt, 2013, 34(15): 119-123. (in Chinese)
梁恒宇, 邓立康, 林海龙, 等. 新资源食品— γ-氨基丁酸(GABA)的研究进展. 食品研究与开发, 2013, 34(15):119-123.
[3] Baum G, Chen Y, Arazi T, et al. A plant glutamate decarboxylase containing a calmodulin binding domain. Cloning, sequence, and functional analysis. J Biol Chem, 1993, 268(26):19610-19617.
[4] Turano FJ, Fang TK. Characterization of two glutamate decarboxylase cDNA clones from Arabidopsis. Plant Physiol, 1998, 117(4):1411- 1421.
[5] Akama K, Akihiro T, Kitagawa M, et al. Rice (Oryza sativa) contains a novel isoform of glutamate decarboxylase that lacks an authentic calmodulin-binding domain at the C-terminus. Biochim Biophys Acta, 2001, 1522(3):143-150.
[6] Yevtushenko DP, McLael MD, Peiris S, et al. Calcium/calmodulin activation of two divergent glutamate decarboxylases from tobacco.J Exp Bot, 2003, 54(389):2001-2002.
[7] Hu W, Yang XY, Li MY, et al. Cloning and expression analysis of MaGAD1 gene from Banana fruit. Acta Bot Boreal Occident Sin,2009, 29(3):429-434. (in Chinese)
胡伟, 杨晓颖, 李美英, 等. 香蕉谷氨酸脱羧酶基因克隆与表达. 西北植物学报, 2009, 29(3):429-434.
[8] Lee JH, Kim YJ, Jeong DY, et al. Isolation and characterization of a Glutamate decarboxylase (GAD) gene and their differential expression in response to abiotic stresses from Panax ginseng C. A. Meyer. Mol Biol Rep, 2010, 37(7):3455-3463.
[9] Chen XM, Wang CL, Yang JS, et al. Research progress on chemical composition and chemical analysis of Dendrobium officinale. Chin Pharm J, 2013, 48(19):1634-1640. (in Chinese)
陈晓梅, 王春兰, 杨俊山, 等. 铁皮石斛化学成分及其分析的研究进展. 中国药学杂志, 2013, 48(19):1634-1640.
[10] Zhao MM, Zhang G, Zhang DW, et al. ESTs analysis reveals putative genes involved in symbiotic seed germination in Dendrobium officniale. PLos One, 2013, 8(8): e72705.
[11] Zhang G, Song C, Zhao MM, et al. Characterization of an A-type cyclin-dependent kinase gene from Dendrobium candidum. Biologia, 2012, 67(2):360-368.
[12] Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res, 2001, 29(9):e45.
[13] Kozak M. An analysis of 5'-noncoding sequences from 699 vertebrate messenger RNAs. Nucleic Acids Res, 1987, 15(20):8125-8132.
[14] Gut H, Dominici P, Pilati S, et al. A common structural basis for pH- and calmodulin-mediated regulation in plant glutamate decarboxylase. J Mol Biol, 2009, 392(2):334-351.
[15] Shelp BJ, Bown AW, McLean MD. Metabolism and functions of gamma-aminobutyric acid. Trends Plant Sci, 1999, 4(11):446-452.
[16] Arazi T, Baum G, Snedden WA, et al. Molecular and biochemical analysis of calmodulin interactions with the calmodulin-binding domain of plant glutamate decarboxylase. Plant Physiol, 1995, 108(2): 551-561.
[17] Li B, Cheng XM, Zhou YY, et al. Research progress of Pinellia ternata (Thunb.) Breit. Chin J Ethnomedicine Ethnopharmacy, 2010, 19(1): 47-48. (in Chinese)
李斌, 程秀民, 周永妍, 等. 半夏的研究进展. 中国民族民间医药, 2010, 19(1):47-48.
[18] Chen TQ, Wu JZ, Xu J. Analysis of γ-amino butynic acid in several corn medicinal materials. Strait Pharm J, 2005, 17(5):75-77. (in Chinese)
陈体强, 吴锦忠, 徐杰. 几种中药材中γ-氨基丁酸的测定. 海峡药学, 2005, 17(5):75-77.
Isolation and bioinformatics analysis of a glutamate decarboxylase gene in
ZHANG Gang, HU Ben-xiang, LI Yi-min, ZHANG Da-wei, GUO Shun-xing
This study is aimed to isolate and characterize a glutamate decarboxylase (GAD) genefrom, a rare endangered medicinal orchid species.
RT-PCR and RACE technologies were used for gene isolation. The physiochemical properties, conserved domains and three dimensional structure of the deduced DoGAD protein were determined using a series of bioinformatics tools. The analyses of multiple alignment and phylogenetic tree were performed using DNASTAR 6.0 and MEGA 4.0, respectively. Real time quantitative PCR was used for gene expression analysis.
The full-length cDNA of, with 1795 bp in size, was deduced to encode a 498-aa protein with molecular weight of 55.90 kD and isoelectric point of 5.32. The deduced DoGAD protein, without transmembrane or signal peptide residues, contained glutamate decarboxylase and pyridoxal phosphate dependant decarboxylase domains (17-443, 37-381). DoGAD had high identities (69.5% - 78.8%) with a number of GAD proteins from various plants, and was grouped into the Plant subgroup in the evolutionary tree of GADs. The transcript abundance ofwas markedly higher in the leaves and stems than that in the roots, which was about 5.16 and 3.92 fold, respectively.
The full length cDNA ofwas successfully cloned. Its expression pattern suggests thatmay play an important regulatory role in the leaf and stem of.
; Glutamate decarboxylase; Gamma-aminobutyric acid; Compatational biology; Gene clone
GUO Shun-xing, Email: sxguo1986@163.com
国家自然科学基金(31070300、31101608);陕西省青年科技新星项目(2012KJXX-44);陕西省教育厅专项科研计划项目(2013JK0829)
郭顺星,Email:sxguo1986@163.com
2013-12-15
Author Affiliations: College of Pharmacy and Shanxi Provincial Key Laboratory for Chinese Medicine Basis & New Drugs Research, Shanxi University of Chinese Medicine, Xi’an 712046, China (ZHANG Gang, HU Ben-xiang, LI Yi-min); Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China (ZHANG Gang, ZHANG Da-wei, GUO Shun-xing)
