西多福韦对人宫颈癌细胞CaSki内人乳头瘤病毒16抑制作用研究
2014-11-01韩芳陆巧妮徐力昆窦媛媛李玉环
韩芳,陆巧妮,徐力昆,窦媛媛,李玉环
西多福韦对人宫颈癌细胞CaSki内人乳头瘤病毒16抑制作用研究
韩芳,陆巧妮,徐力昆,窦媛媛,李玉环
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所生化室(韩芳、陆巧妮、李玉环);100071 北京,中国人民解放军军事医学科学院微生物流行病研究所(徐力昆、窦媛媛)
从抗病毒角度探讨西多福韦对宫颈癌细胞 CaSki 内人乳头瘤病毒 16(HPV16)的抑制作用及对细胞周期的影响。
用 MTT 法检测西多福韦对细胞的毒性;用实时定量 PCR 法检测其对病毒E6、E7 mRNA 水平的影响;用 Western blot 方法检测其对病毒蛋白 E6、E7 和细胞抑癌蛋白 p53、pRb 表达水平的影响;用流式细胞法检测其对宫颈癌细胞周期的影响。
西多福韦对宫颈癌细胞毒性较正常细胞大。可使HPV16 阳性宫颈癌细胞CaSki 内 E6、E7 mRNA 和蛋白水平降低,最大抑制率分别为(33.38±8.00)%、(28.32±2.73)% 和 98.92%、97.46%;可以使p53、pRb 蛋白水平升高,最大浓度时可以上调 12.06 和 3.53 倍;对 HPV16 阴性宫颈癌细胞 C-33A p53 蛋白表达无影响,但可提高 pRb 蛋白水平;可导致CaSki 和C-33A 细胞发生 S 期阻滞,最高浓度组细胞相对对照组 S 期分别增加22.83% 和 67.64%。
西多福韦可以在对细胞无毒的浓度下,抑制宫颈癌细胞内的 HPV16,诱导宫颈癌细胞发生 S 期阻滞。
抗病毒药; 人乳头瘤病毒 16; 宫颈肿瘤; 西多福韦
宫颈癌发病率在女性恶性肿瘤中排第二位,持续性感染高危型人乳头瘤病毒(human papillomavirus,HPV),尤其 HPV16 是主要原因[1]。目前主要依靠外科切除法治疗 HPV 相关疾病[2],但复发率高。临床上可用药物很少,且副作用大、疗效差,并不推荐使用[3]。
西多福韦(cidofovir,CDV)是新型的胞嘧啶核苷膦酰基甲醚衍生物,用于治疗艾滋病患者巨细胞病毒性视网膜炎。后续发现其具有广谱的抗 DNA 病毒作用,其中包括人乳头瘤病毒[4-5]。
本研究主要从抗病毒角度探讨西多福韦对宫颈癌细胞 CaSki 内 HPV16 的抑制作用,同时考察其对宫颈癌细胞周期的影响,评价其对 HPV 感染治疗的应用价值。
1 材料与方法
1.1 材料
1.1.1 细胞系 宫颈癌细胞 CaSki(HPV16 阳性)和 C-33A(HPV 阴性)购自美国菌种保藏中心(ATCC),由本实验室自行传代保存;人胚肺成纤维细胞 HEL,由本实验室自行传代保存。本实验所用细胞均在 12 ~ 20 代之间。
1.1.2 试剂 RPMI 1640、MEM 液体培养基购自美国 Gibco 公司;四甲基偶氮唑盐(MTT)、DMSO 购自美国 Sigma-Aldrich 公司;细胞总蛋白提取试剂盒购自美国 Thermo Scientific 公司;mRNA 提取试剂盒购自德国 Qiagen 公司;实时荧光定量 PCR 试剂盒购自美国 Invitrogen 公司;细胞周期与细胞凋亡检测试剂盒购自碧云天生物技术研究所。
1.1.3 抗体 羊抗 HPV16 E6、鼠抗 HPV16 E7 购自美国 Santa Cruz Technology 公司;鼠抗 p53、pRb 购自美国 BD Pharmingen 公司;鼠抗 β-actin、HRP 标记的山羊抗小鼠 IgG、HRP 标记的兔抗山羊 IgG 二抗购自美国 Cell Signal Technology 公司。
1.1.4 仪器 二氧化碳孵箱购自美国 Thermo Scientific 公司;倒置显微镜购自日本 Olympus 公司;Bio-Rad 湿转系统、凝胶成像系统购自美国 Bio-Rad 公司;ABI 7500 Fast 实时荧光定量 PCR 仪购自美国 ABI 公司;流式细胞仪购自美国 Coulter Corp 公司。
1.2 方法
1.2.1 CDV 对不同细胞毒性的测定 将 CDV 用各细胞系对应的完全培养基溶解,起始浓度为1000 μg/ml,2 倍梯度稀释,共 8 个浓度。以每孔100 μl 加入预先 24 h 铺好 CaSki、C-33A 和 HEL 细胞(1.5 × 104个)的 96 孔板中,每孔 100 μl,每个浓度设 3 个重复孔。同时设正常细胞对照孔,重复 3 孔。48 h 后,每孔加入 20 μl MTT(5 mg/ml),继续培养 4 h,弃去培养液,每孔加入 150 μl DMSO,振荡 10 min,在酶联免疫检测仪 490 nm 处测量各孔的吸光值度。细胞存活率 =(实验孔值/对照孔值)× 100%。细胞存活率≥ 90% 则认为 CDV 对细胞无毒。
1.2.2 实时定量 PCR 检测 CDV 对 CaSki 细胞中 HPV16 E6、E7 mRNA 表达的影响 用培养基将 CDV 稀释成 130、65 和 32.5 μg/ml 3 个浓度,以每孔 2 ml 加入预先 24 h 铺好 CaSki 细胞(4 × 105个)的 6 孔板中,同时设立细胞对照孔。48 h 后终止培养,提取细胞内的总 RNA,以 E6、E7 为目的基因,β-actin 为内参基因,通过实时定量 PCR 检测CDV 作用于 CaSki 细胞后,HPV16 E6、E7 mRNA 水平上的变化。HPV16 E6 上游引物:5' CT GCAATGTTTCAGGACCCA 3',下游引物:5' TCAT GTATAGTTGTTTGCAGCTCTGT 3';HPV16 E7 上游引物:5' GAGGAGGAGGATGAAATAGATGGT 3',下游引物:5' CACTTGCAACAAAACGTTACAA TATTG 3';β-actin 上游引物:5' CCAACCGCGAGA AGATGA 3',下游引物:5' CCAGAGGCGTACAGG GATAG 3'。条件为:50 ℃2 min;95 ℃5 min;95 ℃15 s,60 ℃ 30 s,40 个循环。CDV 处理细胞后,E6、E7 基因的表达水平相对于对照组的变化倍数为2-△△CT倍。
1.2.3 Western blot 检测 CDV 对 HPV16 病毒蛋白及细胞蛋白的影响 用完全培养基将 CDV 配制成 130、65、32.5 和 16.25 μg/ml 的 4 个浓度,以每孔 2 ml 分别加入预先 24 h 铺好 CaSki(4 × 105个)的 6 孔板中,同时设立细胞对照孔。用完全培养基将 CDV 配制成 65、32.5、16.25 和 8.125 μg/ml 4 个浓度,以每孔 2 ml 分别加入预先 24 h 铺好 C-33A 细胞(6 × 105个)的 6 孔板中,同时设立细胞对照孔。48 h 后终止培养,提取细胞内的总蛋白,并定量检测。以 CaSki 内 E6、E7、p53、pRb和 C-33A 内 p53、pRb 为目的蛋白,β-actin 为内参,通过 Western blot 检测蛋白水平的变化。
1.2.4 流式细胞术检测 CDV 对宫颈癌细胞CaSki、C-33A 细胞周期的影响 用培养基将 CDV 配制成 130、65 和 32.5 μg/ml 3 个浓度,以每孔2 ml 加入预先 24 h 铺好 CaSki 细胞(2 × 105个)的 6 孔板中。另外用培养基将 CDV 配制成 65、32.5 和 16.25 μg/ml 3 个浓度,以每孔 2 ml 加入预先 24 h 铺好 C-33A 细胞(4 × 105个)的 6 孔板中。两组实验均设立细胞对照孔。48 h 后终止培养,胰酶消化,用 70% 的乙醇 4 ℃固定细胞 12 h,经 RNase 消化,PI 染色后流式细胞仪检测分析。
1.3 统计学处理
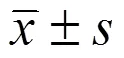
2 结果
2.1 MTT 法检测 CDV 的细胞毒性
CDV 对宫颈癌细胞 CaSki、C-33A、人胚肺成纤维细胞 HEL 的毒性不同(图 1),作用 48 h 后,最大无毒浓度 TC0分别是 125、62.5和 500 μg/ml。
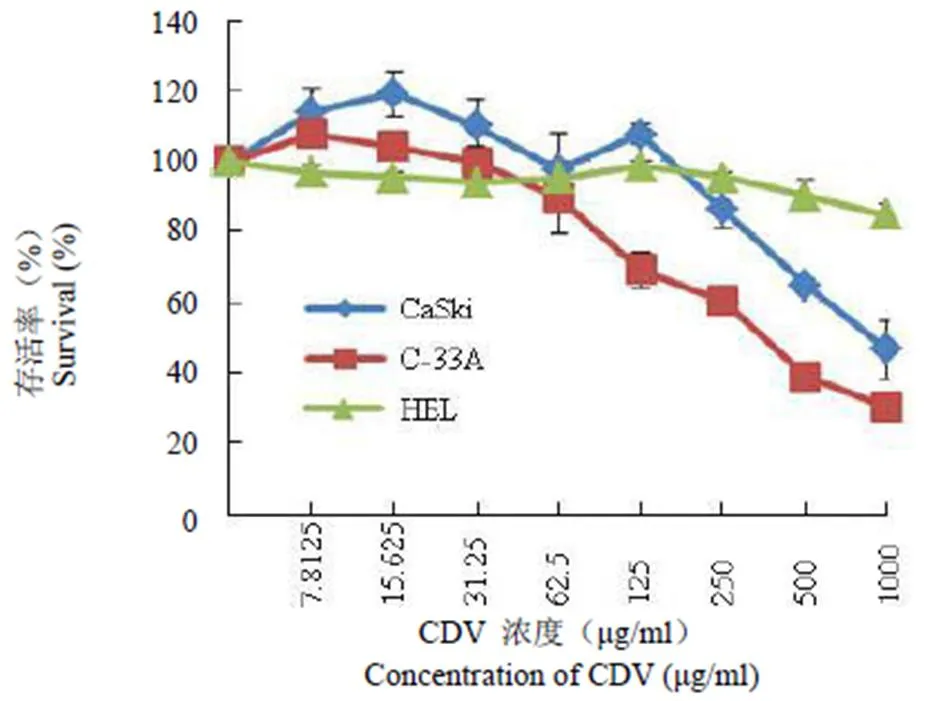
图 1 CDV 的细胞毒性
Figure 1 Toxicity of CDV on different cells lines
2.2 CDV 对 CaSki 细胞中 HPV16 E6、E7 mRNA 表达的影响
PCR 结果显示,CDV 在浓度为 130、65 和 32.5 μg/ml 时,作用于 CaSki 细胞 48 h 后,对CaSki 细胞 HPV16 E6、E7 mRNA 表达均有抑制作用,分别下调(33.38±8.00)%、(28.31±3.28)%、(23.16±2.75)% 和(28.32±2.73)%、(24.46±7.87)%、(16.26±4.98)%(图 2)。

mRNA 相对表达量Relative expression of mRNA1.2 1.0 0.8 0.6 0.4 0.2 0 130 65 32.5 0 CDV 浓度(μg/ml)Concentration of CDV (μg/ml)
Figure 2 qRT-PCR analysis of down-regulation of E6 and E7 mRNA levels in CaSki cells upon CDV exposure (*< 0.05,#< 0.05)
2.3 CDV对HPV16病毒蛋白及细胞蛋白的影响
Western blot 结果显示,CDV 在浓度为 130、65、32.5 和 16.25 μg/ml 时,作用于 CaSki 细胞48 h 后,可下调 CaSki 细胞内 HPV16 E6、E7 蛋白的表达(图 3),分别下调 98.92 %、94.97 %、67.91 %、44.39 % 和 97.46 %、53.87 %、21.87 %、3.08 %,同时可以上调抑癌蛋白 p53、pRb 的表达,分别上调 12.06、6.21、1.11、1.66 倍和 3.53、2.62、0.98、0.08 倍(图 4)。CDV 在浓度为 65、32.5、16.25 和 8.125 μg/ml 时,作用于 C-33A 细胞 48 h 后,可上调抑癌蛋白 pRb 的表达,分别上调 3.03、4.05、4.03 和 3.38 倍,但对 p53 表达无影响(图 5)。

CDV(μg/ml) 130 65 32.5 16.25 对照Control HPV16 E6 HPV16 E7 β-actin
Figure 3 Western blot analysis of down-regulation of E6 and E7 protein levels in CaSki cells upon CDV exposure
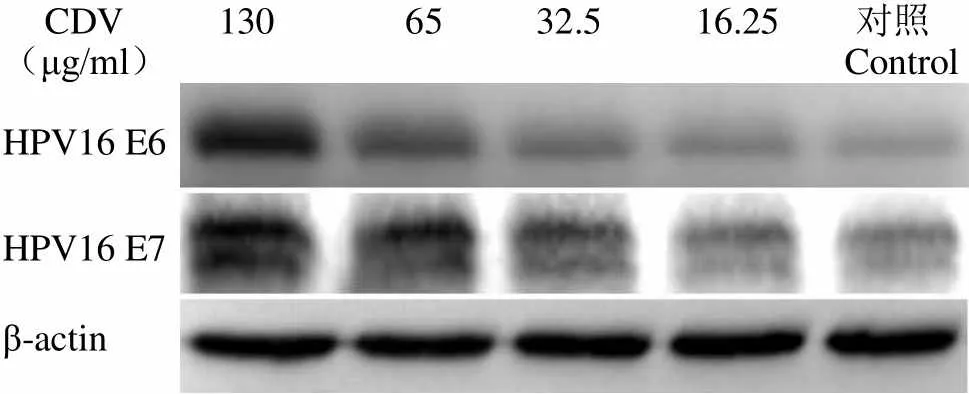
CDV(μg/ml) 130 65 32.5 16.25 对照Control HPV16 E6 HPV16 E7 β-actin
Figure 4 Western blot analysis for up-regulation of protein levels of p53 and pRb in CaSki cells upon CDV exposure
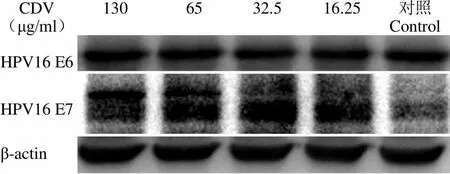
CDV(μg/ml) 130 65 32.5 16.25 对照Control HPV16 E6 HPV16 E7 β-actin
Figure 5 Western blot analysis for the effects of CDV on protein levels of p53 and pRb in C-33A cells
2.4 流式细胞法检测 CDV 对宫颈癌细胞 CaSki、C-33A 细胞周期的影响
CDV 在浓度为 130、65 和 32.5 μg/ml 时,作用于 CaSki 细胞 48 h 后,可使 CaSki 细胞发生 S 期阻滞(图 6),并具剂量-效应关系。最高浓度组细胞相对对照组 S 期增加了 22.83% ;CDV在浓度为 65、32.5 和 16.25 μg/ml时,作用于C-33A 细胞 48 h 后,可使 C-33A 细胞发生 S 期阻滞(图 7),并具剂量-效应关系,最高浓度组细胞相对对照组 S 期增加了 67.64%。
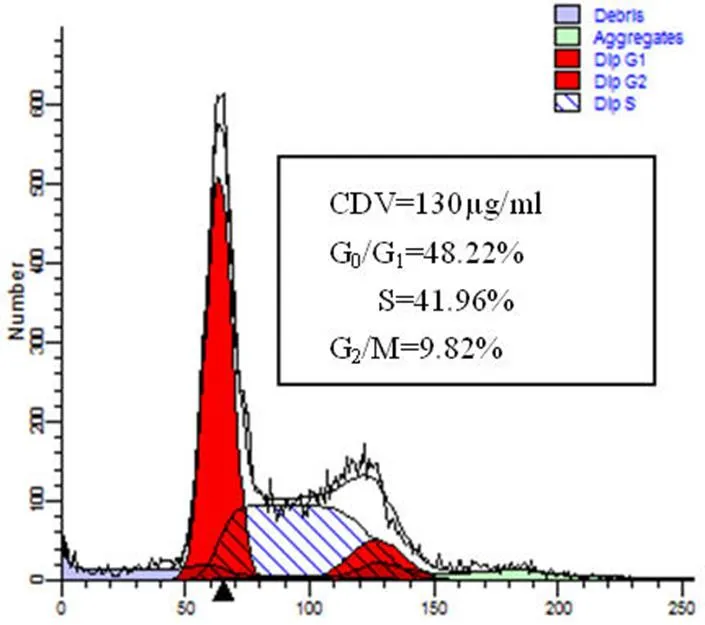
Figure 6 Flow cytometry analysis of CDV-inducted of S phase cell cycle arrest in CaSki cells
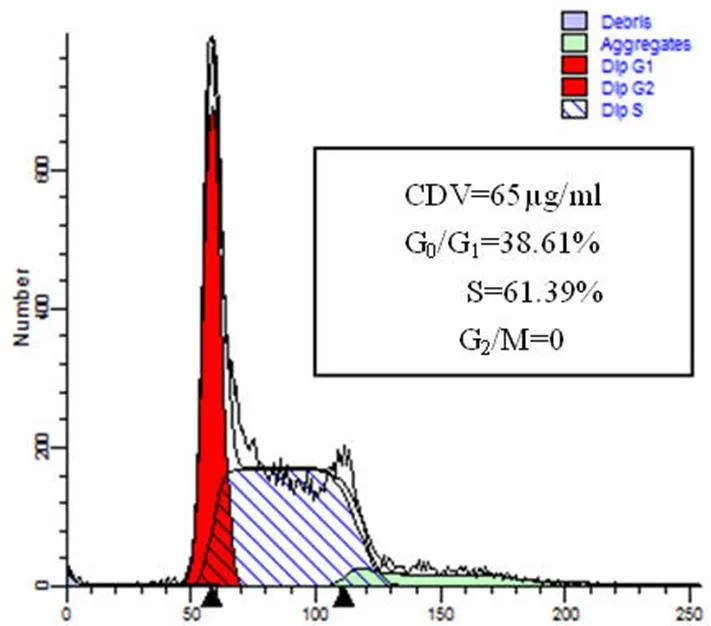
Figure 7 Flow cytometry analysis of CDV-inducted of S phase cell cycle arrest in C-33A cells
3 讨论
CDV 具有广谱的抗 DNA 病毒作用,其机制是主要活性代谢产物 CDVpp竞争性抑制病毒的DNA 聚合酶,抑制病毒复制[5]。临床数据显示西多福韦凝胶也有比较好的抗 HPV 作用,目前西多福韦的适应证外用药呈增加的趋势,国内外均期望将西多福韦开发为抗 HPV 药物[6-9]。HPV 病毒复制完全依赖宿主细胞 DNA 聚合酶,因此,CDV 必然可以通过其他机制发挥抗HPV作用。
我们首先研究了 CDV 对不同细胞的毒性影响,结果显示 CDV 对细胞毒性具有一定选择性,在浓度大于 125μg/ml 时,就对 HPV 阳性宫颈癌细胞 CaSki 产生毒性,而浓度大于 500 μg/ml时才会对正常细胞 HEL 产生毒性。这种细胞毒性差异或许可以解释临床上观察到的 CDV 可以特异性地破坏 HPV 感染病变组织,而对正常组织基本没影响的现象[8-9]。
高危型 HPV 诱导宫颈癌是一个多步骤的过程,E6 和 E7 在诱导过程中起关键作用,其主要通过泛素化降解细胞抑癌蛋白 p53 和 pRb,使细胞在发生基因突变或 DNA 损伤时无法进行周期调控、DNA 修复或细胞凋亡,从而引起细胞恶性转化[10-11]。因此,抑制 E6、E7 表达,重建 p53、pRb 信号通路是治疗 HPV 引发的癌症的有效策略。本研究显示,CDV 在对细胞无毒的浓度下可以降低 HPV16 阳性宫颈癌细胞 CaSki 内 E6、E7 mRNA 和蛋白水平,提高 p53 和 pRb 蛋白水平,说明 CDV 体外具有抑制 HPV16 的作用,该结果与文献[12]报道相符。我们还检测了 CDV 对 HPV 阴性宫颈癌细胞 C-33A内 p53 和 pRb 蛋白的影响,发现 p53 蛋白水平基本不变,但可以明显提升 pRb 水平。通过对比 CDV 对 HPV16 阳性和阴性宫颈癌细胞的影响,我们推测 CDV 可以通过抑制病毒间接提升细胞中 p53 水平,而对 pRb 水平的影响可以通过抑制病毒和直接激活 pRb 蛋白表达实现。另外,我们检测了 CDV 对 CaSki 和 C-33A 细胞周期的影响,结果表明,CDV 使这两种细胞的细胞周期均发生了 S 期阻滞,这也反过来印证了 CDV 有激活 p53、pRb 蛋白表达的功能。CDV 对 HPV 阳性宫颈癌细胞的抑制作用,除了实验中观察到的抑制病毒癌基因表达、提高细胞抑癌蛋白水平、阻滞细胞周期外,促进细胞凋亡也是重要原因[13-15]。
综上,CDV 可以在无毒浓度下,抑制宫颈癌细胞 CaSki 内的 HPV16 病毒蛋白 E6、E7 的表达,上调细胞抑癌蛋白 p53、pRb 的表达,并且可使细胞发生周期阻滞,从而抑制增殖。CDV 对 p53 的上调是通过解除 E6 对 p53 的降解实现的,而对 pRb 的上调既可以通过解除 E7 对 pRb 的降解又可以直接激活。本研究可以作为支持 CDV 局部用药治疗 HPV 感染相关疾病的分子理论基础。
[1] Crow JM. HPV: The global burden. Nature, 2012, 488(7413):S2-S3.
[2] Snoeck R. Papillomavirus and treatment. Antiviral Res, 2006, 71(2-3): 181-191.
[3] Bernard HU. Established and potential strategies against papillomavirus infections. J Antimicrob Chemother, 2004, 53(2):137- 139.
[4] De Clercq E, Holý A. Acyclic nucleoside phosphonates: a key class of antiviral drugs. Nat Rev Drug Discov, 2005, 4(11):928-940.
[5] De Clercq E. Therapeutic potential of Cidofovir (HPMPC, Vistide) for the treatment of DNA virus (i.e. herpes-, papova-, pox- and adenovirus) infections. Verh K Acad Geneeskd Belg, 1996, 58(1):19-47.
[6] Coremans G, Snoeck R. Cidofovir: clinical experience and future perspectives on an acyclic nucleoside phosphonate analog of cytosine in the treatment of refractory and premalignant HPV-associated anal lesions. Expert Opin Pharmacother, 2009, 10(8):1343-1352.
[7] Graupp M, Gugatschka M, Kiesler K, et al. Experience of 11 years use of cidofovir in recurrent respiratory papillomatosis. Eur Arch Otorhinolaryngol, 2013, 270(2):641-646.
[8] Snoeck R, Noel JC, Muller C, et al. Cidofovir, a new approach for the treatment of cervix intraepithelial neoplasia grade III (CIN III). J Med Virol, 2000, 60(2):205-209.
[9] Stier EA, Goldstone SE, Einstein MH, et al. Safety and efficacy of topical cidofovir to treat high-grade perianal and vulvar intraepithelial neoplasia in HIV-positive men and women. AIDS, 2013, 27(4):545- 551.
[10] Ghittoni R, Accardi R, Hasan U, et al. The biological properties of E6 and E7 oncoproteins from human papillomaviruses. Virus Genes, 2010, 40(1):1-13.
[11] Yugawa T, Kiyono T. Molecular mechanisms of cervical carcinogenesis by high-risk human papillomaviruses: novel functions of E6 and E7 oncoproteins. Rev Med Virol, 2009, 19(2):97-113.
[12] Abdulkarim B, Sabri S, Deutsch E, et al. Antiviral agent Cidofovir restores p53 function and enhances the radiosensitivity in HPV-associated cancers. Oncogene, 2002, 21(15):2334-2346.
[13] Zhang CL. Cidofovir in inhibiting Siha cell proliferation of cervical cancers. Chin Gen Pract, 2009, 12(22):2021-2024. (in Chinese)
张春丽. 西多福韦抑制宫颈癌Siha细胞增殖作用的研究. 中国全科医学, 2009, 12(22):2021-2024.
[14] Andrei G, Snoeck R, Schols D, et al. Induction of apoptosis by cidofovir in human papillomavirus (HPV)-positive cells. Oncol Res, 2000, 12(9-10):397-408.
[15] Yang Y, Zhao X, Chen W, et al. Effects of cidofovir on human papillomavirus-positive cervical cancer cells xenografts in nude mice. Oncol Res, 2010, 18(11-12):519-527.
Anti-HPV16 activity of cidofovir on cervical carcinoma cells (CaSki)
HAN Fang, LU Qiao-ni, XU Li-kun, DOU Yuan-yuan, LI Yu-huan
To investigate the antiviral activity of cidofovir (CDV) against HPV type 16 in the CaSki cervical cancer cell line and its effects on the cell cycle.
Cytotoxicities of CDV in CaSki, C-33A and HEL were assessed by MTT assay. The mRNA and protein levels of E6 and E7 oncogene were analyzed by quantitative real-time PCR (qRT-PCR) and Western blot. p53 and pRb protein levels were also detected by Western blot. The effect of CDV on cell cycle was analyzed by flow cytometry.
MTT assay showed that cytotoxicity of CDV was much greater in cervical carcinoma cells than in normal cells. In HPV16-positive CaSki cervical carcinoma cell line, qRT-PCR results showed that E6 and E7 mRNA levels were decreased. Meanwhile, Western blot analysis revealed that E6 and E7 protein levels had the same trend with mRNA. However, p53 and pRb protein expressions were found to be increased simultaneously. Moreover, pRb protein expression was found to be increased in the HPV16-negative C-33A cervical carcinoma cell line, while the level of p53 protein didn’t change. In addition, flow cytometry assay showed CDV could induce S phase arrest in both cervical carcinoma cell lines.
This study showed that cidofovir has antiviral activity through suppressing E6 and E7 oncogene expressions and could induce S phase arrest at nontoxic concentration.
Antiviral agents; Human papillomavirus 16; Uterine cervical neoplasms; Cidofovir
LI Yu-huan, Email: yuhuanlibj@126.com
10.3969/cmba.j.issn.1673-713X.2014.05.005
“重大新药创制”国家科技重大专项(2012ZX09301-002-001- 015)
李玉环,Email:yuhuanlibj@126.com
2013-12-04
Author Affiliations: Laboratory of Oncology, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China(HAN Fang, LU Qiao-ni, LI Yu-huan); Academy of Military Medical Sciences, Beijing 100050, China (XU Li-kun, DOU Yuan-yuan)
