BAMBI通过促进ERK1/2磷酸化抑制猪前体脂肪细胞分化
2014-10-31麦茵张振宇董培越杨浩杨公社孙世铎
麦茵,张振宇,董培越,杨浩,杨公社,孙世铎
西北农林科技大学 动物脂肪沉积与肌肉发育实验室,陕西 杨凌 712100
骨形成蛋白和激活素的跨膜抑制剂 (BMP and Activin receptor Membrane Bound Inhibitor,BAMBI)于1998年在非洲爪蟾蜍卵母细胞中筛选与 BMP4基因表达谱中发现,而在 1999年Onichtchouk等在非洲爪蟾蜍中也发现了一种与BMP4表达模式相似的互补 DNA,正式将其命名为BAMBI[1-2]。BAMBI蛋白质的氨基酸序列与nma有89%的相似性,因此BAMBI也可称为nma,研究证明 nma位于人的 10号染色体p11.2-p12.3区域[3]。而组织差异实验也表明,nma即BAMBI在人肝脏髓质、胎盘以及脾脏中高表达,在肾脏皮质、肝脏、前列腺和肠中稳定表达,在肺及肌肉中不表达[3]。随后在小鼠中的组织差异表达则表明,BAMBI在小鼠的心脏、肺以及睾丸中高表达,在脑、肝脏以及肾脏中低表达[4]。
大量的研究证明,BAMBI在各个组织中广泛表达,且在脊椎动物中保守表达,因此BAMBI可能参与机体的多种代谢过程,是一种重要的功能型蛋白。随着研究的深入,发现 BAMBI是一种横跨膜糖蛋白,其编码的产物含有260个氨基酸[1]。BAMBI的结构与TGF超家族的Ⅰ型受体(TGF-βRΙ/BMP-RΙ)的结构相似,其胞外域与 TGF-βRΙ/BMP-RΙ十分相似,但是其胞内域与之相比,较短且缺乏丝氨酸/苏氨酸激酶结构域[1,4],故其被认为是TGF-β信号通路的伪受体。目前,BAMBI的研究主要集中在肿瘤细胞、胚胎发育、牙形成以及血管生成方面的作用研究[5-7]。最近的研究表明,敲除 BAMBI后增加了由TGF-β刺激的SMAD1/5和ERK1/2的磷酸化进而调控血管生成[7]。ERK1/2信号通路在调控细胞增殖与分化等生理学过程中发挥重要的作用。研究表明,ERK1/2在 3T3-L1细胞脂肪形成的过程中起负调控的作用[8-9]。
由以上的研究推测,BAMBI可能通过ERK1/2信号通路脂肪细胞分化。为验证BMABI的生物学功能,构建慢病毒干扰载体,感染猪前体脂肪细胞,探讨其对脂肪细胞分化的影响,为深入研究其在猪前体脂肪细胞分化过程中调控机制奠定基础。
1 材料与方法
1.1 材料
1–3日龄健康关中黑猪。慢病毒载体系统和293T细胞系由实验室保存。限制性内切酶BamHⅠ及XhoⅠ,T4 DNA连接酶,Taq DNA聚合酶,反转录和Real-time PCR试剂盒、Trizol购于日本TaKaRa公司;Opti-MEM、DMEM、DMEM/F12、Ⅰ型胶原酶、胎牛血清均购自美国Gibco公司;质粒小量提取试剂盒、凝胶回收试剂盒均购于BioFlux公司;Western blotting所用抗体均购自Santa公司;其他试剂均为国产或进口分析纯。
1.2 方法
1.2.1 猪 pLentiH1-BAMBI shRNA的构建
根据 NCBI中报道的猪 BAMBI基因序列(GenBank Accession No. NM_001201485),利用Invitrogen公司在线软件 ranidesigener (https://rnaidesigner.invitrogen.com/rnaiexpress/)设计BAMBI干扰引物,在中间添加loop环和两端添加BamHⅠ、XhoⅠ酶切位点后,由上海生工生物工程有限公司合成3对shRNA Oligo DNA序列 (表 1)。将合成的单链寡核苷酸退火形成双链,与经BamHⅠ和XhoⅠ双酶切后的pLenti-H1载体连接,产物转化 DH5α感受态细胞,挑选阳性克隆扩繁并提取质粒,酶切鉴定正确后,送南京金斯瑞公司测序。
1.2.2 病毒包装、浓缩及滴度测定
磷酸钙法转染:转染前 24 h以 2×104/cm2密度将 HEK293T细胞接种到 10 cm皿中,加8 mL含10% FBS的DMEM培养基,包装前2−4 h将培养基更换为 8 mL新鲜培养基,10 μg pLentiH1-Akt2 shRNA,6 μg VSVG,6 μg Δ8.9加入高压灭菌的双蒸水中,使总体积为480 μL,涡旋使混匀;将520 μL 0.5 mol/L CaCl2加入质粒混合物中,涡旋混匀;将 20 μL 70 mmol/L NaH2PO4和980 μL的HN缓冲液混匀为HNP缓冲液,将1 000 μL HNP缓冲液用200 μL移液枪边涡旋边滴加入质粒混合物中;室温静置15 min以形成沉淀;用200 μL移液枪将混合物滴加入培养皿中;14−16 h后换为新鲜培养基;48 h和72 h后收集含有病毒的上清液,3 000 r/min离心10 min,去除细胞碎片,0.45 μm的PVDF膜过滤。按照10倍倍比稀释病毒,得到100−10–6浓度梯度,分别感染293T细胞,2 d后观察荧光表达情况,计算病毒滴度,计算公式为:病毒滴度(TU/mL)=GFP阳性细胞数×病毒稀释倍数/0.01 mL。
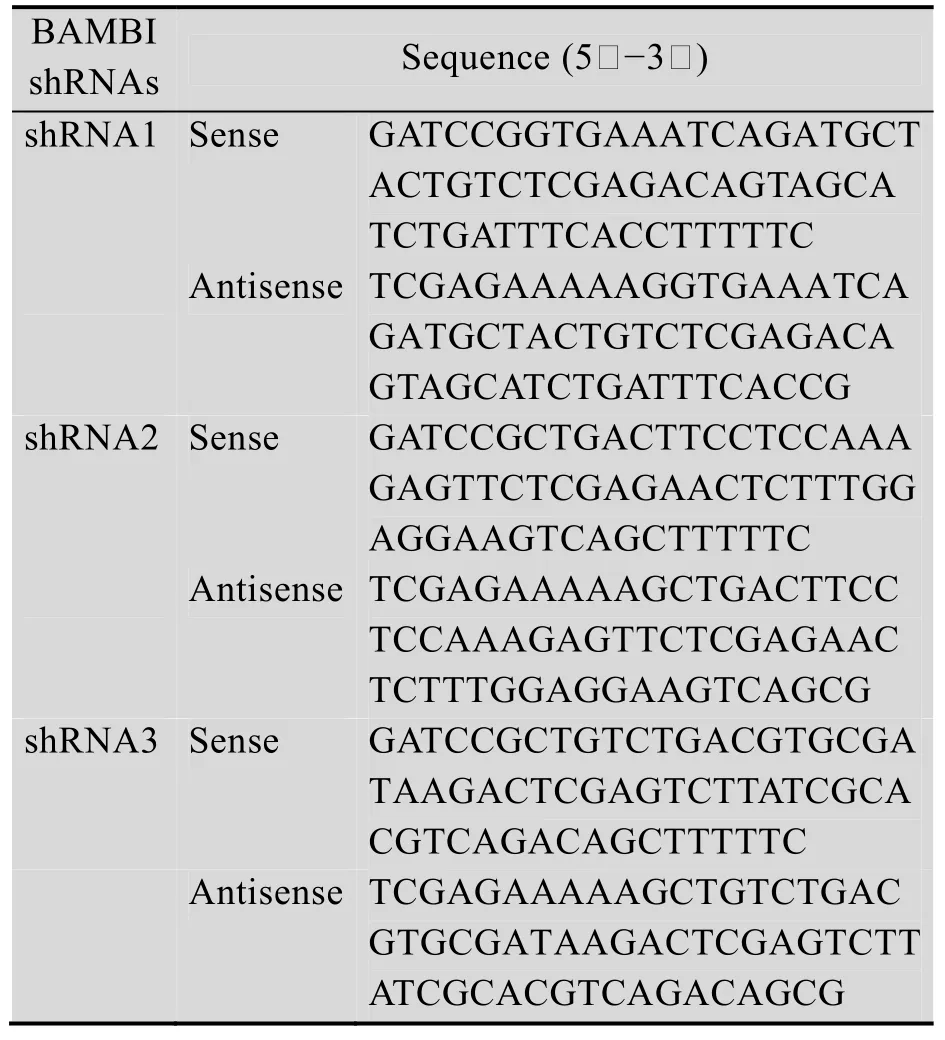
表1 猪BAMBI基因shRNA设计Table 1 shRNA oligo DNA targeting porcine BAMBI CDS
1.2.3 猪前体脂肪细胞培养
无菌状态下采集健康 3日龄仔猪背部皮下脂肪组织,用含双抗的PBS缓冲液浸泡、冲洗3次,剪成约1 mm3的组织块,向剪碎的组织块中加入1 mg/mLⅠ型胶原酶消化液,置37 ℃振荡摇床内温育60−80 min后取出,经200目钢筛过滤、离心、重悬以后,以5.0×104个/cm2密度接种至培养皿中,置于37 ℃、5% CO2培养箱内培养,12 h后更换培养基,之后每2 d换液1次。
1.2.4 慢病毒感染猪前体脂肪细胞
待3.5 cm培养皿中猪前体脂肪细胞融合率达 70%−80%时,吸去培养皿中培养基,加入2 mL 病毒原液,200 μL FBS,2 μL 聚凝胺,设置空白对照,孵育24 h后,换为新鲜培养基。
1.2.5 Real-time PCR分析
猪前体脂肪细胞感染慢病毒48 h后观察荧光强度,收集细胞,PBS洗2次后,加入1 mL Trizol试剂,按TaKaRa提供的Trizol使用说明书提取细胞总 RNA[10]。根据 GenBank中猪BAMBI、β-actin、PPARγ和 ap2 mRNA 序列,应用Primer Primer5.0设计PCR扩增引物,送上海生工公司合成,引物相关参数见表2。
1.2.6 Western blotting
猪前体脂肪细胞感染慢病毒72 h后观察荧光强度,收集细胞,用蛋白裂解液提取细胞总蛋白;猪前体脂肪细胞感染慢病毒2 d后,诱导分化,用含有1 μmol/L地塞米松,5 μg/mL胰岛素,0.5 μmol/L IBMX (3-异丁基-1-甲基黄嘌呤)的DMEM/F12诱导液诱导2 d,后用含5 μg/mL胰岛素的DMEM/F12的维持液培养4 d后弃去培养基,收集细胞,用蛋白裂解液提取细胞总蛋白,用BCA法测定蛋白浓度,调整总蛋白浓度后,按1∶4加入5×上样缓冲液,煮沸15 min,用 5%−12%预制胶进行电泳分离,电泳完毕后电转移到硝酸纤维素膜上,用5%脱脂牛奶室温封闭2 h,一抗孵育2 h,二抗孵育2 h,最后用化学发光法显示结果。
1.2.7 油红O染色和油红O提取比色法
病毒感染猪前体脂肪细胞后,进行成脂诱导分化,6 d后吸出培养基,PBS 3次,4%多聚甲醛固定45 min,PBS洗3次,油红O工作液染色45 min,PBS洗3次,倒置显微镜下观察照相。另取一部分细胞按照以上方法固定、染色、冲洗后,加入2 mL异丙醇提取与脂滴结合的油红O染料,以相同处理为空白对照,在波长510 nm处测量,记录吸光度值 (OD)。
1.2.8 数据统计分析
实验数据以平均值±标准误 (x±s)表示,采用SPSS19.0统计分析软件One-way ANOVA进行方差分析与显著性检验。
2 结果
2.1 pLentiH1-BAMBI shRNA构建与包装
将合成的3对shRNA Oligo DNA退火后,电泳可见一条单一的,大小为59 bp的条带 (图1A)。随后,对pLentiH1空载质粒进行酶切,酶切后电泳可见2个片段,大片段为7 612 bp,小片段为209 bp (图1B),说明酶切成功,可用于后续实验。胶回收大片段产物,与退火产物进行连接,转化DH5α,涂板后挑取阳性克隆,摇菌,提质粒,用BamHⅠ和XhoⅠ双酶切重组质粒pLentiH1-BAMBI shRNA得到长度为59 bp的片段 (图1C),后送公司测序验证,测序结果正确,载体构建成功。
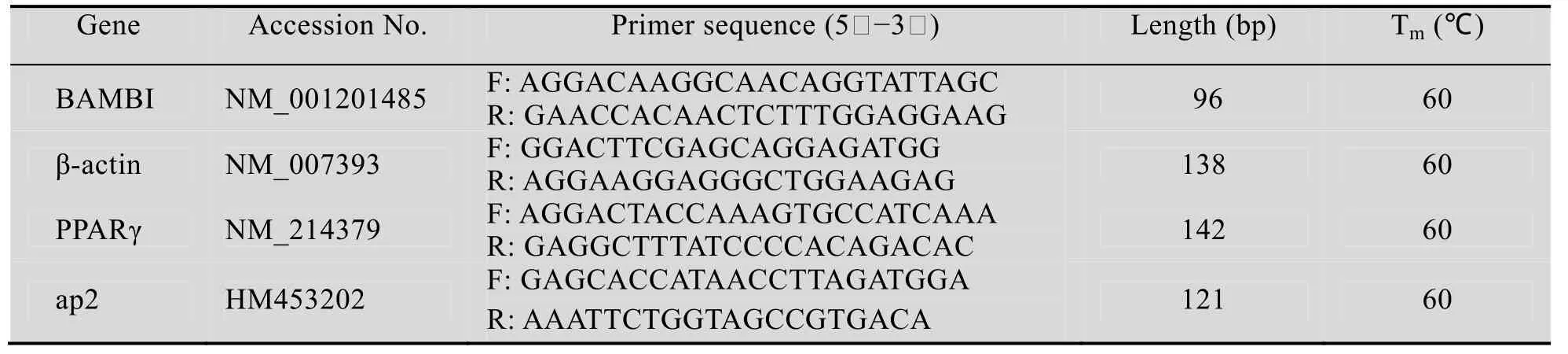
表2 Real-time PCR特异引物Table 2 Specific primers for Real-time PCR
2.2 慢病毒的包装及感染猪前体脂肪细胞
将慢病毒重组质粒、包装质粒Δ8.9和包装质粒VSVG共转染293T细胞,分别于24、48和72 h在倒置荧光显微镜下观察绿色荧光蛋白(GFP)表达情况。结果显示,48 h后细胞生长良好,已经有90%以上细胞表达绿色荧光蛋白,表明包装成功 (图2)。同时,在48、72 h收集病毒上清液。待猪前体脂肪细胞细胞融合率达到70%−80%时,用病毒上清液感染猪前体脂肪细胞,48 h后荧光显微镜下观察,可见50%以上的细胞发绿色荧光 (图 3),表明慢病毒已经整合到细胞基因组,并开始表达GFP和干扰片段。
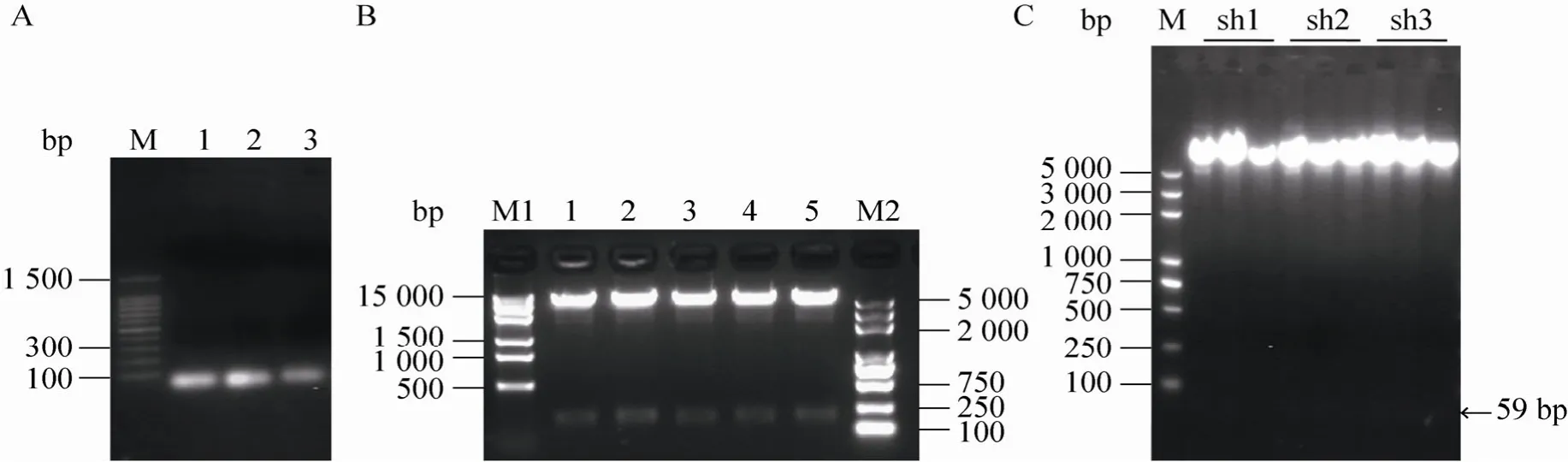
图1 BAMBI慢病毒载体的构建Fig. 1 Construction of BAMBI lentivirus vectors. (A)shRNA Oligo DNA was annealed to double-stranded DNA.M: DNA marker; 1−3: BAMBI shRNA1, 2 and 3 Oligo DNA annealing product (58 bp). (B)pLentiH1 blank plasmids was identified by restriction enzyme digestion BamHⅠand XhoⅠ). M1: DNA marker 1; 1−5: enzyme digestion product by BamHⅠand XhoⅠ; M2: DNA marker 2; (C)pLentiH1-BAMBI shRNA recombinant plasmids were identified by restriction enzyme digestion (BamH I and XhoⅠ).M: DNA marker; sh1–sh3: enzyme digestion product of pLentiH1-BAMBI shRNA1, 2 and 3.

图2 BAMBI重组慢病毒的产生Fig. 2 Production of BAMBI recombinant lentivirus. (A, E)Transfected with pLentiH1-BAMBI shRNA1. (B, F)Transfected with pLentiH1-BAMBI shRNA2. (C, G)Transfected with pLentiH1-BAMBI shRNA2. (D, J)Transfected with pLentiH1 scrambled. (A, B, C, D)Examined under amicroscope (40×). (E, F, G, H)Examined under amicroscope (100×).
2.3 慢病毒感染猪前体脂肪细胞后对 BAMBI基因表达的影响
用 pLentiH1-BAMBI shRNA1、2、3以及scrambled慢病毒感染猪前体脂肪细胞,48 h和72 h后分别收集RNA和蛋白,采用real-time PCR检测干扰片段对 BAMBI基因的干扰效率,其中shRNA2的干扰效率达到 60%,高于 50%,达到预期效果,可用于后续实验 (图4A),将其重新命名为sh-BAMBI。Western blotting检测结果也显示,感染了shRNA2的猪前体脂肪细胞,BAMBI蛋白表达显著降低 (图4B)。结果表明,构建的慢病毒能够有效抑制猪前体细胞中BAMBI的表达。

图3 重组慢病毒感染猪前体脂肪细胞2 d后GFP表达Fig. 3 GFP expression in porcine preadipocytes infected with lentivirus 2 days later (100×). (A–C)Porcine preadipocyte infected by lentivirus containing BAMBI shRNA1, 2 and 3. (D)Porcine preadipocyte infected by lentivirus containing scrambled, as control.
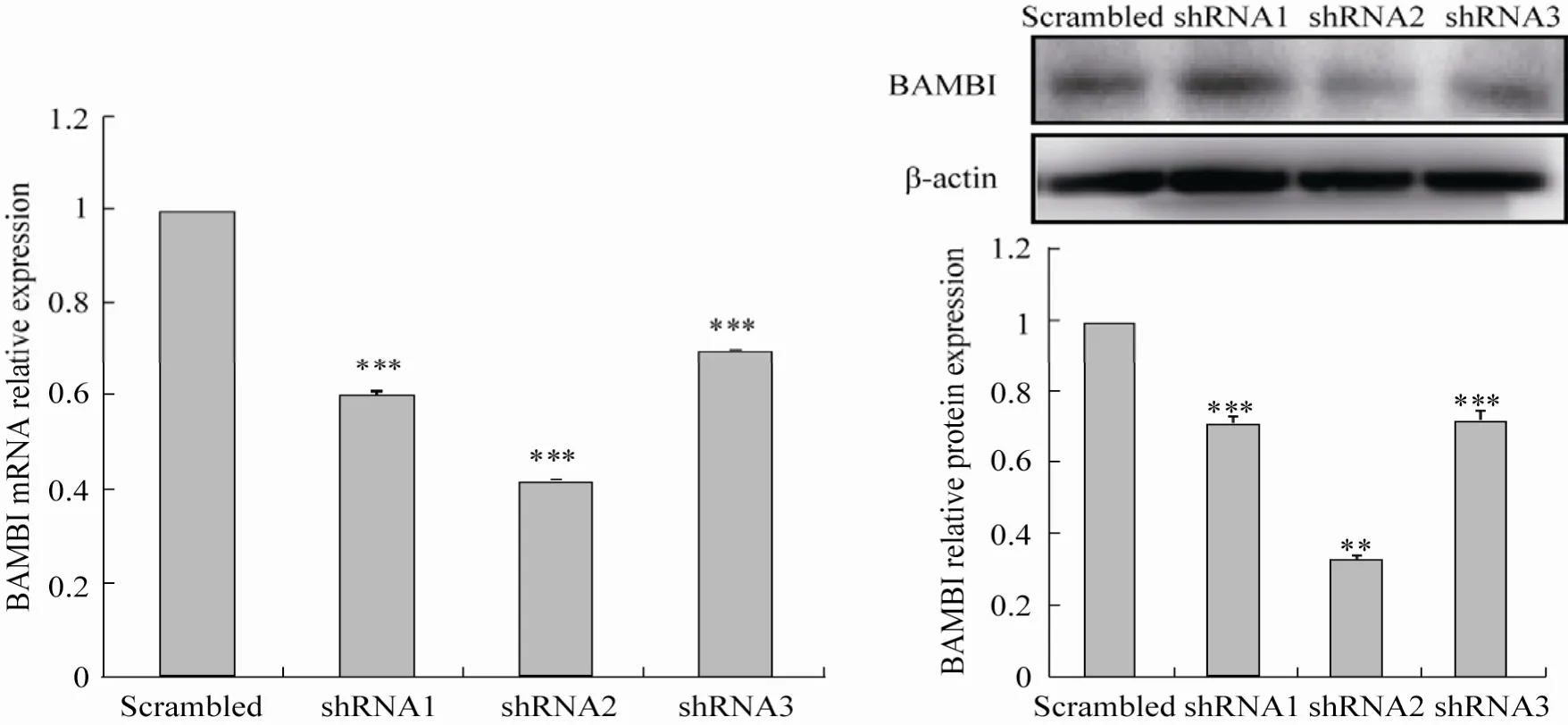
图4 重组慢病毒感染猪前体脂肪细胞后BAMBI的mRNA及蛋白水平的表达Fig. 4 Expression of BAMBI mRNA and protein in porcine preadipocytes infected with lentiviru. (A)Real-time PCR analysis BAMBI and β-actin mRNA expression in porcine preadipocytes infected by lentivirus including BAMBI and scrambled shRNA. Noinfected and scrambled as controls, β-actin as internal control. (B)Western blotting analysis of BAMBI and β-actin protein expression in porcine preadipocytes infected by lentivirus including BAMBI and scrambled shRNA. Noinfected and scrambled as controls, β-actin as internal control. ** P<0. 01; *** P<0.001.
2.4 干扰BAMBI后促进猪前体脂肪细胞分化
慢病毒病毒感染猪前体脂肪细胞,进行诱导分化,6 d后进行油红O染色及提取,同时,提取细胞总RNA,利用Real-time PCR检测细胞中过氧化物酶体增殖物激活受体γ (PPARγ)、和脂肪细胞型脂肪酸结合蛋白 (ap2)mRNA 表达情况。油红O染色结果表明,BAMBI干扰后细胞中的脂滴量明显增加 (图5A)。油红O提取比色法结果也显示,降低BAMBI的表达促进了猪前体脂肪细胞脂质累积 (图 5B)。Real-time PCR检测结果则表明,BAMBI干扰处理组与对照组相比PPARγ和ap2 mRNA表达显著升高,其中PPARγ水平上调约2.2倍,ap2水平上调约2.1倍 (图6A)。蛋白水平的检测表明,干扰BAMBI后PPARγ和ap2的蛋白水平升高了,此外,磷酸化的 ERK1/2水平降低了 (图 6B)。因此,BAMBI可能通过ERK1/2信号通路抑制猪前体脂肪细胞分化。
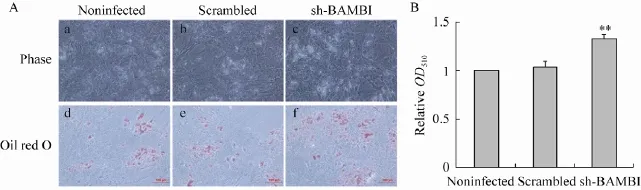
图5 BAMBI干扰对猪前体脂肪细胞分化的影响Fig. 5 Effects of interference of BAMBI on pig preadipocyte differentiation. (A)Oil red O staining of porcine preadipocytesat at day 6 after differentiation (100×). After infected by lentivirus preadipocytes were induced for 6 days to differentiate by cocktail way. a, b and c: adipocytes before staining; d, e and f: adipocytes by oil red O staining. a and d: adipocytes not be infected lentivirus; b and e: adipocytes infected by lentivirus includingnonsense shRNA; c and f: adipocytes infected by lentivirus including BAMBI shRNA2. (B)Quantitative analysis of the Oil Red O staining, the accumulation of lipid droplets in shRNA2 treated group was increased. **P<0.01.

图6 猪前体脂肪细胞干扰BAMBI后对PPARγ和ap2的表达以及ERK1/2信号通路的影响Fig. 6 Effect of PPARγ, ap2 and ERK1/2 signaling pathway in porcine preadipocytes lacking BAMBI. Preadipocytes were infected with lentivirus and induced for 6 days by cocktail way. Total RNAs were collected 6 days later. The expression levels of PPARγ and ap2 were measured by real-time PCR and Western blotting, the activity of ERK1/2 was detected by Western blotting. Results were normalized by β-actin. (A)The mRNA levels of PPARγ and ap2. (B)The protein expression of PPARγ, ap2 and ERK1/2 signaling pathway. *P<0.05, **P<0.01. Noninfected: adipocytes did not be infected by lentivirus; scrambled: infected by lentivirus including scrambled shRNA; sh-BAMBI: adipocytes infected by lentivirus including BAMBI shRNA2; p-ERK1/2: the phosphorylation level of ERK1/2.
3 讨论
肥胖是机体内脂肪细胞数目和大小的增加导致脂肪组织过度积累造成的,它成为21世纪人类生存危机之一[11]。肥胖更容易引发Ⅱ型糖尿病、高血压、高血脂、动脉硬化等疾病,因此,了解脂肪沉积的调控机制成为近年来的热点问题[12]。大量研究表明,脂肪形成过程受到一个复杂的网络调控。本研究发现BAMBI可能是一个新的调节脂肪细胞分化的因子。
近年来,BAMBI作为TGF-β超家族的伪受体,在肿瘤细胞中有大量的研究。研究发现,在结肠癌细胞中过表达 BAMBI阻断了癌细胞对 TGF-β信号通路的反应[13]。人的 BAMBI基因 (hBAMBI)可以抑制TGF-β和BMP介导的转录应答以及TGF-β诱导的R-Smads磷酸化,hBAMBI还可以通过与Smad7、ALK5形成三元复合物抑制了ALK5和R-Smads的相互作用从而抑制TGF-β信号通路[14]。Sekiya等[15]证明,TGF-β信号通路中的Smad3和Smad4与BAMBI的启动子相结合,从而使得 TGF-β信号通路调节BAMBI的转录。而最近的研究则发现,作为伪受体的BAMBI在血管形成过程中通过TGF-β信号通路调节 ERK1/2的磷酸化水平发挥作用[7]。研究显示,ERK1/2信号通路在脂肪细胞分化过程中发挥关键的作用[16]。在分化的早期阶段抑制 ERK1/2信号通路可以抑制脂肪的形成[17]。虽然有研究认为ERK1/2信号通路促进了脂肪细胞分化[18]。但是,许多的研究也表明ERK1/2信号通路在脂肪形成过程中发挥负调控作用。MacDougald等发现,持续的激活ERK1/2信号通路可以抑制脂肪细胞分化[19]。ERK1/2信号通路是通过增加PPARγ的磷酸化水平,从而抑制其活性,进而抑制脂肪形成[16,20]。此外,Zang等发现Brd2增加ERK1/2的磷酸化水平,进而增加了PPARγ的磷酸化水平,导致PPARγ的降解,最后抑制脂质沉积[21]。因此,我们推测BAMBI可能通过调控ERK1/2的活性调控脂肪形成。
本研究采用了慢病毒介导的RNA干扰,该方法可应用于难以干扰的细胞,并且在感染后能与宿主细胞基因整合,实现长期的稳定表达[22]。此外,使用磷酸钙法对慢病毒干扰载体进行包装,与脂质体法相比,前者可达到后者的转染效率,并且不需更换无双抗培养基,降低了细胞污染的概率,此外,还节约了实验的成本[23]。而为了进一步保证慢病毒的侵染效率,在侵染时慢病毒中混入了0.1%的polybrene。实验中,成功构建了猪BAMBI干扰载体,研究结果表明,构建的BAMBI慢病毒干扰载体可有效的干扰BMABI的mRNA和蛋白的表达。为进一步研究 BAMBI对脂肪细胞分化的作用机理奠定了基础。此外,以猪前体脂肪细胞作为研究材料,一方面可以为 BAMBI调控猪脂肪沉积,进而影响胴体品质提供思路;另一方面,猪在生理特性与脂肪沉积的调控机理有很高的相似性[24],是合适的动物模型,可为治疗肥胖及其相关疾病提供新的靶点。
通过油红O染色及油红O提取比色法检测发现,BAMBI慢病毒干扰载体干扰BAMBI表达后,猪前体脂肪细胞中的脂质积累增加了,说明抑制 BAMBI的表达能够促进猪前体脂肪细胞分化。PPARγ和 ap2分别在启动前体脂肪细胞分化与脂肪细胞成熟阶段发挥重要的作用,因此,它们作为脂肪细胞分化的标志基因[25-26]。为了进一步确定干扰BAMBI后对猪脂肪形成的影响,我们通过实时定量PCR检测了PPARγ和 ap2的表达情况,检测结果表明,干扰BAMBI后,PPARγ和ap2的表达水平显著上升。此外,我们发现干扰 BAMBI后,ERK1/2的磷酸化水平降低了,即 ERK1/2的活性降低了。因此,BAMBI基因可能通过促进 ERK1/2的活性抑制猪前体脂肪细胞分化。但是,BAMBI是否是通过提高ERK1/2的活性,进而降解抑制PPARγ的活性,从而调控脂肪形成还需要进一步的研究。
综上所述,本研究成功构建了猪 BAMBI慢病毒干扰载体,获得高感染力的病毒并成功感染猪前体脂肪细胞,有效地抑制了 BAMBI的表达。BAMBI沉默通过抑制ERK1/2的活性促进了猪前体脂肪细胞分化,表明BAMBI通过ERK1/2信号通路对猪前体脂肪细胞分化起负调控的作用。这些结果都为进一步研究 BAMBI调控脂肪细胞分化的作用机理提供了理论依据。
[1]Onichtchouk D, Chen YG, Dosch R, et al. Silencing of TGF-beta signalling by the pseudoreceptor BAMBI. Nature, 1999, 401(6752): 480–485.
[2]Gawantka V, Pollet N, Delius H, et al. Gene expression screening in Xenopus identifies molecular pathways, predicts gene function and provides a global view of embryonic patterning.Mech Dev, 1998, 77(2): 95–141.
[3]Degen WG, Weterman MA, van Groningen JJ, et al. Expression of nma, a novel gene, inversely correlates with the metastatic potential of human melanoma cell lines and xenografts. Int J Cancer,1996, 65(4): 460–465.
[4]Knight C, Simmons D, Gu TT, et al. Cloning,characterization, and tissue expression pattern of mouse Nma/BAMBI during odontogenesis. J Dent Res, 2001, 80(10): 1895–1902.
[5]Fritzmann J, Morkel M, Besser D, et al. A colorectal cancer expression profile that includes transforming growth factor beta inhibitor BAMBI predicts metastatic potential. Gastroenterology,2009, 137(1): 165–175.
[6]Pils D, Wittinger M, Petz M, et al. BAMBI is overexpressed in ovarian cancer and co-translocates with Smads into the nucleus upon TGF-beta treatment. Gynecol Oncol, 2010, 117(2):189–197.
[7]Guillot N, Kollins D, Gilbert V, et al. BAMBI regulates angiogenesis and endothelial homeostasis through modulation of alternative TGFβ signaling. PLoS ONE, 2012, 7(6): e39406.
[8]Cargnello M, Roux PP. Activation and function of the MAPKs and their substrates, the MAPK-activated protein kinases. Microbiol Mol Biol Rev, 2011, 75(1): 50–83.
[9]Engelman JA, Berg AH, Lewis RY, et al.Constitutively active mitogen-activated protein kinase kinase 6 (MKK6)or salicylate induces spontaneous 3T3-L1 adipogenesis. J Biol Chem,1999, 274(50): 35630–35638.
[10]Zhou J, Chen KM, Ge BF, et al. Proliferation and differentiation of rat bone marrow mesenchymal stem cells in static electromagnetic fields of different intensities in vitro. Chin J Biochem Mol Biol, 2011, 27(7): 650–657 (in Chinese).周健, 陈克明, 葛宝丰, 等. 不同强度静电磁场对体外培养骨髓间充质干细胞增殖与分化的影响. 中国生物化学与分子生物学报, 2011, 27(7):650–657.
[11]Kersten S. Mechanisms of nutritional and hormonal regulation of lipogenesis. EMBO Rep,2001, 2(4): 282–286.
[12]Nakagami H. The mechanism of white and brown adipocyte differentiation. Diabetes Metab J, 2013,37: 85–90.
[13]Sekiya T, Adachi S, Kohu K, et al. Identification of BMP and activin membrane-bound inhibitor(BAMBI), an inhibitor of transforming growth factor-beta signaling, as a target of the beta-catenin pathway in colorectal tumor cells. J Biol Chem, 2004, 279(8): 6840–6846.
[14]Yan X, Lin Z, Chen F, et al. Human BAMBI cooperates with Smad7 to inhibit transforming growth factor-beta signaling. J Biol Chem, 2009,284(44): 30097–30104.
[15]Sekiya T, Oda T, Matsuura K, et al.Transcriptional regulation of the TGF-beta pseudoreceptor BAMBI by TGF-beta signaling.Biochem Biophys Res Commun, 2004, 320(3):680–684.
[16]Hu E, Kim JB, Sarraf P, et al. Inhibition of adipogenesis through MAP kinase-mediated phosphorylation of PPARgamma. Science, 1996,274(5295): 2100–2103.
[17]Tang QQ, Otto TC, Lane MD. Mitotic clonal expansion: a synchronous process required for adipogenesis. Proc Natl Acad Sci USA, 2003,100(1): 44–49.
[18]Rosen ED, MacDougald OA. Adipocyte differentiation from the inside out. Nat Rev Mol Cell Biol, 2006, 7: 885–896.
[19]MacDougald OA, Mandrup S. Adipogenesis:forces that tip the scales. Trends Endocrinol Metab, 2002, 13(1): 5–11.
[20]Adams M, Reginato MJ, Shao D, et al.Transcriptional activation by peroxisome proliferator-activated receptor gamma is inhibited by phosphorylation at a consensus mitogenactivated protein kinase site. J Biol Chem, 1997,272(8): 5128–5132.
[21]Zang K, Wang J, Dong M, et al. Brd2 inhibits adipogenesis via the ERK1/2 signaling pathway in 3T3-L1 adipocytes. PLoS ONE, 2013, 8(10):e78536.
[22]Cockrell AS, Kafri T. Gene delivery by lentivirus vectors. Mol Biotechnol, 2007, 36(3): 184–204.
[23]Wang P, Xiong Y, Yang GS, et al. Knockdown of Akt2 by lentivirus vector-mediated RNA interference suppresses differentiation of porcine preadipocytes. Chin J Biochem Mol Biol, 2012,28(1): 53–60 (in Chinese).王平, 熊燕, 杨公社, 等. 慢病毒载体介导的RNA干扰 Akt2表达抑制猪前体脂肪细胞分化.中国生物化学与分子生物学报, 2012, 28(1):53–60.
[24]Belliger DA, Merrichks EP, Nichols TC. Swine models of type 2 diabetes mellitus: insulin resistance, glucose tolerance, and cardiovascular complications. ILAR J, 2006, 47: 243–245.
[25]Sarjeant K, Stephens JM. Adipogenesis. Cold Spring Harb Perspect Biol, 2012, 4(9): a008417.
[26]Furuhashi M, Tuncman G, Görgün CZ, et al.Treatment of diabetes and atherosclerosis by inhibiting fatty-acid-binding protein aP2. Nature,2007, 447(7147): 959–965.
