小鼠睾丸注射不同转染试剂和注射方法对外源基因表达的影响
2014-10-31戴建军李翔吴彩凤张树山张廷宇张德福
戴建军,李翔,吴彩凤,张树山,张廷宇,张德福
1 上海农业科学院畜牧兽医研究所,上海 201106
2 上海农业遗传育种重点实验室 动物遗传工程研究室,上海 201106
睾丸注射是一种操作简便、成本低和适宜于大群生产的精子介导的转基因方法。1999年,Sato等[1]将外源基因注入小鼠睾丸,成功获得了转基因小鼠,并且转基因可以稳定遗传到下一代,证实了睾丸注射可以制备转基因动物。此后睾丸注射法制备转基因动物取得较快发展,目前已经获得了转基因小鼠[2-3]、兔[3]、猪[4]、绵羊[5]和鸡[6-7]等动物。但是睾丸注射法仍然存在不足,主要表现在转基因效率不稳定、目的基因随机插入、片段容易丢失和不能准确表达等。
精子虽具有捕获外源基因的能力,但效率相对较低,需利用一些试剂辅助以提高转染效率。Kim等[8]首先在小鼠和猪睾丸注射中利用商业化的脂质体,证实了其可以成功对动物体内生精细胞进行转染。此后,研究者相继发现了多种可以提高动物生精细胞体内转染效率的转染试剂,如 DMSO (二甲基亚砜,Dimethyl sulfoxide)和 DMN (2,6-萘二甲酸二甲酯,2,6-Naphthalenedicarboxylicacid)等,但是转染效率仍不高,相关研究仍需深入进行[3,9]。睾丸注射主要有睾丸网注射、曲精细管注射和间质注射 3种方法。丁晓麟等利用睾丸网注射法获得了转基因小鼠,63只仔鼠中有2只PCR鉴定呈阳性[10]。Kanatsu -Shinohara等利用逆转录病毒作为载体注入未成熟小鼠曲精细管亦获得转基因仔鼠,平均效率为 2.8%[11]。Shen等使用DMSO处理外源DNA,通过睾丸间质注射后收集小鼠精子后进行体外授精,结果41.7%的胚胎表达绿色荧光;在兔睾丸进行注射后,56.3%的仔兔 PCR鉴定呈阳性[3]。孙敏等采用睾丸间质注射的方法,成功获得了转基因鸡,后代 PCR检测的阳性率为 27.27%[6]。然而,不同的睾丸注射方法所获得的转染效率差异很大,且不同文献中所获得的结果也不一致。
本研究拟从睾丸组织损伤和转基因效率两个方面,对3种转染试剂 (两种脂质体LipofectamineTMLTX & PLUSTM和Lipofectamine 2000,一种纳米化载体PAMAM-D)和3种睾丸注射方法 (睾丸网注射、曲精细管注射和睾丸间质注射)进行对比,旨在探索一种对小鼠睾丸损伤小、转基因效率高的注射方法,为睾丸注射法在猪等大家畜中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
6−7周龄昆明白小鼠由复旦大学医学院实验动物中心提供;pEGFP-C1质粒由上海市农业科学院畜牧兽医研究所易建中研究员惠赠,该质粒具有卡那霉素抗性,EGFP基因在细胞中由CMV启动子启动,大小4.7 kb;LipofectamineTMLTX & PLUSTM和 Lipofectamine 2000购自Invitrogen公司;纳米化PAMAM-D购自Qiagen公司;其余生化试剂均购自Sigma公司;引物合成和测序由生工生物工程股份有限公司完成。
1.2 转染液制备
1) LipofectamineTMLTX & PLUSTM转染液配制方法如下:在100 μL OPTI-MEM中按照顺序加入 1 μL pEGFP-C1 质粒 (1 μg/μL),1.0 μL PLUS,轻轻混匀,静置5 min,1.5 μL LTX,混匀,静置30 min,注射前加入终浓度0.2%的台盼蓝为指示剂。
2) Lipofectamine 2000转染液配制方法如下:分别取两管 50 μL OPTI-MEM,分别加入2 μL pEGFP-C1 质 粒 (1 μg/μL)和 2 μL Lipofectamine 2000,室温放置5 min将两者温和混匀,静置30 min;注射前加入终浓度0.2%的台盼蓝为指示剂。
3) PAMAM-D转染液配制方法如下:在100 μL OPTI-MEM 中加入 3 μL pEGFP-C1 质粒(1 μg/μL),混匀,3 μL PAMAM-D 混匀,短暂离心,室温下静置10−15 min,注射前加入终浓度0.2%的台盼蓝为指示剂。
1.3 睾丸注射
小鼠麻醉后进行术部消毒,用眼科剪在小鼠下腹部两侧分别纵切0.8−1 cm切口,暴露睾丸和附睾,利用外径60 μm显微注射针和自制口吹注射管进行注射。睾丸网注射方法如下:显微镜下找出睾丸血管蒂,其正下方0.2 mm的池状结构即是睾丸网,将显微注射针平行进针插入睾丸网腔内进行注射。曲精细管注射方法如下:显微镜下观察睾丸内曲精细管走向,顺曲精细管方向将显微注射针插入曲精细管内进行注射。睾丸间质注射方法如下:取睾丸长轴两端为注射位点,避开血管垂直进行注射。
小鼠每侧睾丸分别注入约为30 μL转染液,当大部分睾丸变成蓝色时注射完成,两侧睾丸利用相同的方法注射。注射小鼠单笼饲养 30 d后,每组10只小鼠随机选取5只与发情母鼠1∶2合笼,次日检查阴道栓,见栓者单笼饲养,产仔后检测仔鼠转基因阳性率和EGFP表达情况;每组剩余 5只小鼠解剖,附睾取精,计算精子总数、活力和精子EGFP阳性率。
1.4 小鼠精子检测睾丸注射
小鼠精子检测方法如下:小鼠颈椎脱臼处死,打开腹部,取出小鼠附睾尾部及输精管,快速置于37 ℃,1 mL 预热HTF培养液中,用针头撕碎附睾和输精管使精子游出,放入1.5 mL的 EP管中,37 ℃的二氧化碳培养箱中孵育10 min,吸取上清液用于精子密度、活力和精子荧光检测。
1) 精子密度与精子活力检测:精子在二氧化碳培养箱中孵育10 min后,立即取10 μL精液于490 μL的HTF中等温稀释,采用精子全自动分析仪检测精子密度和精子活力。
2) 精子荧光检测:取 10 μL精液于490 μL多聚甲醛中固定,混匀,取 10 μL含精子的多聚甲醛液体置于载玻片上,加盖玻片后于荧光显微镜下统计EGFP阳性精子比例。
1.5 仔鼠基因组提取及PCR检测
按照 Axygen基因组 DNA提取试剂盒使用说明,提取仔鼠尾尖基因组DNA。根据pEGFP-C1载体序列 (GenBank Accession No. U55763.1),利用primer5软件设计引物,上游引物:5?-CCTGGTCGAGCTGGAAGGCGA-3?,下游引物:5?-ACGAACTCCAGCACCATG-3?。反应长度:528 bp,反应条件:94 ℃ 10 min;94 ℃ 45 s,55 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min ,1.5%凝胶电泳检测。将PCR产物直接测序,测序结果与目的序列比对。
1.6 统计分析
统计分析用SPSS 19软件包,数据以均值±标准差 (x±s)表示,采用单因素方差分析对试验结果进行统计学分析,P<0.05表示差异显著。
2 结果与分析
2.1 不同转染试剂对公鼠精子密度和活力的影响
采用睾丸网注射的方法对 3种转染试剂的转染效率进行比较,结果见表1。与对照组相比,3个实验组的精子总数和精子活力均有所降低,下降的程度由小到大依次为 LipofectamineTMLTX & PLUSTM、Lipofectamine 2000和PAMAM-D。数据统计见表1。
2.2 不同转染试剂对精子转染效率和仔鼠EGFP基因表达效率
睾丸网注射后,不同转染试剂对转基因效率的影响见表2、图1和图2。图1为荧光下精子头部绿色荧光表达,图2为部分仔鼠PCR检测结果。表1中LipofectamineTMLTX & PLUSTM组的阳性精子率 (35.65%)和仔鼠PCR阳性率 (29.17%)均要显著高于其他两组 (P<0.05)。部分仔鼠尾尖和脚趾在荧光下观察可见绿色荧光蛋白表达 (图3),其中LipofectamineTMLTX & PLUSTM组的EGFP表达率为 6.94%,Lipofectamine 2000组为 2.74%,PAMAM-D组为4.41%。
表1 不同转染试剂对公鼠精子密度和活力的影响 (n=15,x±s)Table 1 Effect of different transfection reagents on sperm density and motility of male mice (n=15,x±s)

图1 EGFP阳性表达精子 (200×)Fig. 1 Positive sperms with EGFP expression. (A)Sperm under visible light. (B)Sperm under fluorescent.
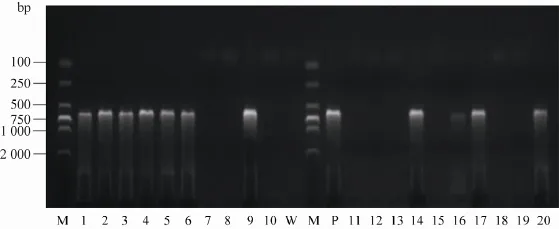
图2 EGFP基因PCR扩增电泳图Fig. 2 The electrophoretogram of EGFP production amplified by PCR. 1−20: PCR production of newborn mice; M:DL2000 marker; P: plasmid; 1, 2, 3, 4, 5, 6, 9, 14, 16, 17 and 20 were PCR positive newborn mice.

表2 不同转染试剂对精子阳性率和仔鼠EGFP基因表达率的影响 (n=15,x±s)Table 2 Effect of different transfection reagents on the rates of positive sperm and newborn EGFP expression(n=15,x±s)
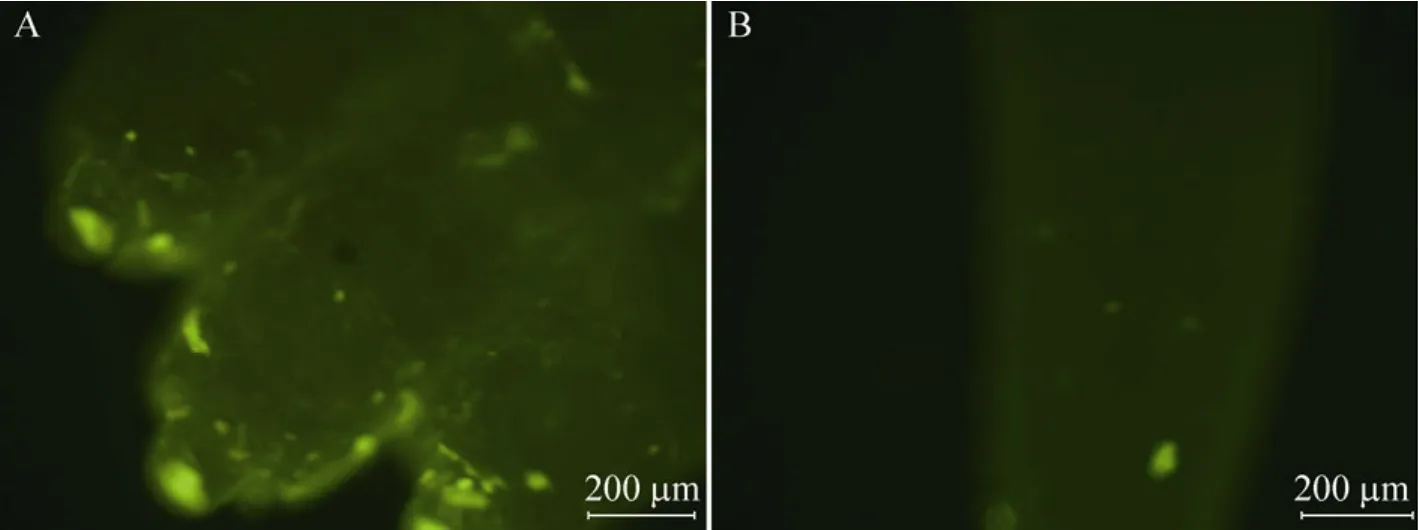
图3 EGFP转基因阳性仔鼠 (40×)Fig. 3 EGFP positive newborn mice expressed EGPF. (A)Toes of newborn mice express green fluorescence under fluorescent. (B)Tail end of newborn mice express green fluorescence under fluorescent.
2.3 不同睾丸注射方法对公鼠精子密度和活力的影响
使用LipofectamineTMLTX & PLUSTM转染试剂,3种不同睾丸注射方法处理的小鼠睾丸与正常小鼠睾丸相比较均发生萎缩,睾丸萎缩程度由小到大依次为睾丸网注射、曲精细管注射和睾丸间质注射 (图4)。不同睾丸方法注射后,3者的精子密度和精子活力均有所下降,其中曲精细管注射法和睾丸间质注射法下降显著 (P<0.05),睾丸网注射法与对照组相比差异不显著 (P>0.05)(表3)。
2.4 不同睾丸注射方法对精子转染效率和仔鼠EGFP基因表达效率的影响
使用LipofectamineTMLTX & PLUSTM转染试剂进行不同睾丸注射方法对精子转染效率的比较。睾丸网注射后阳性精子的比例为35.13%,显著高于曲精细管组 (15.13%,P<0.05)。配种后两组的仔鼠的 PCR阳性率分别为30.77%和12.50%,差异显著 (P<0.05)。仔鼠脚趾和尾尖经荧光检测,睾丸网注射法有4只小鼠呈绿色荧光表达 (5.13%),曲精细管注射有2只呈荧光表达 (2.78%)。睾丸间质注射法未能获得EGFP阳性精子,也未能获得PCR阳性和EGFP表达后代。

图4 注射后小鼠睾丸形态Fig. 4. Mouse testicular morphology after injection.(A)Testes from rete testicular injection method. (B)Testes from seminiferous tubules injection method. (C)Testes from testicular interstitial injection method. (D)Testes from control with physiological saline.

表3 不同睾丸注射方法对公鼠精子密度和活力的影响 (n=15,x±s)Table 3 Effect of different testicular injection methods on sperm density and sperm of male mice (n=15,x±s)
表4 不同转染试剂对精子转染效率和仔鼠EGFP基因表达效率 (n=15,x±s)Table 4 Effect of different testicular injection methods on the rates of positive sperm and newborn EGFP expression (n=15,x±s)
3 讨论
睾丸注射法是一种简单、高效的转基因动物制备方法。睾丸注射法通过对雄性动物睾丸内生精细胞的转染,使生殖细胞携带外源基因,从而实现转基因动物的生产。Kim 等[12]最早研究证实,小鼠睾丸注射后精原干细胞可以转染外源基因。Li等[13]利用睾丸注射法获得转基因鸡,并且对转基因鸡进行了大群繁殖。但是睾丸注射法仍存在一些不足,如易造成对动物的睾丸损伤、转染效率较低和不能稳定遗传等问题。本研究从不同转染试剂和注射方法的角度系统探讨睾丸注射对小鼠转基因效率的影响因素。
转染试剂的使用可以提高精子捕获外源基因的能力。Kim 等[12]将脂质体应用到睾丸注射中,结果提高了小鼠和猪阳性精子的比例,成功获得了转基因动物。Celebi等[14]利用睾丸注射将DNA-脂质体混合物注入小鼠睾丸,通过组织切片观察到外源基因在未成熟的精子和不同阶段生精细胞中均获得表达。Amaral等[15]发现,DMSO也可增加精子捕获外源基因的能力,提高睾丸注射后的转基因效率。国内阴彦辉等[16]结合小鼠的睾丸冰冻切片,经荧光观察和 PCR检测,也证实外源基因经过脂质体包裹后可以在小鼠睾丸内获得表达,并可传递给下一代。然而不同的转染试剂有着不同的转染原理和效率,何种转染试剂最适合在睾丸注射中进行应用的研究仍很少。Miao等利用 Lipofectamine 2000与Thanatin基因相混合进行睾丸注射,结果获得了38.46%的F1代仔鼠PCR阳性率[17]。Yonezawa等[18]将8种商业化的转染试剂与DNA混合后注入小鼠睾丸中,结果显示转染试剂自身特性影响转基因效率,仅有两种脂质体获得了相对较高的精子阳性率。本研究选择了 3种常用的转染试剂在小鼠睾丸注射中进行应用,比较其转染效率的差异,结果 LipofectamineTMLTX & PLUSTM组获得的转染效率最高。LipofectamineTMLTX & PLUSTM和Lipofectamine 2000属于同一类转染试剂,前者是在后者的基础上改良而成,具有毒性小、转染效率高的特点,本研究在小鼠的睾丸注射中也证实了这一点。PAMAM-D是一种纳米化聚酰胺-胺型树枝状聚合物,已经在动物和人类基因治疗方面取得了良好的应用,在精子孵育法建立转基因动物研究中也有不错的表现[19-20],但在睾丸注射中的应用鲜有人报道。本研究表明 PAMAM-D可用于小鼠的睾丸注射,但转染效率不如LipofectamineTMLTX & PLUSTM和Lipofectamine 2000,且细胞毒性较大。
除了常用的脂质体法介导外源基因导入,还有DMSO处理法[3]、慢病毒载体法[11]、电穿孔法[21]和直接外源基因注入法[22]等均可用于睾丸注射。这些方法各有利弊,实际使用中应根据需求选择合适的方法。
睾丸注射过程本身会对睾丸造成一定的机械损伤,加上转染试剂的化学毒性,注射后动物往往出现繁殖性能下降等问题,因此选择一个对睾丸损伤较小,转染效率更高的睾丸注射方法尤为重要。Blanchard等[23]比较了睾丸网注射和睾丸间质注射对大鼠生精细胞的转染效果,发现只有睾丸网注射可以成功转染大鼠生精细胞。Park等[24]利用重组 EGFP基因杆状病毒作为表达载体,对睾丸间质注射和曲精细管注射两者的转染效率进行了比较,得出曲精细管更适宜对睾丸内生精细胞转染的结论。由于杆状病毒只能在节肢动物中复制,因此其在脊椎动物的应用中具有较高的生物安全性。Kim等[25]通过实时荧光成像系统,比较了曲精细管注射和睾丸间质注射对EGFP基因表达的影响,结果获得了与Park相似的结论。不同的报道有着不同的实验结果,这可能与每个实验有着不同的操作手法和使用不同的转染试剂有关。本研究比较了睾丸网注射、曲精细管注射和睾丸间质注射 3种方法对转基因小鼠生产效率的影响,结果睾丸网注射对小鼠睾丸损伤程度较小,且获得的转基因效率最高,睾丸间质由于采用了多点注射的方法,对睾丸的损伤最大,未能获得阳性的精子和阳性仔鼠后代。
此外,本研究还发现仔鼠的PCR阳性率与精子的阳性率比较相近,但成功表达 EGFP基因的仔鼠比例却不是很高,表明外源基因在随后的受精和发育过程中可能发生了丢失或缺失,影响了外源基因的表达,需进一步对此种现象形成的机理进行更深入研究。
本研究结果表明,采用 LipofectamineTMLTX & PLUSTM作为转染试剂,结合睾丸网注射可最大程度降低睾丸注射对小鼠睾丸的损伤,提高转基因生产效率。
[1]Sato M, Yabuki K, Watanabe T, et al.Testis-mediated gene transfer (TMGT)in mice:successful transmission of introduced DNA from F0 to F2 generations. Transgenics, 1999, 3(1): 11−22.
[2]Yamazaki Y, Yagi T, Ozaki T, et al. In vivo gene transfer to mouse spermatogenic cells using green fluorescent protein as a marker. J Exp Zool, 2000,286(2): 212−218.
[3]Shen W, Li L, Pan Q, et al. Efficient and simple production of transgenic mice and rabbits using the new DMSO-sperm mediated exogenous DNA transfer method. Mol Reprod Dev, 2006, 73(5):589−594.
[4]Xiao HW, Zheng XM, Chen SH, et al.Sperm-mediated gene transfer to produce hCD59 transgenic porcine. J Huazhong Agri Univ, 2006,25(2): 170−173 (in Chinese).肖红卫, 郑新民, 陈思怀, 等. 精子介导生产转hCD59 基因猪. 华中农业大学学报, 2006, 25(2):170−173.
[5]He X, Li H, Zhou Z, et al. Production of brown/yellow patches in the SLC7A11 Transgenic Sheep via testicular injection of transgene. J Genet Genomics, 2012, 39(6): 281−285.
[6]Sun M, Ni LG, Shi QQ, et al. Transfection of Mx gene by testis-meidated method to produce disease resistance transgenic chickens. J Yangzhou Univ:Agri Life Sci Ed, 2010, 31(2): 14−18 (in Chinese).孙敏, 倪黎刚, 施青青, 等. 睾丸注射 Mx基因生产抗病转基因鸡初探. 扬州大学学报: 农业与生命科学版, 2010, 31(2): 14−18.
[7]Min S, Qing SQ, Hui YY, et al. Generation of antiviral transgenic chicken using spermatogonial stem cell transfected in vivo. Afric J Biotech, 2013,10(70): 15678−15683.
[8]Kim TS, Lee SH, Gang GT, et al. Exogenous DNA uptake of boar spermatozoa by a magnetic nanoparticle vector system. Reprod Domest Anim,2010, 45(5): 201−206.
[9]Collares T, Campos VF, de Leon PMM, et al.Transgene transmission in chickens by spermmediated gene transfer after seminal plasma removal and exogenous DNA treated with dimethylsulfoxide or N,N-dimethylacetamide. J Biosci, 2011, 36(4): 613−620.
[10]Ding XL, Zhang HY, Xu X, et al. Construction of transgenic mice by testis rete injection. Natl J Androl, 2008, 22(7): 5−8 (in Chinese).丁晓麟, 张寒莹, 许欣, 等. 睾丸网注射法建立转基因小鼠. 中国男科学杂志, 2008, 22(7): 5−8.
[11]Kanatsu-Shinohara M, Toyokuni S, Shinohara T.Transgenic mice produced by retroviral transduction of male germ line stem cells in vivo.Biol Reprod, 2004, 71(4): 1202−1207.
[12]Kim JH, Jung-Ha HS, Lee HT, et al. Development of a positive method for male stem cell-mediated gene transfer in mouse and pig. Mol Reprod Dev,1997, 46(4): 515−526.
[13]Li BC, Sun GB, Sun HC, et al. Efficient generation of transgenic chickens using the spermatogonial stem cells in vivo and ex vivo transfection. Sci China C Life Sci, 2008, 51(8): 734−742.
[14]Celebi C, Auvray P, Benvegnu T, et al. Transient transmission of a transgene in mouse offspring following in vivo transfection of male germ cells.Mol Reprod Dev, 2002, 62(4): 477−482.
[15]Amaral MG, Campos VF, Seixas FK, et al.Testis-mediated gene transfer in mice: comparison of transfection reagents regarding transgene transmission and testicular damage. Biol Res,2011, 44(3): 229−234.
[16]Yin YH, Sun M, Chen TF, et al. Generation of goat H-FABP overexpression transgenic mice by testicular injection. Hereditas, 2012, 34(6):727−735 (in Chinese).阴彦辉, 孙敏, 陈庭锋, 等. 睾丸注射法制备携带山羊 H-FABP 基因的转基因小鼠. 遗传,2012, 34(6): 727−735.
[17]Miao XY, Zhang X. Production of transgenic mice carrying the Thanatin gene by intratesticular injection. Biochem Biophys Res Commun, 2011,415(3): 429−433.
[18]Yonezawa T, Furuhata Y, Hirabayashi K, et al.Detection of transgene in progeny at different developmental stages following testis-mediated gene transfer. Mol Reprod Dev, 2001, 60(2): 196−201.
[19]Campos VF, Komninou ER, Urtiaga G, et al.NanoSMGT: transfection of exogenous DNA on sex-sorted bovine sperm using nanopolymer.Theriogenology, 2011, 75(8): 1476−1481.
[20]Wu B, Dai JJ, Zhang TY, et al. Positive effects of PAMAM-D on the efficiency of boar sperm-mediated gene transfer. Chin J Vet Sci,2013, 33(3): 466−471 (in Chinese).吴斌, 戴建军, 张廷宇, 等. 纳米化聚酰胺-胺型树状聚合物对猪精子介导基因转移效率的影响.中国兽医学报, 2013, 33(3): 466−471.
[21]Parrington J, Coward K, Hibbitt O, et al. In vivo gene transfer into the testis by electroporation and viral infection-a novel way to study testis and sperm function. Soc Reprod Fertil Suppl, 2007, 65:469–474.
[22]Yamazaki Y, Fujimoto H, Ando H, et al. In vivo gene transfer to mouse spermatogenic cells by deoxyribonucleic acid injection into seminiferous tubules and subsequent electroporation. Biol Reprod, 1998, 59(6): 1439–1444.
[23]Blanchard KT, Boekelheide K. Adenovirusmediated gene transfer to rat testis in vivo. Biol Reprod, 1997, 56(2): 495−500.
[24]Park HJ, Lee WY, Kim JH, et al. Interstitial tissue-specific gene expression in mouse testis by intra-tunica albuguineal injection of recombinant baculovirus. Asian J Androl, 2009, 11(3): 342−350.
[25]Kim TS, Choi HS, Ryu BY, et al. Real-time in vivo bioluminescence imaging of lentiviral vector-mediated gene transfer in mouse testis.Theriogenology, 2010, 73(1): 129−138.
