摩氏摩根菌ZJB-09203酯酶的分离纯化及性质
2014-10-31郑仁朝王天真黎小军郑裕国
郑仁朝王天真黎小军郑裕国
1 浙江工业大学 生物工程研究所,浙江 杭州 310032
2 浙江工业大学 生物转化与生物净化教育部工程研究中心,浙江 杭州 310032
普瑞巴林 (Pregabalin),化学名 (S)-(+)-3-氨甲基-5-甲基己酸,是抑制性神经递质γ-氨基丁酸 (GABA)的3位异丁基取代物,属钙离子通道调节剂[1]。普瑞巴林于2005年9月以商品名“Lyrica”首次在美国上市,目前已成为全球增长最快的药物之一[2],被国际疼痛学会 (IASP)、欧洲神经病理学会联盟 (EFNS)和英国国立卫生与临床研究所 (NICE)等多个国际权威指南推荐为治疗神经病理性疼痛的一线药物[3-5]。美国辉瑞公司最新年报显示,Lyrica®2012年全球销售额高达41.6亿美元[6]。
由于普瑞巴林广阔的市场前景,其规模化不对称合成技术成为制药工程研究的热点,合成新方法不断涌现[7]。其中,辉瑞公司引入脂肪酶手性生物催化开发成功的化学-酶法工艺是目前最高效的普瑞巴林生产方法[8]。与第一代全化学合成工艺相比,新一代化学-酶法通过拆分步骤前移、无效单体回用和原位脱羧等技术使环境因子 (E factor)由86降至8[9],大幅减少了原料消耗和“三废”排放。该新工艺的核心是获得能够立体选择性水解rac-2-羧乙基-3-氰基-5-甲基己酸乙酯 (CNDE)生成 (3S)-2-羧乙基-3-氰基-5-甲基己酸的水解酶。辉瑞公司规模化生产所用水解酶为诺维信商品化脂肪酶Lipolase®,生产成本高,且已申请专利保护[10]。因此,开发具有自主知识产权、能够高效拆分CNDE的新酶源成为普瑞巴林酶法合成的关键。
本实验室经前期大量筛选,首次报道了能够高效对映选择性拆分CNDE的摩氏摩根菌Morgarella morganii ZJB-09203[11]。文中主要对M. morganii ZJB-09203产生的酯水解酶进行分离纯化和酶学性质研究,为今后酶分子改造提高催化效率和工业化应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器
标准牛血清清蛋白 (Sigma公司);rac-2-羧乙基-3-氰基-5-甲基己酸乙酯、(3S)-2-羧乙基-3-氰基-5-甲基己酸 (浙江某医药公司馈赠);不同碳链长度对硝基苯酯 C2 (p-NP acetate)、C4(p-NP butyrate)、C6 (p-NP hexanoate)、C10 (p-NP decanoate)、 C12 (p-NP laurate)、 C16 (p-NP palmitate)(J&K Chemical);Phenyl Sepharose 6 FF 和DEAE Sephadex A-50 (GE公司);其他常用试剂均为市售分析纯。Agilent 7890气相色谱仪 (美国安捷伦公司);GC-14C气相色谱仪 (日本岛津);超滤浓缩管 (MWCO 10 kDa,Millipore公司);Microfuge 22R高速冷冻离心机(BECKMAN公司);5 mL Bio-Scale CHT预装柱、Mini-Protein Ⅱ电泳仪型、BioLogic LP低压层析系统和凝胶成相仪 (Bio-Rad公司)。
1.1.2 菌种
摩氏摩根菌M. morganii ZJB-09203由本实验室分离并鉴定[11],并保藏于中国典型培养物保藏中心,保藏编号:CCTCC No. M 2011175。
1.2 培养基及培养条件
1) 斜面培养基:牛肉膏蛋白胨培养基,30 ℃培养24 h;2) 种子培养基(W/V):1.0%葡萄糖,0.3%牛肉膏,0.01% Fe2(SO4)3,0.1%Na2HPO4,30 ℃、180 r/min培养 24 h;3)发酵培养基(W/V):1.5%葡萄糖,0.7%牛肉膏,0.01%Fe2(SO4)3,1.0%吐温-80,0.1% Na2HPO4,30 ℃、180 r/min培养36 h。
1.3 酶活测定和蛋白质浓度测定
在体系中加入1 mL Tris-HCl缓冲液(50 mmol/L,pH 9.0)和970 μL酶液,置于40 ℃保温10 min,加入30 μL CNDE (终浓度 50 mmol/L),40 ℃下150 r/min振荡反应60 min,用50 μL 1 mol/L HCl终止反应。气相色谱法检测2-羧乙基-3-氰基-5-甲基己酸生成量。酶活力的定义为:在上述条件下,每分钟生成 1 μmol (3S)-2-羧乙基-3-氰基-5-甲基己酸所需酶量定义为一个酶活力单位(U)。蛋白质浓度定量分析采用Bradford法。
1.4 底物、产物含量与光学纯度的检测方法
底物、产物含量用气相色谱Agilent 7890测定,色谱柱类型:HP-5弱极性色谱柱(30 m×0.32 mm×0.25 μm),初始柱温 130 ℃,以 5 ℃/min程序升温至 165 ℃,载气为氮气,载气流量1.0 mL/min,进样量1 μL,分流比50∶1,检测器及进样口温度均为250 ℃。
底物、产物光学纯度 (eeS、eeP)用气相色谱GC-14C测定,色谱柱类型:Chiraldex G-TA(30 m×0.25 mm×0.25 μm),柱温 135 ℃,载气为氦气,流量为1.0 mL/min,进样量1 μL,分流比40∶1,检测器及进样口温度均为220 ℃。产物和底物各异构体的保留时间分别为:(3S)-2-羧乙基-3-氰基-5-甲基己酸 10.8 min,(3R)-2-羧乙基-3-氰基-5-甲基己酸 11.7 min;(R)-CNDE 38.2 min,(S)-CNDE 39.2 min。
1.5 摩氏摩根菌酯水解酶的分离纯化
1.5.1 粗酶液的制备
发酵液于4 ℃离心 (12 000 r/min,10 min)收集菌体,重悬于一定量的Tris-HCl 缓冲液(50 mmol/L,pH 8.0)中,在冰浴条件下超声破碎菌体 (破碎功率300 W,工作1 s,停1 s),破碎液冰浴中静置0.5 h,以利于酶的进一步释放。12 000 r/min离心15 min,收集上清液得粗酶液,记为酶液Ⅰ。
1.5.2 硫酸铵分级沉淀
将研细的固体硫酸铵加入到粗酶液中,调至不同的饱和度 (20%−80%),0 ℃冰浴下静置4 h,4 ℃、15 000 r/min 离心 10 min,分离上清与沉淀,沉淀用Tris-HCl缓冲液 (50 mmol/L,pH 8.0)复溶,并进行蛋白浓度和活性测定,确定最优盐析条件。
1.5.3 Phenyl Sepharose 6 FF疏水层析
硫酸铵盐析得到的沉淀用 Tris-HCl缓冲液(50 mmol/L,pH 8.0)溶解后记为酶液Ⅱ。上样于Phenyl Sepharose 6 FF 疏水层析柱,然后用缓冲液buffer A:pH 8.0 PBS (含有1.8 mol/L硫酸铵)平衡,再用低盐缓冲液洗脱。所用的低盐缓冲依次有缓冲液 B:PBS (50 mmol/L,pH 8.0)以及缓冲液 C: Tris-HCl (50 mmol/L,pH 8.0),缓冲液 D为纯水。采用梯度洗脱,收集的酶活集中部分,记为酶液Ⅲ。
1.5.4 DEAE Sephadex A-50 阴离子交换
将收集的酶液Ⅲ进行 DEAE阴离子交换层析分离,首先用低盐的缓冲液 A (50 mmol/L Tris-HCl,pH 8.0)平衡,上样后再用高盐的缓冲液B (缓冲液 A + 1 mol/L NaCl)洗脱。洗脱时采用分步洗脱,洗脱缓冲液分别是含0、0.05、0.1、0.2和1.0 mol/L NaCl。每部分洗脱液体积为 3−5个柱体积。检测各洗脱液的蛋白浓度及酶活,并将有活性的洗脱液混合,记为酶液Ⅳ。
1.5.5 羟基磷灰石Bio-Scale CHT层析
酶液Ⅳ透析脱盐后进行羟基磷灰石层析,首先采用磷酸钾缓冲液(20 mmol/L,pH 8.0)平衡,再用浓度为0.5 mol/L的缓冲液 (pH 8.0)梯度洗脱,收集检测有活力的部分,记为酶液Ⅴ。
1.6 分离纯化效果和蛋白分子量检测
采用 12% SDS-PAGE,蛋白质用考马斯亮蓝 R-250染色,用于检测目的蛋白的纯化效果及测定蛋白表观分子量。
蛋白分子量的测定采用高效液相色谱凝胶过滤层析法测定。Shimadzu LC-10Avp HPLC液相系统,色谱柱为UtrahydrogelTM250水相凝胶柱 (7.8 cm×30 cm, 6 μm)。流动相为纯净水,流速0.5 mL/min,检测波长280 nm。根据酶蛋白与其他标准蛋白保留时间关系计算分子量。所用标准蛋白及其分子量为:磷酸化酶B (97.2 kDa),牛血清蛋白 (66.4 kDa),卵清蛋白 (43.0 kDa),碳酸酐酶 (30.0 kDa),胰蛋白酶抑制剂 (20.1 kDa)和 α-乳清蛋白 (14.4 kDa)。
1.7 酶学性质研究
1.7.1 底物特异性
以不同碳链长度的p-硝基苯酚酯为底物,对纯化的酯水解酶进行底物谱研究。反应体系为:对硝基苯酚酯与乙醇的混合溶液80 μL,Tris-HCl 缓冲液 (pH 8.0,50 mmol/L)1 720 μL,纯化后的酶液200 μL。对照组用200 μL Tris-HCl缓冲液 (pH 8.0,50 mmol/L)代替酶液。室温下反应5 min,测定405 nm吸光值变化,每组实验重复3次,计算平均值及标准偏差。
1.7.2 酶的最适反应pH及pH稳定性
1) 最适反应 pH:分别在pH 5.0–7.0 的 50 mmol/L Na2HPO4-NaH2PO4缓冲液,pH 7.5–9.0的50 mmol/L Tris-HCl 缓冲液和pH 9.0–10.0 的50 mmol/L Gly-NaOH 缓冲液中, 40 ℃下测定酶活力和 eeP,考察纯酶的最适pH。 2) pH 稳定性:将酶液置于不同pH (5.0–10.0)的缓冲液中于4 ℃放置24 h,然后于最适pH条件下测定其对应残留酶活力。以活力最高值为100%,计算相对活力。
1.7.3 酶的最适反应温度及热稳定性
1) 最适反应温度:在酶的最适反应 pH 条件下,分别测定纯酶在30 ℃–60 ℃的酶活力,通过酶活力和eeP考察酶的最适反应温度。2)热稳定性:在50 mmol/L Na2HPO4-NaH2PO4缓冲液 (pH 8.5)中,将酶液分别置于40 ℃、45 ℃、50 ℃保温,在不同时间分别取样并在最适温度下测定其相应的残留酶活力,以活力最高值为100%,考察酶的热稳定性。
1.7.4 金属离子对酶活力的影响
在反应体系中分别加入终浓度为5 mmol/L的Fe3+、Co2+、Cu2+、Zn2+、Mn2+、Ca2+、Ni2+、Ba2+、Mg2+、Li+、Al3+和EDTA,在40 ℃下反应60 min测定酶活和eeP,考察金属离子对酶活的影响。
1.7.5 摩氏摩根菌酯酶的动力学参数测定
在40 ℃下,测定酯酶的反应初速度,利用Lineweaver-Burk 双倒数作图法求出该酶的Km值及Vmax。将不同浓度的p-硝基苯酚酯乙醇溶液加入Tris-HCl缓冲液 (pH 8.0, 50 mmol/L)中,其中乙醇最终体积分数4%,对硝基苯酚酯终浓度范围为0.01−0.25 mmol/L。
2 结果与分析
2.1 摩氏摩根菌酯水解酶的分离纯化
酯酶经35%和65%的饱和硫酸铵分级沉淀、Phenyl Sepharose 6 FF疏水层析、DEAE Sephadex A-50 阴离子交换和Bio-Scale CHT层析后,分离得到能够对映选择性水解CNDE的水解酶。纯化后,该酶比活力由0.18 U/mg提高到15.61 U/mg,纯化倍数为86.7倍,回收率为6.5%(表1)。SDS-PAGE结果 (图1)表明,纯化后的酶蛋白为单一条带,说明得到了电泳纯目标蛋白,其表观分子量约为 72 kDa。进一步利用凝胶过滤HPLC测定了该酶的分子量。该酶蛋白的保留时间为14.4 min (图2),根据蛋白质分子量标准曲线回归方程,算得其分子量为68.0 kDa。同时结合SDS-PAGE结果,表明该酶为单亚基酶,亚基分子量为68.0 kDa。
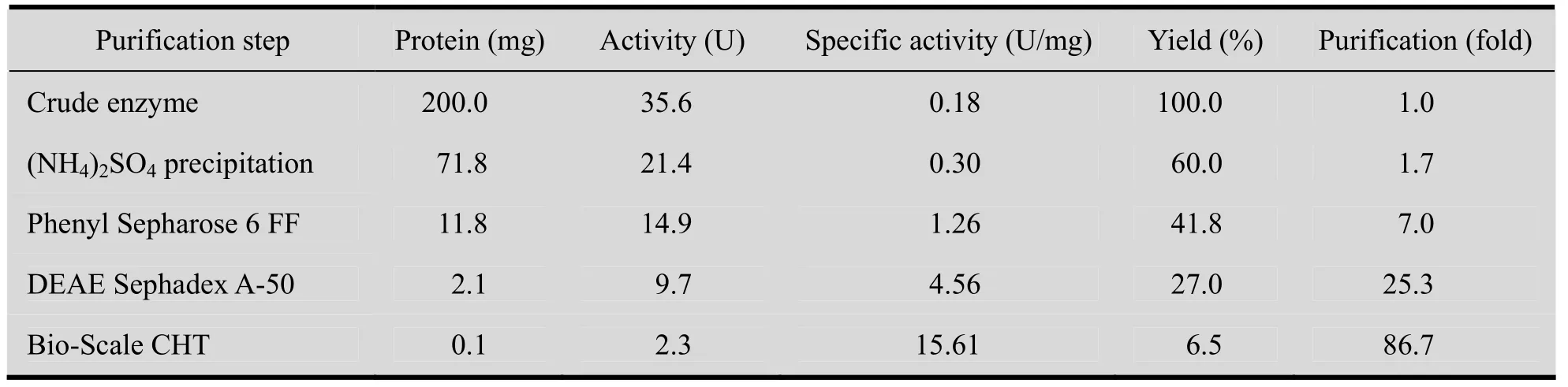
表1 M. morganii ZJB-09203酯水解酶的纯化Table 1 Purification of carboxyl esterase from M. morganii ZJB-09203

图1 M. morganii ZJB-09203酯水解酶的SDS-PAGEFig. 1 SDS-PAGE analysis of purified carboxyl estersase from Morgarella morganii ZJB-09203. 1:protein marker; 2: concentrated purified enzyme.

图2 纯化后M. mo rganii ZJB-09203酯水解酶的液相谱图Fig. 2 HPLC chromatograms of the purified enzyme.
2.2 摩氏摩根菌酯水解酶的底物特异性
由于脂肪酶和酯酶均可能水解 CNDE酯键。脂肪酶和酯酶的显著区别在于偏好底物的链长不一致:脂肪酶偏向于水解碳链较长的酯类 (>10个碳原子),而酯酶偏好水解碳链较短的酯类(<10个碳原子)[12]。为了确定M. morganii ZJB-09203酯水解酶类型,考察了该酶对不同碳链长度p-硝基苯酚酯的活性,如图 3所示。该酶与枯草芽胞杆菌Bacillus subtilis RRL1789酯酶[13]表现出类似的底物偏好性,对碳链较短底物 (C4,C6)的酶活较高,而对碳链较长酯类(C10,C12,C16)的活力明显下降,对 p-硝基苯酚棕榈酸酯 (C16)的活力仅为对p-硝基苯酚己酸酯的1%。据此可推断该酯水解酶为酯酶。
2.3 酯酶酶学性质
2.3.1 酯酶最适反应pH及pH稳定性

图3 M. morganii ZJB-09203酯水解酶的底物特异性Fig. 3 Substrate specificity of the carboxyl esterase from M. morganii ZJB-09203. The activity towards p-nitrophenyl hexanoate was taken as 100%.
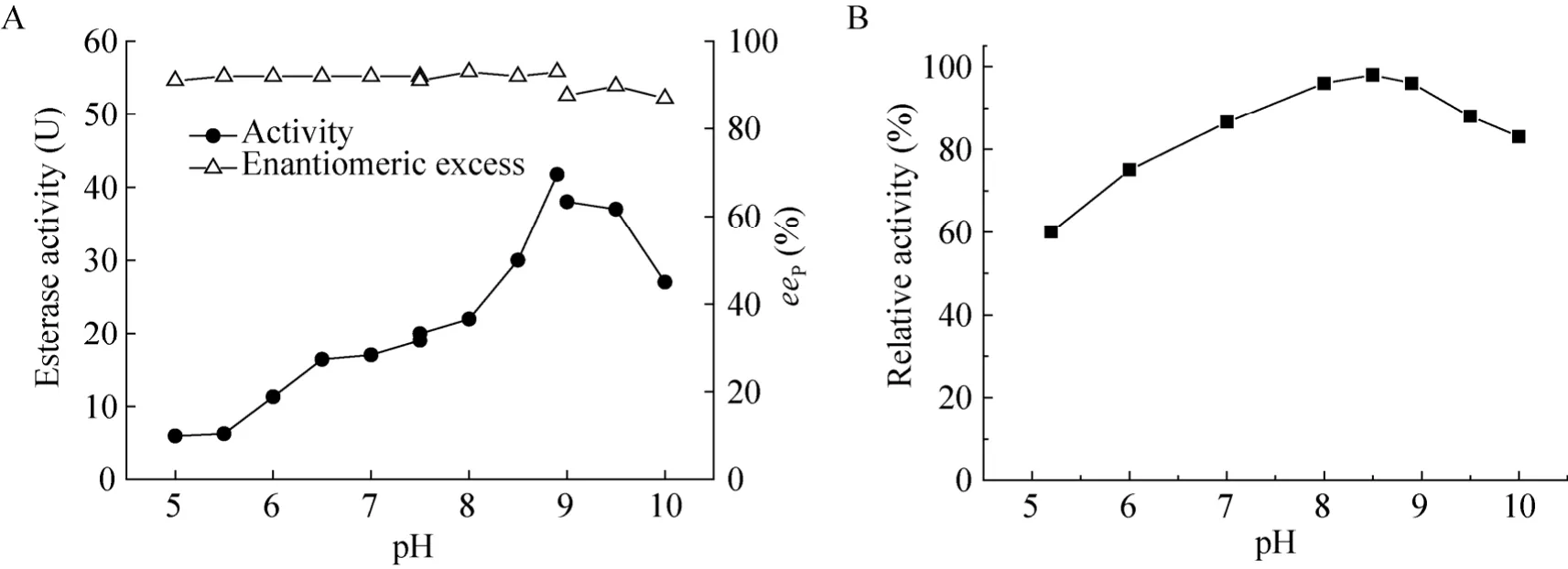
图4 pH对酯酶活力 (A)及稳定性 (B)的影响Fig. 4 Effect of pH on the activity (A)and stability (B)of esterase from M. morganii ZJB-09203.
1)最适反应 pH:pH 对酯酶活力影响结果见图 4A。该酶在 pH 8.5–9.5酶活力较好,当pH<8.0 或 pH>9.5 时酶活力下降。以磷酸盐和 Tris-HCl缓冲液为反应体系时,产物光学纯度较高,而改用Gly-NaOH缓冲液时,eeP下降至 90%以下。pH稳定性实验结果见图 4B,该酯酶在pH 8.0–9.0、4 ℃下放置24 h保持原活力的94%左右。而当pH<8.0 或 pH>9.0时酶活力损失较大。
2.3.2 酯酶的最适反应温度及热稳定性
1) 最适反应温度:酶反应最适温度测定结果表明,该酯酶在40 ℃–45 ℃间具有较高活力,最适温度为45 (℃图5A)。2)热稳定性:酶的热稳定性实验结果表明,当温度低于 40 ℃时,酯酶稳定性良好。在40 ℃保温30 min,仍保存91.8%活力。但在45 ℃、50 ℃保温30 min后,其酶活损失分别达到34.6%和69.5% (图5B)。
2.3.3 金属离子及EDTA对酶活力的影响
金属离子及EDTA 对酶活力影响的实验结果见表2。Ca2+、Mn2+和Cu2+对酶活力有一定的激活作用,酶活力分别提高到 112.1%、117.9%和111.7%。Co2+、Fe3+、Ni2+、Zn2+和Ba2+对酶活力均有一定的抑制作用,其中Co2+、Fe3+、Ni2+有强烈的抑制作用,分别抑制了约 33.3%、29.6%和30.5%的酶活力。添加EDTA后,酶活降为原来的69.1%。
2.3.4 M. morganii ZJB-09203酯酶水解动力学参数
根据米氏方程,采用双倒数作图法,绘制该酯酶对 p-硝基苯酚丁酸酯、己酸酯、癸酸酯和月桂酸酯的动力学曲线,并分别计算其动力学参数 (表 3)。实验结果表明,该酯酶对 4种底物的亲和力大小是:C6 > C10 > C4 > C12。

表2 金属离子和EDTA对酯酶活力的影响Table 2 Effect of mental ions and EDTA on esterase activity
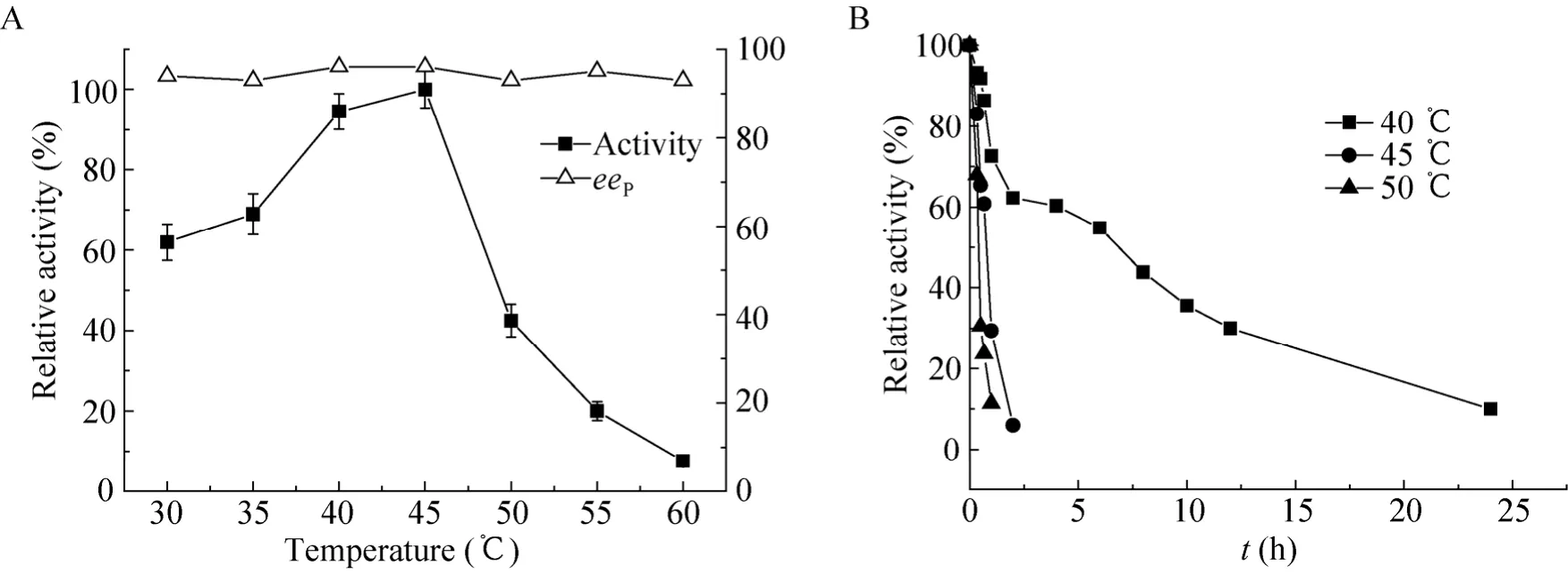
图5 温度对酯酶酶活和稳定性的影响Fig. 5 Effect of temperature on the activity (A)and stability (B)of esterase.
2.3.5 M. morganii ZJB-09203酯酶催化CNDE立体选择性水解
M. morganii ZJB-09203酯酶催化不同浓度CNDE水解进程见图 6。当底物浓度分别为30 mmol/L和60 mmol/L时,转化率在3 h和6 h即达到45%以上。但随着CNDE浓度的继续增加,转化率呈下降趋势。200 mmol/L底物浓度下,反应时间延长至24 h,转化率仅为31%。在前期 M. morganii ZJB-09203全细胞催化CNDE水解中,也观察到高底物浓度下由产物引起的抑制现象[11]。向反应体系中添加 Ca2+、Zn2+等二价金属离子与产物形成络合物[8]或加入大孔吸附树脂进行原位分离[11]可显著解除底物抑制现象。
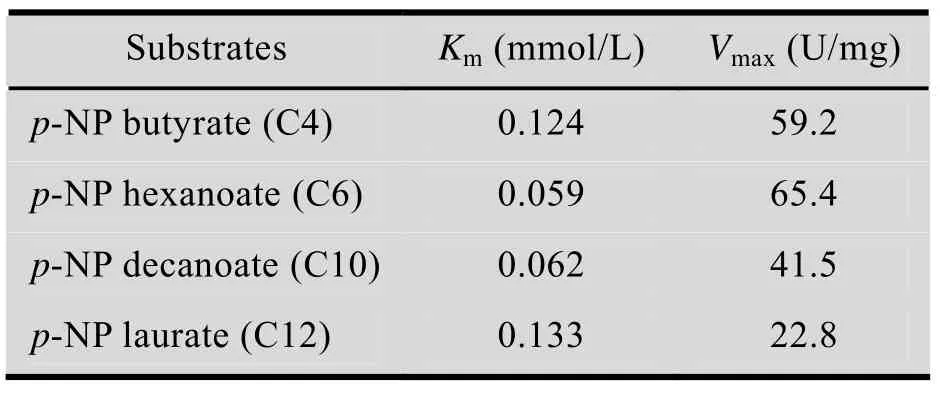
表3 M. morganii ZJB-09203 酯酶的动力学参数Table 3 Kinetic constants of M. morganii ZJB-09203 esterase

图6 M. m organii ZJB-09203酯酶催化不同浓度CNDE水解Fig. 6 Time courses of CNDE hydrolysis at different concentrations catalyzed by M. morganii ZJB-09203 esterase.
3 结论
新酶源的发现是生物催化工艺开发至为关键的第一步。在普瑞巴林化学-酶法工艺开发过程中,辉瑞公司筛选了大量商品化水解酶[10],发现疏绵状嗜热丝孢菌 Thermonyces lanuginosus脂肪酶 (商品名 Lipolase®)和德式根霉Rhizopus delemar脂肪酶对CNDE具有优良的S-立体选择性 (E>200),而商品化酯酶(如pig liver esterase和cholesterol esterase)基本无选择性 (E=2)[8]。除笔者课题组发现的 M.morganii ZJB-09203酯水解酶外,能够对映选择性水解S -型CNDE的非商品化生物催化剂迄今未见报道。因此,对M. morganii ZJB-09203产生的酯水解酶进行分离纯化和酶学性质研究,对于建立具有自主知识产权的普瑞巴林化学-酶法工艺和实现工业应用具有一定的意义。
本文首先通过硫酸铵沉淀和3步柱层析,首次分离纯化了摩氏摩根菌酯水解酶,获得了电泳纯酶,并利用凝胶过滤HPLC测定其分子量为68 kDa。该酶水解CNDE的比活力达到15.6 U/mg。酯水解酶对不同碳链长度对硝基苯酚酯底物的偏好性是区分脂肪酶和酯酶的重要依据[14-15],通过纯酶底物特异性分析,确定M. morganii ZJB-09203选择性水解CNDE的酶为酯酶。
酶学性质研究表明,该酯酶最适pH范围为8.5−9.5,最适温度范围为40 ℃−45 ℃。与沃氏不动杆菌Acinetobacter lwoffii 16C-1酯酶类似[16],该酶在 pH 7.0−9.0和低于40 ℃时具有良好的稳定性。金属离子对不同微生物源酯酶的活性影响不一,如扩展短杆菌Brevibacterium linens ATCC 9174酯酶受多种二价金属离子的抑制[17];Micrococcus sp. YGJ1酯酶受Hg2+、Cu2+强烈抑制,而Fe3+、Ni2+、Co2+等对其无显著影响[18];Mn2+对活性污泥宏基因组来源酯酶EstAS具有较强激活作用,但受Cu2+的抑制[19]。在实验中我们发现,Ca2+、Cu2+、Mn2+对该酯酶活性有一定的促进作用,而Co2+、Fe3+、Ni2+、Zn2+和Ba2+对酶活有不同程度的抑制作用。与地芽胞杆菌Geobacillus sp. HBB-4[20]和A. lwoffii 16C-1[16]酯酶类似,该酶受EDTA抑制,说明金属离子对酶活具有一定的激活作用,其机理有待进一步研究。
酯酶由于不需辅酶、耐受有机溶剂和高立体选择性等优势,成为制药和精细化工工业中常用的重要生物催化剂[21-22],广泛用于手性醇和手性羧酸的合成。本研究首次从摩氏摩根菌中分离纯化获得酯酶,后续研究经胰蛋白酶酶切并利用 LC/MS/MS测定了其多肽氨基酸序列。通过NCBI序列比对和引物设计,该酯酶的结构基因正在克隆中。这些工作将为探索酯酶蛋白结构与分子机理,构建更为高效的生物催化剂奠定基础。
[1]Lauria-Horner BA, Pohl RB. Pregabalin: a new anxiolytic. Expert Opin Invest Drugs, 2003, 12(4),12: 663–672.
[2]Tao JH, Xu JH. Biocatalysis in development of green pharmaceutical process. Curr Opin Chem Biol, 2009, 13(1): 43–50.
[3]Attal N, Cruccu G, Baron R, et al. EFNS guidelines on the pharmacological treatment of neuropathic pain: 2010 revision. Eur J Neurol, 2010, 17(9):1113–1123.
[4]Peter B, Tracey C. Neuropathic pain: the pharmacological management of neuropathic pain in adults in non-specialist settings// NICE Clinical Guideline 96. London: National Institute for Health and Clinical Excellence, 2010.
[5]Dworkin RH, O’Connor AB, Audette J, et al.Recommendation for the pharmacological management of neuropathic pain: an overview and literature update. Mayo Clin Proc, 2010, 85(3):S2–S14.
[6]2012 Pfizer Financial Report [EB/OL].[2013-03-11]. http://www. pfizer.com/files/annualreport/2012/financial/financial2012.pdf.
[7]Chen YS, Li X, Cheng RN, et al. Recent development in the synthesis of Pregabalin. Chin J Org Chem, 2011, 31(10): 1582–1594 (in Chinese).陈永升, 李勋, 程若男, 等. 普瑞巴林的合成研究进展. 有机化学, 2011, 31(10): 1582–1594.
[8]Martinez CA, Hu SH, Dumond Y, et al.Development of a chemoenzymatic manufacturing process for pregabalin. Org Process Res Dev, 2008,12(3): 392–398.
[9]Dunn PJ. The importance of green chemistry in process research and development. Chem Soc Rev,2012, 41(4): 1452–1461.
[10]Hu SH, Martinez CA, Tao JH, et al. Preparation of pregabalin and related compounds: US,20110065168A1. 2011-03-17.
[11]Zheng RC, Wang TZ, Fu DJ, et al. Biocatalysis synthesis of chiral intermediate of pregabalin with high substrate loading by a newly isolated Morganella morganii ZJB-09203. Appl Microbiol Biotechnol, 2013, 97(11): 4839–4847.
[12]Fojan P, Jonson PH, Petersen MT, et al. What distinguishes an esterase from a lipase: a novel structural approach. Biochimie, 2000, 82(11):1033–1041.
[13]Kaiser P, Raina C, Parshad R, et al. A novel esterase from Bacillus subtilis (RRL 1789):purification and characterization of the enzyme.Protein Expres Purif, 2006, 45(2): 262–282.
[14]Zhao LL, Xu JH, Zhao J, et al. Biochemical properties and potential applications of an organic solvent-tolerant lipase isolated from Serratia marcescens ECU1010. Process Biochem, 2008,43(6): 626–633.
[15]Zheng GW, Pan J, Yu HL, et al. An efficient bioprocess for enzymatic production of L-menthol with high ratio of substrate to catalyst using whole cells of recombinant E. coli. J Biotechnol, 2010,150(1): 108–114.
[16]Kim HE, Park KR. Purification and character ization of an es terase from Acinetobacter lwoffii 16C-1.Curr Microbiol, 2002, 44(6): 401–405.
[17]Rattray FP, Fox P. Purification and characterization of an intracellular esterase from Brevibacterium linens ATCC 9174. Int Dairy J, 1997, 7(4):273–278.
[18]Maruyama K, Akita K, Naitou C, et al. Purification and characterization of an esterase hydrolyzing monoalkyl phthalates from Micrococcus sp. YGJ1.J Biochem, 2005, 137(1): 27–32.
[19]Zhang T, Han WJ, Liu ZP. Gene cloning and characterization of a novel esterase from activated sludge metagenome. Microb Cell Fact, 2009, 8: 67.
[20]Metin K, Ateslier ZBB, Basbulbul G, et al.Characterization of estera se activity in Geobacillus sp. HBB-4. J Basic Mi crobiol, 2006, 46(5):400–409.
[21]Bornscheuer U T. Microbial carboxyl esterase:classification, prop erties and application in biocatalysis. FEMS Microb Rev, 2002, 26(1): 73–81.
[22]Asoodeh A, Ghanbari T. Characterization of an extracellular thermophilic alkaline esterase produced by Bacillus subtilis DR8806. J Mol Catal B: Enzym, 2013, 85-86: 49–55.
