双酶偶联转化果糖制备含有稀少糖的混合糖液
2014-10-31韩文佳玥朱明柏玮何森健张同存孙媛霞
韩文佳玥,朱明,柏玮,何森健,张同存,孙媛霞
1 天津科技大学生物工程学院,天津 300457
2 中国科学院天津工业生物技术研究所 工业酶国家工程实验室,天津 300308
稀少糖是自然界中存在但含量极少的一类单糖及其衍生物。作为一种功能性甜味剂,稀少糖具有低热量、低吸收、抗龋齿、降血糖、改善肠道菌群等理化性质[1-4]。例如,D-阿洛酮糖可以改善肠道菌群、降低血糖、抗龋齿等[5-8],D-阿洛糖具有抑制活性氧、抑制癌细胞增殖等功能[9-12]。因此,功能性稀少糖在膳食、保健、医药等领域拥有广阔的应用前景。
2002年,Izumori教授建立了稀少糖的生物转化生产策略——Izumoring方法[13-14]。根据该方法利用酮糖差向异构酶、醛糖异构酶和多元醇脱氢酶可实现单糖与糖醇之间的相互转化[15-18]。前期工作中,本实验室建立了稀少糖转化酶的筛选平台,从各类环境样品中筛选得到含有不同稀少糖转化酶的微生物,并成功对其稀少糖转化酶进行克隆、异源表达和性质研究。例如,来源于瘤胃菌Ruminococcus sp.的D-阿洛酮糖3-差向异构酶 (D-psicose 3-epimerase, DPE),可以将D-果糖转化为 D-阿洛酮糖[19];来源于枯草芽胞杆菌 Bacillus subtilis 168的 L-鼠李糖异构酶(L-rhamnose isomerase, L-RhI),可以将D-阿洛酮糖转化为D-阿洛糖[20]。
但是,DPE的转化率普遍较低[19,21-24],因此本研究提出利用双酶偶联转化系统提高转化效率的思路。即以D-果糖作为底物,利用DPE和L-RhI同时生产 D-阿洛酮糖和 D-阿洛糖。由于D-阿洛糖的生成会消耗部分 D-阿洛酮糖,从而促进整个反应向生成功能性稀少糖的方向进行,提高了底物的转化率 (图1)。
果葡糖浆、菊芋提取物中含有较高浓度的果糖,利用DPE、L-RhI双酶偶联转化方法,以这些低附加值原料为底物,可以获得含有 D-阿洛酮糖和 D-阿洛糖等功能性稀少糖的高附加值混合糖液,为利用酶法获得含有功能性稀少糖的果糖高附加值产物的开发应用提供了新的思路。
1 材料与方法
1.1 材料
1.1.1 生化试剂
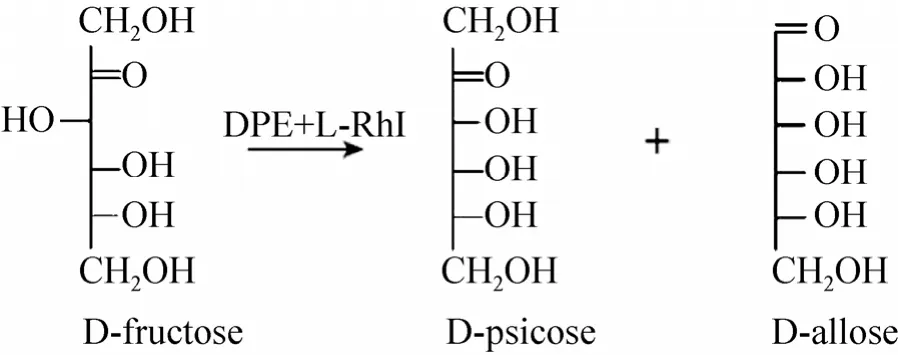
图1 双酶偶联转化系统的反应Fig. 1 Reaction of dual enzyme-coupled system.
D-果糖、 D-阿洛酮糖、D-阿洛糖等稀少糖购自Sigma Aldrich。蛋白胨、酵母粉、琼脂及其他试剂均为分析纯。
1.1.2 菌种
异源表达 DPE的菌种为 E. coli BL21 pET-RDPE,异源表达 L-RhI的菌种为 E. coli BL21 pET-21a-L-RhI,均为实验室前期构建。
E. coli的培养基为 Luria-Bertani (LB)培养基。
1.2 方法
1.2.1 酶的表达与纯化
分别将携带DPE和L-RhI基因的重组大肠杆菌接入含有终浓度为100 mg/L氨苄青霉素的LB培养基中,37 ℃、200 r/min培养至 OD600为0.8–1.0后,加入终浓度为0.5 mmol/L的IPTG,20 ℃、100 r/min继续培养过夜。
培养结束后,10 000 r/min离心5 min收集菌体,弃去上清,菌体沉淀用破碎缓冲液(50 mmol/L Tris-HCl,pH 8.0)悬浮,并在冰上超声破碎细胞,然后于 4 ℃、12 000 r/min离心30 min,上清即为粗酶液。
将粗酶液经过镍离子亲和层析柱纯化目标蛋白,所用纯化系统为ÄKTA PurifierTM100 (GE Healthcare Biosciences)。将粗酶液经0.45 μm的膜过滤后,上样 His-Trap 镍离子螯合柱(结合缓冲液:20 mmol/L Tris-HCl,0.5 mol/L NaCl,40 mmol/L 咪唑,pH 8.0),以高咪唑含量的缓冲液进行线性洗脱(洗脱缓冲液:20 mmol/L Tris-HCl,0.5 mol/L NaCl,0.5 mol/L 咪唑,pH 8.0)。收集目的蛋白洗脱峰,对于 DPE用50 mmol/L Tris-HCl缓冲液 (pH 8.0)进行脱盐和浓缩,对于L-RhI用50 mmol/L Glycine-NaOH缓冲液 (pH 9.0)进行脱盐和浓缩,SDS-PAGE检测纯化所得蛋白的纯度。
1.2.2 酶最佳比例的摸索
DPE、L-RhI双酶偶联系统转化D-果糖的标准反应体系为:以50 mmol/L Glycine-NaOH (pH 9.0)作为缓冲液,并添加1 mmol/L Mn2+,以2% D-果糖作为底物。DPE的加酶量为 0.05 mg/mL,L-RhI的加酶量分别为0.1、0.25、0.5 mg/mL,即两酶的质量比分别为1∶2、1∶5、1∶10。60 ℃下反应至平衡。
在不进位加法和进位加法的口算测试中,各年级被测所用时间的平均值和标准差如表1所示.为了便于分.析,分别以add11、add12、jadd11、jadd12表示“一位数加一位数”、“一位数加两位数不进位加法”、“一位数加一位数进位加法”和“一位数加两位数进位加法”.
1.2.3 最佳反应温度的摸索
以2% D-果糖作为底物,DPE和L-RhI的加酶量分别为 0.05 mg/mL和 0.5 mg/mL。在含有1 mmol/L Mn2+的50 mmol/L Glycine-NaOH缓冲液(pH 9.0)中,不同温度(30–70 )℃下反应5 h,沸水浴5 min终止反应,检测D-阿洛酮糖和D-阿洛糖的产率。
1.2.4 最佳反应pH的摸索
以2% D-果糖作为底物,DPE和L-RhI的加酶量分别为 0.05 mg/mL和 0.5 mg/mL。在含有1 mmol/L Mn2+的不同pH (5.0–10.0)的缓冲液中(pH 5.0、6.0使用醋酸-醋酸钠缓冲液,pH 7.0、8.0使用Tris-HCl缓冲液,pH 9.0、10.0使用甘氨酸-氢氧化钠缓冲液),60 ℃下反应5 h,沸水浴5 min终止反应,检测D-阿洛酮糖和D-阿洛糖的产率。
1.2.5 反应进程的测定
采用DPE、L-RhI双酶偶联系统转化D-果糖的标准反应体系:利用甘氨酸-氢氧化钠缓冲液(pH 9.0),以2% D-果糖作为底物,DPE和L-RhI的加酶量分别为0.05 mg/mL和0.5 mg/mL,60 ℃条件下反应至平衡。以HPLC测定D-果糖、D-阿洛酮糖和 D-阿洛糖随时间的变化趋势,绘制反应进程曲线。
1.2.6 糖的检测
2 结果与分析
2.1 酶的表达与纯化
携带DPE和L-RhI基因的重组菌经IPTG诱导后,均有蛋白表达,并且将菌体破碎后,发现表达产物几乎全部为可溶性蛋白,包涵体很少。
重组DPE和L-RhI蛋白经过His Trap HP亲和色谱一步纯化后,即得到纯度≥95%的电泳纯的重组蛋白质 (图2)。重组DPE和L-RhI蛋白的理论分子量分别约33 kDa和49 kDa,12%聚丙烯酰胺凝胶电泳的结果显示,目的蛋白条带大小符合预期。
RDPE的产量较高,每升发酵液产纯酶约为150 mg,该酶对D-果糖的酶活为8.95 U/mg[19];但L-RhI的产量较低,每升发酵液产纯酶只有大约10 mg,该酶对D-阿洛酮糖的酶活为0.32 U/mg[20]。
2.2 酶最佳比例的摸索
采用DPE、L-RhI双酶偶联系统转化D-果糖的标准反应体系,DPE和L-RhI的加酶质量比分别为 1∶2、1∶5、1∶10。以 HPLC测定产物的组分以及各组分的含量,结果如表1所示。

图2 DPE与L-RhI的纯酶电泳图Fig. 2 SDS-PAGE analysis of DPE and L-RhI pure enzyme.

表1 不同加酶量时反应液中各组分的含量Table 1 Content of sugars in reaction solution at different enzyme dosage
双酶偶联转化系统中,L-RhI的加入转化了部分的D-阿洛酮糖,使得DPE催化的反应向生成 D-阿洛酮糖的方向移动,从而提高了 D-果糖的转化率。另外,由于在反应体系中,DPE酶活较高,而L-RhI酶活较低,因此L-RhI是双酶偶联转化系统中的限速酶,其加入量较低时需要很长的时间反应才能达到平衡。
通过增加L-RhI的酶量,有助于D-阿洛糖的生成,当DPE:L-RhI=1∶10 (W/W),双酶偶联转化系统达到平衡时,此时D-果糖与D-阿洛酮糖的质量比约为 3∶1,D-阿洛酮糖与D-阿洛糖的质量比约为 2∶1,分别为两个酶催化反应平衡时的底物与产物的比例。
根据以上实验结果可以看出,通过提高L-RhI添加的比例,可以弥补该酶活性和稳定性较差的缺点。最终确定DPE和L-RhI加酶量的比例为 1∶10 (反应体系中 RDPE的终浓度为0.05 mg/mL)。此时,产物的组成如图3所示,除D-阿洛酮糖、D-阿洛糖以外,还有少量副产物出现。根据出峰时间推测该副产物应为D-葡萄糖,是因为反应时间过长,D-果糖在L-RhI催化作用下发生异构化,转化为D-葡萄糖。
2.3 双酶偶联转化系统最佳条件的探索
2.3.1 反应温度对转化效率的影响
实验结果如图4所示,随着温度的升高,D-阿洛酮糖和D-阿洛糖的含量逐渐增加。这是因为随着温度的升高,DPE和L-RhI的活性逐渐增强,在相同的反应时间内,果糖的转化效率也随之提高。但继续提高反应温度会加速酶的失活,使反应难以达到真正的平衡。实验表明:温度大于60 ℃时,DPE的活性会逐渐下降,并且酶的热稳定性也逐渐降低[19];而当温度分别为60 ℃、65 ℃、70 ℃和75 ℃时,反应1 h,L-RhI的相对酶活比为 100:91:35:30。因此该反应体系的最适反应温度确定为60 ℃。
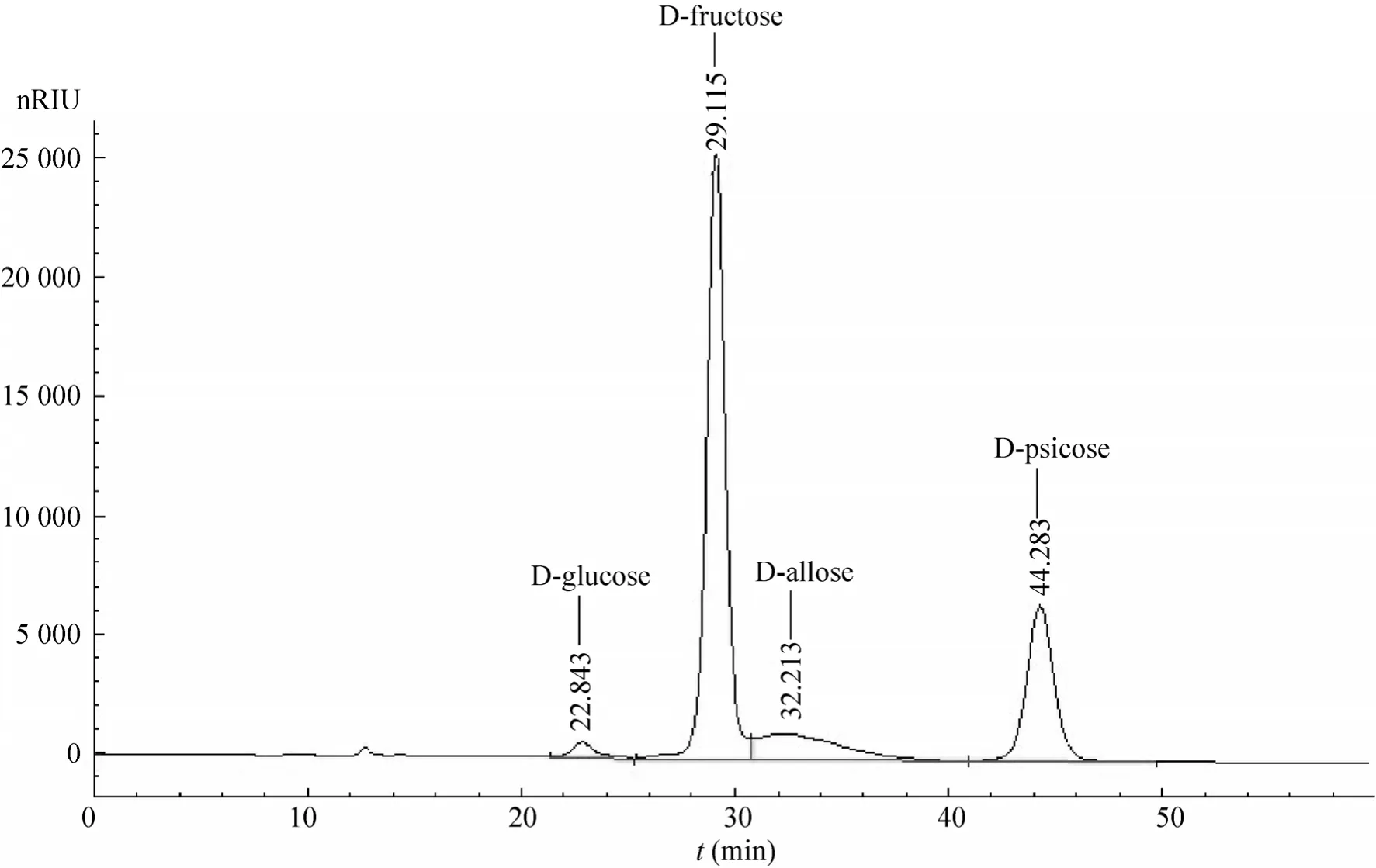
图3 反应平衡时反应液中各组分的HPLC分析Fig. 3 HPLC analysis of sugars in reaction solution at reaction equilibrium.

图4 温度对转化率的影响Fig. 4 Effect of temperature on the conversion rate.
2.3.2 反应pH对转化效率的影响
实验结果如图5所示,随着反应体系pH的升高,果糖转化率逐渐提高,稀少糖的总量和D-阿洛糖的含量明显增加。当pH为9.0和10.0时,生成的D-阿洛酮糖和D-阿洛糖的含量基本一致,且高于其他 pH下的产量。但是,当 pH为10.0时有副产物出现,而其他pH下几乎没有副产物出现。HPLC检测和标样对比显示该副产物可能为D-葡萄糖;Leang等报道来源于施氏假单胞菌Pseudomonas stutzeri的L-RhI可以催化D-葡萄糖和 D-果糖的相互转化[25],故推测 pH较高时,L-RhI对 D-果糖的活性变高,可以将D-果糖转化为 D-葡萄糖。综上所述,该反应体系的最适pH确定为9.0。

图5 pH对转化率的影响Fig. 5 Effect of pH on the conversion rate.
2.4 双酶偶联系统转化反应进程
以2%果糖作为底物测定DPE、L-RhI双酶偶联系统转化反应的进程曲线,结果如图6所示。可见DPE催化的D-果糖转化为D-阿洛酮糖的反应在很短的时间内就达到平衡,1 h后D-阿洛酮糖的含量基本没有明显变化。而L-RhI的催化活性较低,反应需经历较长的时间达到平衡。随反应进行,D-阿洛糖的含量逐渐增加,D-果糖的含量小幅下降,大约10 h后反应达到平衡。此时,D-果糖的含量约为 64%,比 DPE单酶反应平衡时的转化率有了较明显的增加。

图6 双酶偶联系统的反应进程Fig. 6 Reaction process of dual enzyme-coupled system.
3 结论
文中利用DPE和L-RhI构建双酶偶联反应体系,催化D-果糖生成D-阿洛酮糖和D-阿洛糖等功能性稀少糖。通过实验确定DPE和L-RhI加酶量的比例为 1∶10,其中 DPE 的浓度为0.05 mg/mL;转化反应的最佳温度为60 ℃,最佳pH为9.0。当D-果糖浓度为2%时,经过10 h反应达到平衡,此时 D-阿洛酮糖和 D-阿洛糖的产量分别为5.12和2.04 g/L。实验证明,多级反应生物转化,如酶的偶联反应,能够更有效地将廉价底物单糖转化为高附加值的稀少糖,可以作为功能性稀少糖开发应用的研究基础。
[1]Izumori K. Bioproduction strategies for rare hexose sugars. Naturwissenschaften, 2002, 89(3):120−124.
[2]Mu W, Zhang W, Feng Y, et al. Recent advances on applications and biotechnological production of D-psicose. Appl Microbiol Biotechnol, 2012, 94(6):1461−1467.
[3]Lu Y, Levin GV, Donner TW. Tagatose, a new antidiabetic and obesity control drug. Diabetes Obes Metab, 2008, 10(2): 109−134.
[4]Zeng Y, Zhang X, Guan Y, et al. Characteristics and antioxidant activity of Maillard reaction products from psicose-lysine and fructose-lysine model systems. J Food Sci, 2011, 76(3):C398−403.
[5]Chung MY, Oh DK, Lee KW. Hypoglycemic health benefits of D-psicose. J Agric Food Chem,2012, 60(4): 863−869.
[6]Hossain MA, Kitagaki S, Nakano D, et al. Rare sugar D-psicose improves insulin sensitivity and glucose tolerance in type 2 diabetes Otsuka Long-Evans Tokushima Fatty (OLETF)rats.Biochem Biophys Res Commun, 2011, 405(1):7−12.
[7]Hayashi N, Iida T, Yamada T, et al. Study on the postprandial blood glucose suppression effect of D-psicose in borderline diabetes and the safety of long-term ingestion by normal human subjects.Biosci Biotechnol Biochem, 2010, 74(3): 510−519.
[8]Ochiai M, Nakanishi Y, Yamada T, et al. Inhibition by dietary D-psicose of body fat accumulation in adult rats fed a high-sucrose diet. Biosci Biotechnol Biochem, 2013, 77(5): 1123−1126.
[9]Lim YR, Oh DK. Microbial metabolism and biotechnological production of D-allose. Appl Microbiol Biotechnol, 2011, 91(2): 229−235.
[10]Ishihara Y, Katayama K, Sakabe M, et al.Antioxidant properties of rare sugar D-allose:effects on mitochondrial reactive oxygen species production in Neuro2A cells. J Biosci Bioeng,2011, 112(6): 638−642.
[11]Tanaka S, Sakamoto H. Effects of D-allose on the endocytic activity of dendritic cells and the subsequent stimulation of T cells. Cell Immunol,2011, 271(1): 141−146.
[12]Murata A, Sekiya K, Watanabe Y, et al. A novel inhibitory effect of D-allose on production of reactive oxygen species from neutrophils. J Biosci Bioeng, 2003, 96(1): 89−91.
[13]Izumori K. Izumoring: a strategy for bioproduction of all hexoses. J Biotechnol, 2006, 124(4):717–722.
[14]Granström TB, Takata G, Tokuda M, et al.Izumoring: a novel and complete strategy for bioproduction of rare sugars. J Biosci Bioeng,2004, 97(2): 89−94.
[15]Poonperm W, Takata G, Okada H, et al. Cloning,sequencing, overexpression and characterization of L-rhamnose isomerase from Bacillus pallidus Y25 for rare sugar production. Appl Microbiol Biotechnol, 2007, 76(6): 1297−1307.
[16]Uechi K, Takata G, Fukai Y, et al. Gene cloning and characterization of L-ribulose 3-epimerase from Mesorhizobium loti and its application to rare sugar production. Biosci Biotechnol Biochem,2013, 77(3): 511−515.
[17]Li Y, Zhu Y, Liu A, et al. Identification and characterization of a novel L-arabinose isomerase from Anoxybacillus flavithermus useful in D-tagatose production. Extremophiles, 2011, 15(3):441−450.
[18]Menavuvu BT, Poonperm W, Takeda K, et al.Novel substrate specificity of D-arabinose isomerase from Klebsiella pneumoniae and its application to production of D-altrose from D-psicose. J Biosci Bioeng, 2006, 102(5):436−441.
[19]Zhu Y, Men Y, Bai W, et al. Overexpression of D-psicose 3-epimerase from Ruminococcus sp. in Escherichia coli and its potential application in D-psicose production. Biotechnol Lett, 2012,34(10): 1901−1906.
[20]Bai W, Zhu Y, Men Y, et al. Bioconversion of D-fructose to D-allose by novel isomerases. Chin J Biotech, 2012, 28(4): 457−465 (in Chinese).柏玮,门燕, 等. 以 D-果糖为原料利用新型异构酶转化生产 D-阿洛糖. 生物工程学报,2012, 28(4): 457–465.
[21]Mu W, Chu F, Xing Q, et al. Cloning, expression,and characterization of a D-psicose 3-epimerase from Clostridium cellulolyticum H10. J Agric Food Chem, 2011, 59(14): 7785−7792.
[22]Zhang L, Mu W, Jiang B, et al. Characterization of D-tagatose-3-epimerase from Rhodobacter sphaeroides that converts D-fructose into D-psicose. Biotechnol Lett, 2009, 31(6): 857−862.
[23]Kim HJ, Hyun EK, Kim YS, et al. Characterization of an Agrobacterium tumefaciens D-psicose 3-epimerase that converts D-fructose to D-psicose.Appl Environ Microbiol, 2006, 72(2): 981−985.
[24]Ishida Y, Kamiya T, Itoh H, et al. Cloning and characterization of the D-tagatose 3-epimerase gene from Pseudomonas cichorii ST-24. J Ferment Bioeng, 1997, 83(6): 529–534.
[25]Leang K, Takada G, Fukai Y, et al. Novel reaction of L-rhamnose isomerase from Pseudomonas stutzeri and its relation with D-xylose isomerase via substrate specificity. Biochim Biophys Acta,2004, 1674(1): 68–77.
