关于简化国产保健食品变更程序的研究
2014-10-27北京市保健品化妆品技术审评中心100053佘遥于春媛刘东红
北京市保健品化妆品技术审评中心(100053)佘遥 于春媛 刘东红
1 近五成产品未按程序变更
2005年7月《保健食品注册管理办法(试行)》正式实施后,国家食品药品监督管理总局(以下简称国家食药监管总局)对新批准的保健食品实行严格监管,具体措施之一就是将经国家食药监管总局审评并认可的原辅料、工艺环节、感官要求、理化指标、微生物指标、功效/标志性成分指标及检测方法等整合为质量标准或技术要求(以下简称技术要求),与产品说明书一起,作为《国产保健食品批准证书》的附件,随国产保健食品批准证书一同批准。从而落实了《保健食品管理办法》第十七条“保健食品生产者必须按照批准的内容组织生产,不得擅自改变产品的配方、生产工艺、企业产品质量标准以及产品名称、标签、说明书等”的规定。
随着科学技术的发展,保健食品的名称、辅料、工艺参数、技术要求、说明书等也要随科学进步而改变。按照《保健食品注册管理办法(试行)》的规定,申请人需要变更保健食品批准证书及其附件所载明内容时,应向食品药品监督管理部门提出变更申请,国家食药监管总局准予变更的,向申请人颁发《国产保健食品变更批件》。但笔者于2013年对146个北京市在产的保健食品的企业标准进行调查的结果显示,46%的产品在未取得《国产保健食品变更批件》的前提下,改变了《国产保健食品批准证书附件》中的辅料、技术要求等内容[1],这给保健食品带来安全隐患。
2 申请人擅自改变保健食品辅料、技术要求等的原因分析
2.1 保健食品法律法规体系有待健全 2009年《中华人民共和国食品安全法》正式实施,宣告着《中华人民共和国食品卫生法》作废。由此,《保健食品管理办法》、《保健食品注册管理办法(试行)》中所规定的罚则失去上位法依据,增加了各级食药监管部门、保健食品市场和消费者的风险。《食品安全法》实施后,保健食品监督管理等法规却未立即出台,在过去的数年中,保健食品生产企业需要改变产品技术要求等内容时,往往只是在质监或卫生行政部门办理企业标准备案时修改相应内容,而未按照《保健食品注册管理办法(试行)》规定的变更程序履行变更程序。
2.2 法定变更程序有待优化
2.2.1 部分情况变更无门 保健食品注册申请审批的产品配方、工艺、技术要求都仅是适用于中试生产的。保健食品生产企业在拿到批准证书准备开展大规模生产时,往往需要根据生产实际情况对配方中的辅料及工艺参数做部分微调。而《保健食品注册管理办法(试行)》明确规定,保健食品原辅料、工艺属于不得变更的内容。而一个品种研发、试制、试验的时间往往需要1~2年,受理后的审批平均又需要1~3年。由于近年我国食品安全国家标准频繁更新,许多保健食品在经过漫长审批得到批准证书后,质量标准中引用的国家标准就已经作废。此类品种必须将批准证书中引用的作废标准变更为现行的食品安全国家标准才能办理后继的生产许可。但是《保健食品注册管理办法(试行)》规定,办理质量标准变更的保健食品必须是已经生产销售的产品。辅料、工艺参数及未生产过的品种不得办理变更的规定造成生产企业既不能生产又无法变更的。生产企业在这种情况下,只能不履行变更程序,擅自改变相关内容。
2.2.2 法定的变更程序繁琐、流程时间长按照《保健食品注册管理办法(试行)》的规定,申请办理保健食品质量标准变更需要生产连续三个批号的样品,进行功效成分或标志性成分、卫生学、稳定性试验的自检,经省级食品药品监督管理部门试制现场核查、抽取复检样品,最终由国家食药监管总局技术审评、行政审批后才能获得《国产保健食品变更批件》。
为变更质量标准,申请人需要生产连续三个批号的样品,做稳定性自检试验,即使是做加速稳定试验,也需要至少4个月时间。省级食品药品监督管理部门在受理变更申请后需开展试制现场核查,并抽取复检样品送经国家食品药品监督管理总局认定的复核检验机构检验。国家食品药品监督管理总局组织技术审评、等待检验报告、实施行政审批又往往需要6个月以上的时间。一套变更流程走完,申请人需要付出三批样品生产、自检、检验机构检验的物质成本,接受省级食品药品监督管理部门检查的人力成本,总共1年以上的时间成本。
3 简化变更流程的研究
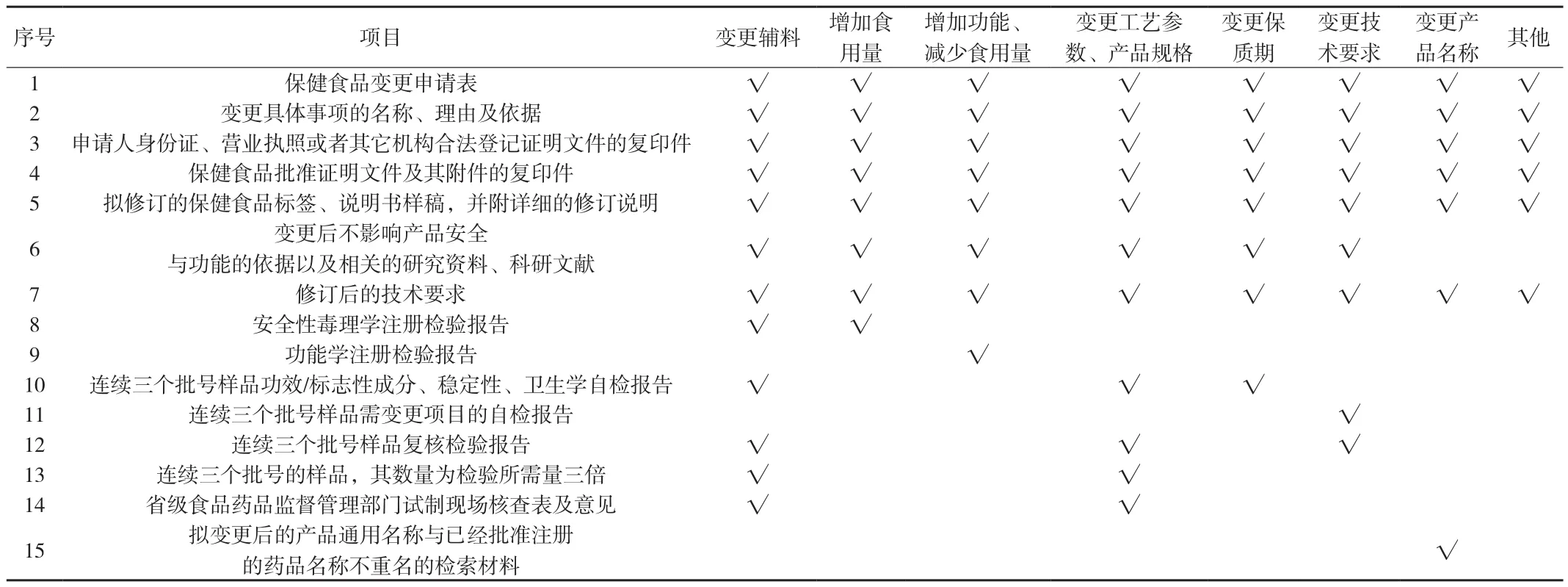
附表 变更申请所需材料
在《食品安全法》修订之际,《保健食品注册管理办法(试行)》也迎来了修订的时机。各级食药监管部门应抓住此次修法的机会,着力制定简单可行的保健食品变更程序,引导、督促保健食品生产企业通过合法途径办理保健食品变更。
3.1 原则 简化保健食品变更程序,应建立在审批行为符合相关法规,并确保保健食品的安全性、有效性、质量可控性的基础上。
3.2 法律依据 《保健食品注册管理办法(试行)》由原国家食品药品监督管理局公布,修订版本的《保健食品注册管理办法(试行)》也由国家食品药品监督管理总局负责起草和解释。此外,此次修订也是贯彻落实中央八项规定的具体措施,真正做到简政放权,提高办事效率。因此,简化保健食品变更程序符合国情国策,不存在法律障碍。
3.3 具体措施 ①保健食品批准证书中载明的可能影响安全、功能的内容不得变更。建议明确不得变更的内容包括保健食品原料、功能名称、工艺环节、食用方法以及扩大适宜人群范围、缩小不适宜人群范围。②申请变更辅料、增加食用量的,都对产品的安全性有潜在影响,应开展安全性毒理学试验。其中变更辅料会对产品工艺、稳定性产生潜在影响,还应开展功效/标志性成分、稳定性、卫生学试验和试制现场核查。由于此类变更涉及技术审评,因此应由国家食药监管总局负责审评和审批。③申请增加功能项目、减少食用量的,需要考察产品保健功能是否有效,应开展功能学试验。由于此类变更涉及技术审评,因此应由国家食药监管总局负责审评和审批。④申请变更工艺参数、产品规格的,需要考察产品的工艺和稳定性,应开展功效/标志性成分、稳定性、卫生学试验和试制现场核查;申请变更保质期的,应开展功效/标志性成分、稳定性、卫生学试验,根据试验结果制定保质期;申请变更产品技术要求的,为简化变更程序,开展相应项目的试验即可。这些变更事项,涉及技术审评,因此应由国家食药监管总局负责审评和审批。⑤申请变更产品名称的,不用作任何试验,由国家食药监管总局审批。⑥申请变更申请人名称、地址,缩小适宜人群范围,扩大不适宜人群范围,增加注意事项的,因不用作任何试验,且不影响产品安全、功能,不涉及技术审评,可下放至省级食药监管部门备案。⑦ 需提交的材料(见附表)。
4 建议
由于法规建设的滞后,近年来保健食品行业的发展已停滞不前。建议国家食品药品监督管理总局借机构改革和《中华人民共和国食品安全法》修订之机,完善保健食品监督管理法规,并着力解决以下三个问题:一是理清保健食品标准体系。建议在《食品安全法》中取消保健食品地方标准、企业标准的法律地位,并赋予国家食品药品监督管理总局审批保健食品标准的权利,保健食品批准证书上的技术要求作为该品种唯一具有合法地位的标准执行。二是开展食品安全国家标准、中国药典适用性研究。建议卫生与计划生育委员会、国家药典委员会公开相关标准制定时验证的范围,对未对保健食品开展验证的,由国家食品药品监督管理总局明确组织各有关单位分批开展研究。三是重新确定保健食品批准证书应批准的内容。建议不再批准,防止日后因标准的更新发生大量变更的情况。而部分对产品安全性、有效性、质量可控性更为关键的内容,如多数品种的原料标准、内包材标准、装量等内容却没有在保健食品批准证书上得到体现,让绝大多数保健食品申请人误认为这些内容可随意更改,留下风险隐患。
