超黄金治疗期的缺血性中风大鼠模型、治疗模式及疗效表述
2014-10-25蒋雪云张颖洁
蒋雪云 张颖洁 赵 明*
(1.首都医科大学医学实验与测试中心,北京100069;2.首都医科大学化学生物学与药学院,北京100069)
脑卒中俗称中风,临床将中风分为缺血性中风和出血性中风两种类型。缺血性中风患者的主要症状包括猝然昏倒、不省人事、口角歪斜、语言不利,以及半身不遂。缺血性中风发病率高、病死率高、致残率高、复发率高,预后差。缺血性中风、冠状动脉粥样硬化性心脏病(以下简称冠心病)和癌症在临床上并列为威胁人类健康的三大疾病。溶栓是临床治疗缺血性中风的唯一方案。组织纤溶酶原激活剂(tPA)是缺血性中风唯一有效的临床治疗药物。由于缺血性中风和出血性中风早期症状不易鉴别,而tPA有严重的出血不良反应,以及由于缺血性中风治疗受3 h黄金期限制,可用tPA施救的机会很少。创造无出血不良反应的缺血性中风治疗药物一直是新药研究的前沿[1-5]。形成对照的是,缺血性中风动物模型研究甚少。基于笔者对血栓治疗药物研究的长期兴趣和疗效判断的自身需求,本文研究了长时缺血性中风大鼠模型及其治疗模式和疗效表述。
1 材料与方法
1.1 大鼠的选择
首都医科大学伦理委员会认为,这里描述的大鼠实验方案符合日内瓦动物试验指南。体质量280~305 g的清洁级健康雄性SD大鼠[实验动物许可合格证号:SCXK(京)2006-0009],购自维通利华实验动物中心。文献[6-10]认为,SD大鼠和Wistar大鼠都可制造缺血性中风模型。对比两种大鼠,笔者发现价格低的SD大鼠种系纯合性好,脑血管变异小,解剖和生理特点更接近人类,抗感染力强,存活时间长,脑体积适宜。将SD大鼠自体血栓与0.9%的氯化钠注射液的悬浮液输入大脑中动脉,使大脑的中动脉支配区域形成的局灶性缺血性中风接近缺血性中风患者的临床病理过程,能够模拟临床缺血性中风,适合于评价缺血性中风溶栓治疗的疗效。
1.2 制备血栓
SD大鼠腹腔注射10%水合氯醛溶液,剂量为400 mg/kg,麻醉后分离颈动脉,取15 mL新鲜动脉血,按每10 μL 1份置于1.5 mL的EP管里,形成的血栓先室温放置2 h,再于冰箱中-20℃放置22 h。使用时加0.5 mL 0.9%的氯化钠注射液,用玻璃棒捣碎,制成大小均匀的血栓块的0.9%的氯化钠注射液悬浮液,通过显微镜观察到每个血栓块的体积大约为0.1 mm3。
1.3 缺血性中风大鼠模型制备及治疗方案
雄性SD大鼠腹腔注射10%水合氯醛溶液,剂量为400 mg/kg,麻醉后于颈部正中纵行切口,分离出右侧颈总动脉主干(约3 cm长)。于舌骨水平分离结扎颈外动脉各分支,于颈膨大处分离出颈内动脉。用无创动脉夹分别夹闭颈内动脉开口处和颈总动脉近心端,并结扎颈外动脉远端。于颈外动脉主干处插入导管(导管内装有0.5 mL血栓块的0.9%的氯化钠注射液悬浮液),在松开颈内动脉夹的同时将导管内的血栓块悬浮液缓慢从颈外动脉向近心端经过颈内动脉注入大脑中动脉。之后,结扎颈外动脉近心端,打开颈内动脉和颈总动脉处的动脉夹,恢复血流。或分离大颈外静脉,把0.9%的氯化钠注射液或药物从颈外静脉输入,缝合伤口,肌肉注射2万IU青霉素预防感染,得到缺血性中风大鼠立即1次性治疗方案;或缝合伤口,肌肉注射2万IU青霉素预防感染,4、6或24 h后把0.9%的氯化钠注射液或阳性药物(尿激酶和tPA)及治疗药物JXY(本实验室合成的小分子多肽,成分为:Gly-Arg-Pro-Ala-Lys-Arg-Gly-Asp-Val)从尾静脉输入,得到缺血性中风4、6或24 h大鼠1次性治疗方案;或者缝合伤口,肌肉注射2万IU青霉素预防感染,4、6或24 h后把0.9%的氯化钠注射液或药物从尾静脉输入,每天1次,连续7 d,得到缺血性中风4、6或24 h大鼠连续治疗方案。
1.4 缺血性中风大鼠的行为及疗效
缺血性中风大鼠0.9%的氯化钠注射液治疗组,中风后立即治疗组,中风4、6和24 h后治疗组的大鼠苏醒24 h后观察其行为和疗效。行为包括行走方式、右眼眼皮下垂程度、尾巴僵直程度、肌肉张力、脑袋偏斜程度、四肢支撑力和死亡数。行为改善程度,描述为可视性疗效。立即接受一次性药物治疗的缺血性中风大鼠的行为与立即接受一次性0.9%的氯化钠注射液治疗的缺血性中风大鼠的行为比较,获得可视性疗效。连续接受药物治疗的缺血性中风大鼠每隔24 h从尾静脉输注一次药物,第2天录像,比较自身行为,获得可视性疗效;与0.9%的氯化钠注射液治疗大鼠比较眼眶、爪、鼻尖、尾部出血状况,获得可视性不良反应。解剖之后,在肺、脾、胃和肠部可发现明显的出血状况。按照1.3项的方法诱发的缺血性中风大鼠的行为可描述为6种损伤程度:①苏醒之后24 h内死亡;②不能站立,尾巴僵直;③呈追尾状行走,脑袋偏斜,左侧前肢不能伸展,尾巴僵直;④呈追尾状行走,左侧前肢不能伸展,尾巴僵直;⑤转圈状行走,左侧前肢不能伸展,尾巴僵直;⑥转圈状行走,右眼皮不能完全抬起,尾巴僵直。最终处死大鼠,取大脑,切片,测脑梗死体积。
2 结果
2.1 中风后立即接受一次性JXY治疗的缺血性中风大鼠的行为
大鼠中风后立即接受一次性1 μmol/kg JXY治疗的疗效可依据给药24 h后的行为判断。0.9%的氯化钠注射液为空白对照,20 000 IU/kg尿激酶和3 mg/kg tPA为阳性对照。为了定量比较疗效,将上面提到的6种损伤变换为文献常用的5个分值,5分为24 h内死亡,0分为无任何损伤症状,表示治愈,详见表1。
大鼠中风后立即接受一次性0.9%的氯化钠注射液,20 000 IU/kg尿激酶,3 mg/kg tPA 和1 μmol/kg JXY治疗24 h后的行为(均未出现5分)为0分(治愈)的大鼠数分别为0%、10%、40%和60%;4分的大鼠数分别为10%、10%、10%和0%。0分和4分大鼠的数量说明1 μmol/kg JXY的疗效比20 000 IU/kg尿激酶和3 mg/kg tPA好。
2.2 中风4、6、24 h后连续接受药物治疗的缺血性中风大鼠的行为
大鼠中风4、6、24 h后接受药物治疗24 h之后,每隔24 h给1次药,分别连续给药4、6、8 d。大鼠的行为通过录像记录,自身比较。疗效可依据行为的改善来判断。经过药物连续治疗后不能站立和尾巴僵直的大鼠的行为损伤逐步恢复,最后可直线行走,不遗留任何运动障碍。大鼠体质量逐日增加。大鼠中风4 h后接受1 μmol/kg JXY连续治疗6次的结果,详见表2。
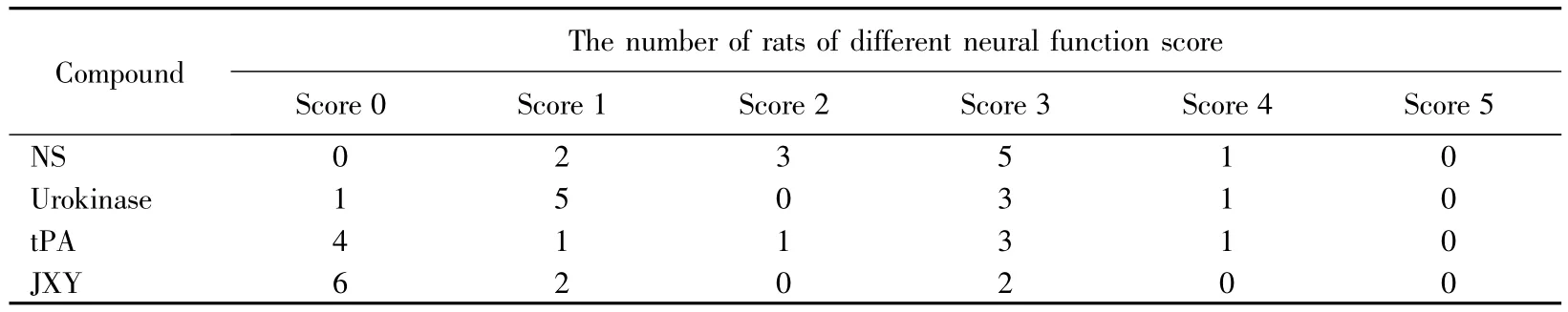
表1 大鼠中风后立即接受JXY一次性治疗的疗效Tab.1 Efficacy of acute ischemic stroke rats immediately received one time treatment of JXY
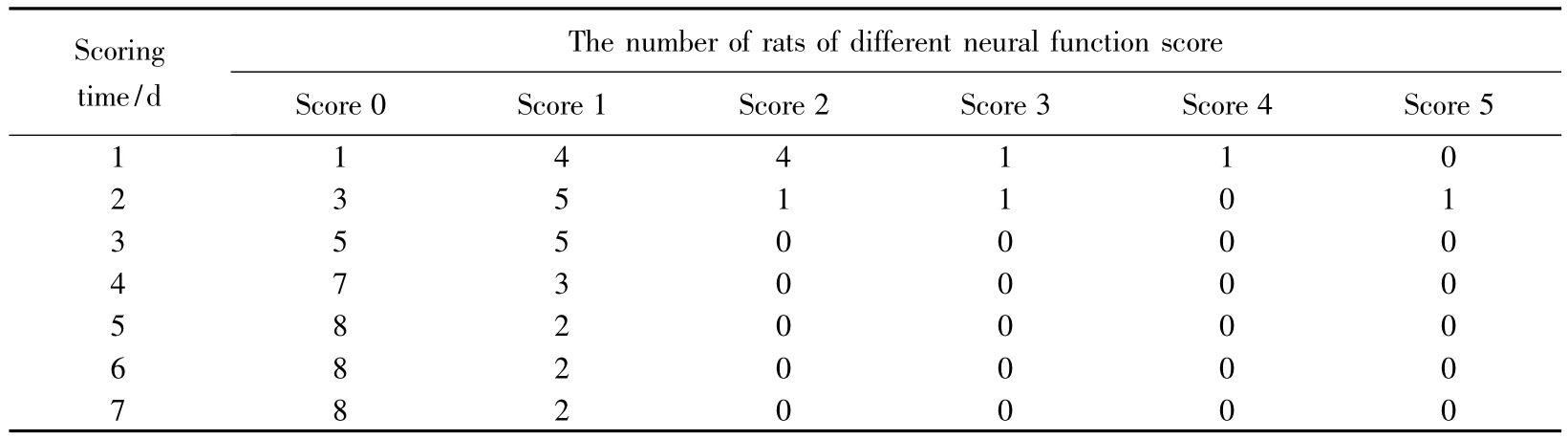
表2 大鼠中风4 h后1 μmol/kg JXY连续治疗6次的疗效Tab.2 Efficacy of six times continuous treating by 1 μmol/kg JXY in acute ischemic stroke rats 4 h after symptom onset
大鼠中风4 h后接受6次1 μmol/kg JXY连续治疗为0分(治愈)的大鼠数量从第1天的9%上升到第7天的73%,治愈率增高。
2.3 中风4 h后连续接受尿激酶和tPA治疗的缺血性中风大鼠的行为
由于严重的出血不良反应,20 000 IU/kg尿激酶和3 mg/kg tPA的连续治疗只允许2次,大鼠中风4 h后20 000 IU/kg尿激酶和3 mg/kg tPA连续治疗2次的结果,详见表3。大鼠中风4 h后接受2次20 000 IU/kg尿激酶连续治疗为0分(治愈)和1分的大鼠均为0%,5分(死亡)的大鼠为33%。连续治疗未提高治愈率。
大鼠中风4 h后接受2次3 mg/kg tPA连续治疗0分(治愈)的大鼠为0%。5分(死亡)的大鼠为17%。连续治疗可稍稍改善疗效,详见表3。
2.4 中风后JXY及tPA治疗的缺血性中风大鼠的脑切片
对中风4 h后接受1次1 μmol/kg JXY和3 mg/kg tPA治疗的大鼠,取大脑,切片。灰白色表示脑梗区,红色表示正常区(图1)。3 mg/kg tPA治疗的大鼠脑切片有明显灰白色的脑梗区(图1A)。1 μmol/kg JXY治疗的大鼠脑切片全部是红色正常区(图1B)。可见,1 μmol/kg JXY的疗效明显强于3 mg/kg tPA。
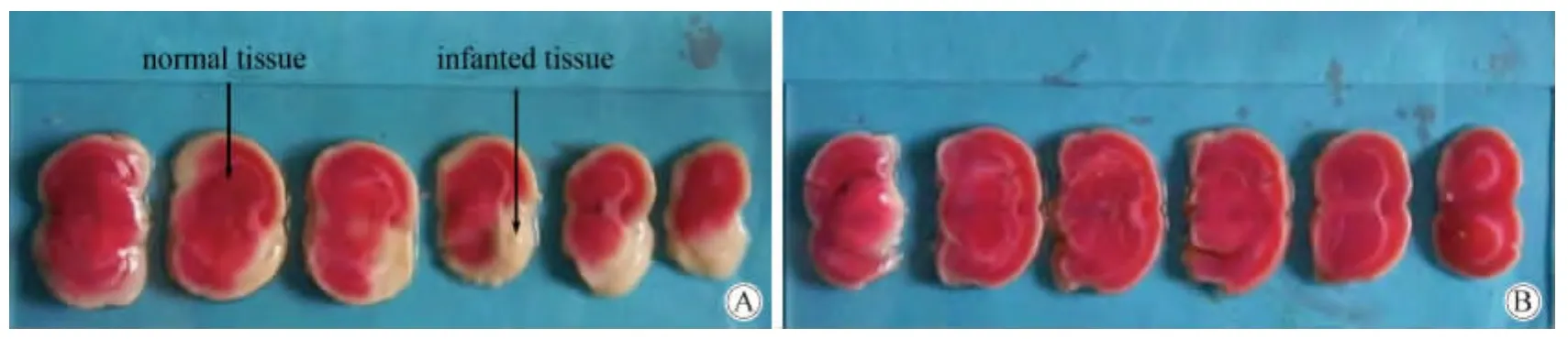
图1 TTC染色的大鼠脑切片Fig.1 Coronal slice of rats stained with TTC

表3 大鼠中风4 h后20 000 IU/kg尿激酶或3 mg/kg tPA连续治疗2次的疗效Tab.3 Efficacy of two times continuous treating by 20 000 IU/kg urokinase or 3 mg/kg tPA in acute ischemic stroke rats 4 h after symptom onset
2.5 药物的出血不良反应
接受尿激酶或tPA连续治疗3 d的中风大鼠可以看到眼眶、爪、鼻尖、尾部出血。在肺、脾、胃和肠部可看到明显的出血状况。大鼠无出血不良反应(图2)。tPA连续治疗3d,大鼠眼眶、爪、鼻和尾部都看到出血(图3)。tPA连续治疗3 d出血致死大鼠的肺、脾、胃和肠部可看到明显出血状况(图4)。
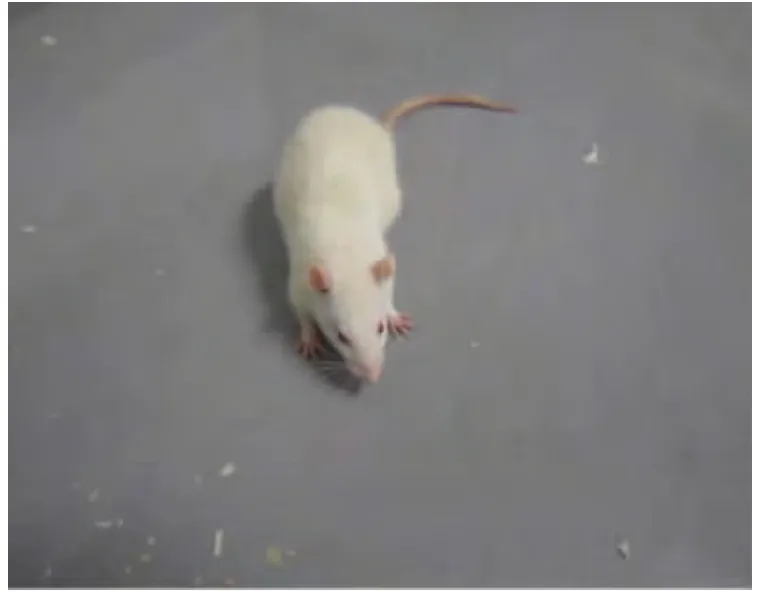
图2 无出血不良反应的大鼠Fig.2 Rats without bleeding side effects

图3 tPA连续治疗3d眼眶、爪、鼻和尾部都看到出血的大鼠Fig.3 Bleeding occurs in eyes,paw,nose and tail in rats treated with tPA for 3 consecutive days tPA:tissue plasminogenactivator.

图4 tPA连续治疗3d出血致死大鼠的肺、脾、胃和肠部可看到明显出血状况Fig.4 Significant bleeding occurs in lung,spleen,stomach and enteron in dead rats treated with tPA for 3 consecutive days tPA:tissue plasminogenactivator.
3 讨论
突破6 h黄金治疗时间(即中风6 h后疗效确切)和避免出血不良反应是缺血性中风临床治疗药物研究的2个瓶颈。建立缺血性中风时间长的大鼠模型,是突破第1个瓶颈的基础条件。评价标准实用化是突破第2个瓶颈的基础条件。文献[11-13]报道的大鼠模型缺血性中风时间最长为60 min和75 min,本研究的大鼠模型把缺血性中风时间延长至4、6、24 h。本研究将大鼠的行为细致分类,使缺血性中风大鼠的症状容易描述,疗效容易比较。分析缺血性中风大鼠的行为与病情,行为与疗效,疗程与疗效,以及行为与不良反应的关联性,使得药物的安全性和有效性可合理地用行为描述。对中风4、6、24 h的大鼠分别进行4、6和8 d连续治疗,使得药物的安全性和有效性可合理体现。疗效治疗还发现,大鼠在行为损伤逐步好转期间身体非常虚弱,无自主饮水和进食能力,体质量快速下降。行为损伤基本消失的大鼠因饥渴可突然死亡,例如大鼠中风4 h后接受6次1 μmol/kg JXY连续治疗的第2天就出现了1例死亡。针对缺血性中风使大鼠丧失自主饮水和进食能力,在连续治疗期间采取护理措施,使得患病大鼠的体质不干扰药物的疗效。用大鼠自身行为能力改善评价药物疗效,避免了分组打分时,组间比较给疗效描述带来的模糊性。大鼠中风4、6或24 h后连续治疗4、6和8 d,实际包含了缺血性中风大鼠定时模型和药物治疗策略两个要素。本研究结果显示,JXY对中风4、6或24 h大鼠的确切疗效映射了其在临床的应用价值。
[1]Yang G,Zhu H,Zhao M,et al.The application of tetrahydroisoquinoline-3-carbonyl-TARGD(F)F as anti-thrombotic agent having dual mechanisms of action[J].Mol Biosyst,2012,8(10):2672-2679.
[2]Gui L,Zhao M,Wang Y,et al.Synthesis,nanofeatures,in vitro thrombuslysis activity and in vivo thrombolytic activity of poly-alpha,beta-aspartyl-L-alanine[J].Nanomedicine(Lond),2010,5(5):703-714.
[3]Liu J,Wang Y,Yang Y,et al.Pyrolo[1,2:4,5]- 1,4-dioxopyrazino[1,2:1,6]-pyrido[3,4-b]indoles:a group of urokinase inhibitors,their synthesis and stereochemistry-dependent activity[J].Chem Med Chem,2011,6(12):2312-2322.
[4]Mei S,Liu J,Zhao M,et al.From Cerius2based stereoview to mouse and enzyme:The model systems for discovery of novel urokinase inhibitors[J].Mol Biosyst,2011,7(9):2664-2669.
[5]Li N,Kang G,Gui L,et al.Novel Cu(Ⅱ)-RGD-octapeptides:synthesis,coordination mode,in vitro anti-platelet aggregation/in vivo anti-thrombotic evaluation and correlation of sequence with nano-structure[J].Nanomedicine,2011,7(4):403-409.
[6]Guluma K Z,Lapchak P A.Comparison of the post-embolization effects of tissue-plasminogen activator and simvastatin on neurological outcome in a clinically relevant rat model of acute ischemic stroke[J].Brain Res,2010,1354:206-216.
[7]Wang C X,Todd K G,Yang Y.Patency of cerebral microvessels after focal embolic stroke in the rat[J].J Cereb Blood Flow Metab,2001,21(4):413-421.
[8]Zhang L,Zhang Z G,Zhang R L,et al.Postischemic(6-hour)treatment with recombinant human tissue plasminogen activator and proteasome inhibitor PS-519 reduces infarction in a rat model of embolic focal cerebral ischemia[J].Stroke,2001,32(12):2926-2931.
[9]Gutiérrez-Fernández M,Rodríguez-Frutos B,álvarez-Grech J,et al.Functional recovery after hematic administration of allogenic mesenchymal stem cells in acute ischemic stroke in rats[J].Neuroscience,2011,175:394-405.
[10]Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[11]Encarnacion A,Horie N,Keren-Gill H,et al.Long-term behavioral assessment of function in an experimental model for ischemic stroke[J].J Neurosci Methods,2011,196(2):247-257.
[12]Hetze S,Romer C,Teufelhart C,et al.Gait analysis as a method for assessing neurological outcome in a mouse model of stroke[J].J Neurosci Methods,2012,206(1):7-14.
[13]Traystman R J.Animal models of focal and global cerebral ischemia[J].ILAR J,2003,44(2):85-95.
