严重高三酰甘油血症对小鼠生育及其后代糖脂代谢的影响
2014-10-25马亚红阿布杜拉热西提谢北辰杨金奎刘国庆
马亚红 阿布杜拉·热西提 谢北辰 郭 鑫 杨金奎 刘国庆*
(1.北京市普仁医院内分泌科,北京100062;2.北京大学心血管研究所教育部分子心血管学重点实验室,北京100191;3.首都医科大学附属北京同仁医院内分泌科,北京100730)
流行病学研究[1]表明,高三酰甘油血症(hypertriglyceridemia,HTG)是动脉粥样硬化的独立危险因子之一,同时还会引起多器官的损害,例如胰腺炎[2]、肾功能损害[3]、神经系统障碍[4]和糖代谢异常[5]等。
HTG常伴发于妊娠,因为在正常妊娠过程中,随着雌激素浓度增加及胰岛素抵抗的增强,糖脂代谢将发生明显改变。自妊娠中期开始,脂肪贮量增加而利用减少,孕晚期脂肪组织较非妊娠期增加1.5~2.0倍,而血浆三酰甘油(triglycerides,TG)也可升高2~3倍,最高达200~300(1 mg/dL=0.011 3 mmol/L),然后逐渐下降,在产后6周接近妊娠前浓度[6]。若妊娠前就有高脂血症,则有可能发生严重HTG而诱发急性胰腺炎,其时孕产妇病死率为20%~50%,胎儿畸形、流产、早产、生长受限等不良妊娠结局明显增高[7-8]。但关于HTG对后代出生后的远期影响如糖脂代谢的影响未见报道。
本研究应用雌性载脂蛋白CIII(apolipoprotein CIII,Apo CIII)转基因的严重HTG小鼠与正常雄性小鼠交配,并以正常雌性及雄性小鼠交配作为对照组,以观察HTG小鼠是否能正常妊娠、分娩。成年Apo CIII转基因的严重 HTG小鼠糖耐量正常[9],本研究将进一步探讨雌性HTG小鼠对幼年后代TG以及与TG代谢密切相关的糖代谢的影响。
1 材料和方法
1.1 小鼠的制备和繁殖
实验用C57B6背景的Apo CIII转基因小鼠来源于美国Jackson实验室,由北京大学医学部实验动物中心SPF级动物房饲养。经与ICR背景小鼠杂交5代,得到易于繁殖的ICRApo CIII转基因小鼠用于本实验,实验动物许可证号:LA2010-059。
共6只转基因雌性小鼠,与6只正常雄性小鼠交配;6只正常雌性小鼠,与6只正常雄性小鼠交配得到后代。于小鼠出生14 d离乳前1周测定禁食后2 h血浆 TG和总胆固醇 (total cholesterol,TC)浓度,依据血浆TG浓度将后代分为3组:母亲为转基因的正常后代(maternal control,MC)和转基因后代(maternal transgenic,MT)及正常对照组(normal control,NC)。从3组后代中每组采用数字表法随机抽取8只进行血脂、血糖和胰岛素检测。
1.2 试验方法
测量3组后代小鼠出生时体质量并监测小鼠生长情况,分别于出生3、6、9、12、14、28 d 测量3 组小鼠体质量。
将上述3组动物饲养至28 d时即离乳后1周,禁食4 h后内眦采血,放入离心管中,肝素抗凝,4℃下4 000 r/min离心10 min,分离出血浆,3组吸取血浆测定血浆 TG、TC、空腹血糖(fasting blood glucose,FBG)和空腹胰岛素(fasting insulin,FINS)浓度。其中,MT组FBG和FINS在20 000 r/min超速离心30 min后取脂肪层下的去脂血浆进行测定。
3组小鼠过夜禁食16 h(但不禁水),50%的葡萄糖3g/kg灌胃,灌胃前及灌胃后30、60、90和120 min,内眦采血放入离心管中,肝素抗凝,4℃下4 000 r/min离心10 min,分离出血浆测定血浆葡萄糖(blood glucose,BG),其中MT组在20 000 r/min超速离心30 min后取脂肪层下的去脂血浆进行测定。
1.3 血浆生化检测
血浆TG和TC、BG浓度均用酶反应比色法检测,应用BIO-RAD MODEL 550酶标仪,检测试剂盒购自北京中生北控科技股份有限公司,详细操作方法参考试剂盒说明书。
1.4 胰岛素检测
应用双抗体夹心ELISA法测定标本中小鼠胰岛素水平,应用BIO-RAD MODEL 550酶标仪,检测试剂盒购自上海依科赛生物制品有限公司,详细操作方法参考试剂盒说明书。
稳态模型评估胰岛素抵抗指数(homeostasis model assessment-insulin resistant index,HOMA-IR)计算公式如下:HOMA-IR=空腹血糖×空腹胰岛素/22.5。
1.5 统计学方法
使用SPSS11.5进行统计学处理,资料均呈正态分布,方差齐,均数以均数±标准差(±s)表示,组间比较采用单因素方差分析方法及单因素重复测量数据方差分析法检验,以P<0.05认为差异有统计学意义。
2 结果
2.1 Apo CIII转基因导致的严重HTG对雌性小鼠生育能力无影响
Apo CIII转基因严重HTG的雌性小鼠可正常妊娠、分娩及哺乳。6只Apo CIII转基因雌性小鼠与6只正常雄性小鼠交配共得到6窝71只后代,6只正常雌性小鼠,与6只正常雄性小鼠交配;共得到6窝70只后代。测定出生14 d小鼠的血浆TG,其中37只TG浓度<300 mg/dL,为MC组,33只TG水平>1500 mg/dL,为MT组。Apo CIII转基因的雌性小鼠生育后代(MC及MT)数量与正常雌雄小鼠交配生育的对照组后代(NC)数量相比,差异无统计学意义(图1)。同样,MC及MT组小鼠出生体质量及生长速度均与NC组小鼠差异无统计学意义(图2)。
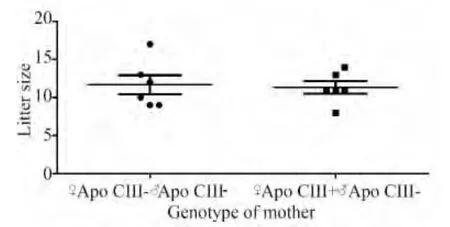
图1 Apo CIII转基因的雌性小鼠生育后代数量与对照组的比较Fig.1 Comparison of litter size between female Apo CIII transgenic mice(♀Apo CIII+♂Apo CIII-)and normal controls(♀Apo CIII-♂Apo CIII-)

图2 Apo CIII转基因的雌性小鼠生育后代与对照组生育后代的生长曲线Fig.2 The growth curve of Apo CIII transgenic offspring of female mice and the control group offspring
2.2 Apo CIII转基因的雌性小鼠的转基因后代血浆TG及TC浓度明显增高
Apo CIII转基因的雌性小鼠的转基因后代血浆TG及TC水平于出生14及28 d均较非转基因后代及正常对照组显著升高(P<0.01),Apo CIII转基因的雌性小鼠的非转基因后代及正常对照组TG及TC浓度差异无统计学意义,详见表1。
表1 Apo CIII转基因的雌性小鼠的转基因后代血脂水平与其他组的比较Tab.1 Comparisons of lipid testing between maternal transgenic and other groups(±s)

表1 Apo CIII转基因的雌性小鼠的转基因后代血脂水平与其他组的比较Tab.1 Comparisons of lipid testing between maternal transgenic and other groups(±s)
*P<0.01 vs MC and NC group;MT:maternal transgenic;MC:maternal control;NC:normal control;TG:triglycerides;TC:total cholesterol.
TG TC Group 14 days 28 days MT 4 276.9±1 766.0* 3 148.9±803.7* 572.4±127.6* 444.8±117.9 14 days 28 days*MC 212.8±131.5 84.6±20.5 235.8±81.2 118.8±21.5 NC 205.3±87.0 72.9±22.7 265.9±40.8 126.3±13.4
2.3 Apo CIII转基因的雌性小鼠的母转基因后代离乳后幼鼠发生糖耐量异常和胰岛素抵抗
3组动物的FBG差异无统计学意义,但MT组小鼠灌胃后30 min BG显著高于MC、NC组(P<0.01),3组动物灌胃后60、90和120 min BG比较,差异均无统计学意义。Apo CIII转基因雌鼠的HTG后代表现为轻度糖耐量受损,而Apo CIII转基因雌鼠所产的非HTG后代则糖耐量正常,与对照组比较,差异无统计学意义(图3)。MT组小鼠FINS浓度较其他2组明显增高(P<0.05),HOMA-IR也较其他2组增高(P<0.05)。这提示MT组幼鼠在出生后28 d已经出现胰岛素抵抗(图4)。

图3 Apo CIII转基因的雌性小鼠的转基因后代口服葡萄糖耐量实验与其他组的比较Fig.3 Comparison of oral glucose tolerance tests results among maternal transgenic and other groups
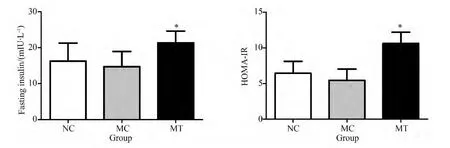
图4 Apo CIII转基因的雌性小鼠的转基因后代Fins及HOMA-IR与其他组的比较Fig.4 Comparison of fasting insulin and HOMA-IR among maternal transgenic and other groups
3 讨论
HTG主要由富含三酰甘油脂蛋白(triglyceriderich lipoproteins,TRLs)的代谢障碍所引起,是代谢综合征的主要表现之一。环境因素在HTG的发生中起重要作用,如高脂、高碳水化合物的饮食习惯,缺乏体力活动等。遗传因素如水解TRLs中三酰甘油的脂蛋白脂酶(lipoprotein lipase,LPL)及调控LPL活性的载脂蛋白、转运体、活化因子等基因的变异,可通过与环境因素的相互作用而影响HTG的发生,在脂代谢中发挥重要作用。Apo CⅢ作为对代谢TRLs起重要作用的 LPL的抑制物[10],与 HTG 的发生密切相关[11]。最近有关Apo CⅢ的重要发现[12]为一种杂合的Apo CⅢ突变体(R19X)人群血浆Apo CⅢ和TG下降。同时,其血管造影证实的冠状动脉粥样硬化发生率明显低于对照人群。研究[12]结果表明,Apo CⅢ的R19X突变是一个有益突变。家族性高三酰甘油血症(familial hypertriglyceridemia,FHTG)是一种常染色体显性遗传性疾病,在一般人群中患病率为1/400~1/300,其血浆三酰甘油浓度通常为 300~800 mg/dL[13],而Apo CIII转基因小鼠血浆TG浓度是正常对照的5~10倍[14],在普通喂养的条件下其TG浓度可达到300 mg/dL 以上[14]。
本研究应用Apo CIII转基因小鼠,建立了经母系遗传的严重HTG后代,同时获得血浆三酰甘油水平正常的阴性的同窝对照后代。Apo CIII转基因介导的严重HTG按照孟德尔规律遗传,母系的后代中基本是一半为正常,一半为Apo CIII转基因的严重HTG。MT及MC组小鼠出生体质量及生长速度均与NC组小鼠差异常无统计学意义,显示Apo CIII转基因造成的雌鼠严重HTG对后代不同基因型的个体发育没有明显影响。
然而,本研究组发现,MT组的TG和TC浓度在哺乳期和离乳后比MC及NC非常显著增高,而MC及NC TG及TC浓度比较差异无统计学意义。母系遗传HTG幼年小鼠(MT)的糖耐量异常、空腹胰岛素水平较MC、NC组明显增高,对血浆空腹葡萄糖浓度没有影响;根据血浆空腹胰岛素和血糖水平计算的HOMA-RI依然是MT组最高,且差异有统计学意义。结果提示,Apo CIII转基因的严重HTG母亲对幼年后代的糖脂代谢的影响只针对于转基因后代。糖尿病患者经常伴有脂代谢异常(HTG和低HDL为主)[15]。其原因可能是,胰岛素抵抗可明显促进肝脏VLDL的合成和分泌形成HTG,但原发性HTG对糖代谢的影响尚不明确。Pollex等[16]发现,一种LPL基因突变人群(LPL291)的HTG与2型糖尿病有正相关性,也意味着HTG可能会导致糖代谢异常。笔者之前的实验研究[5]发现,LPL基因缺陷导致的严重 HTG小鼠有明显的一相胰岛素分泌减少,且在高龄期发生胰岛素抵抗和胰腺β细胞增生。结合本研究新发现的母系遗传HTG可以促进胰岛素抵抗,说明不同原因的原发性HTG是有可能对糖代谢产生一定影响的。然而,Reaven等[17]曾经应用相同严重HTG的Apo CIII转基因小鼠,发现在正常条件和链霉硫脲(streptozocin,STZ)诱发糖尿病后,其机体糖代谢改变与非转基因对照小鼠差异无统计学意义。而本研究发现母系遗传的严重HTG会影响幼年后代糖代谢。由于在转基因动物的繁育中,通常是以转基因父本与非转基因母本交配而产生转基因后代,或混合了母系和父系遗传的转基因后代进行研究,因此,未来有必要进一步研究经母系和父系遗传的HTG对后代糖脂的代谢影响有无差异。
本研究虽然未能对母系遗传HTG促进胰岛素抵抗的发生机制进行探索,但表观遗传很有可能起到重要作用。表观遗传现象发生在环境因素和基因组的互作界面,如ApoE基因缺陷小鼠母亲的高胆固醇血症导致基因组某些区域的基因甲基化和/或染色质的修饰从而引起胆固醇合成的基因影响胚胎的通过诱导甲基化或去甲基化活性的增加,对基因组某些区域进行了修饰,从而增加了后代对动脉粥样硬化的易感性[18-20]。这些发现表明,母亲体内环境的负性改变导致了胚胎中某些基本的细胞过程发生了重编程,由此可能导致母系和父系遗传对后代的不同作用,而确切机制还需要进一步的研究,如果在严重HTG患者中母系遗传也会影响后代的糖代谢,这对临床实践是有指导意义的。
[1]Sarwar N,Danesh J,Eiriksdottir G,et al.Triglycerides and the risk of coronary heart disease:10,158 incident cases among 262,525 participants in 29 western prospective studies[J].Circulation,2007,115(4):45-48.
[2]Gan S I,Edwards A L,Symonds C J,et al.Hypertriglyceridemia-induced pancreatitis:a case-based review[J].World J Gastroenterol,2006,12(44):7197-7202.
[3]Prinsen B H,de Sain-vander Velden M G,de Koning E J,et al.Hypertriglyceridemia in patients with chronic renal failure:possible mechanisms[J].Kidney Int Suppl,2003,(84):S121-S124.
[4]Xian X,Liu T,Yu J,et al.Presynaptic defects underlying impaired learning and memory function in lipoprotein lipasedeficient mice[J].J Neurosci,2009,29(14):4681-4685.
[5]Ding Y L,Wang Y H,Huang W,et al.Glucose intolerance and decreased early insulin response in mice with severe hypertriglyceridemia[J].Exp Biol Med,2010,235(1):40-46.
[6]Koukkou E,Watts G F,Lowy C.Serum lipid,lipoprotein and apolipoprotein changes in gestational diabetes mellitus:a cross-sectional and prospective study[J].J Clin Pathol,1996,49(8):634-637.
[7]Swisher S G,Hunt K K,Schmit P J,et al.Management of pancreatitis complicating pregnancy[J].Am Surg,1994,60(10):759-762.
[8]Eddy J J,Gideonsen M D,Song J Y,et al.Pancreatitis in pregnancy[J].Obstet Gynecol,2008,112(5):1075-1081.
[9]Reaven G M,Mondon C E,Chen Y D,et al.Hypertriglyceridemic mice transgenic for the human apolipoprotein C-III gene are neither insulin resistant nor hyperinsulinemic[J].J Lipid Res,1994,35(5):820-824.
[10]Brown W V,Baginsky M L.Inhibition of lipoprotein lipase by an apoprotein of human very low density lipoprotein[J].Biochem Biophys Res Commun,1972,46(2):375-382.
[11]Wang C S,McConathy W J,Kloer H U,et al.Modulation of lipoprotein lipase activity by apolipoproteins.Effect of apolipoprotein C-III[J].J Clin Invest,1985,75(2):384-390.
[12]Pollin T I,Damcott C M,Shen H,et al.A null mutation in human APOC3 confers a favorable plasma lipid profile and apparent cardioprotection[J].Science,2008,322(5908):1702-1705.
[13]Stalenhoef A F,Demacker P N,Lutterman J A,et al.Plasma lipoproteins,apolipoproteins,and triglyceride metabolism in familial hypertriglyceridemia[J].Arteriosclerosis,1986,6(4):387-394.
[14]Ito Y,Azrolan N,O'Connell A,et al.Hypertriglyceridemia as a result of human apo CIII gene expression in transgenic mice[J].Science,1990,249(4970):790-793.
[15]Howard B V,Mayer-Davis E J,Goff D,et al.Relationships between insulin resistance and lipoproteins in nondiabetic African Americans, Hispanics, and non-Hispanic whites:the Insulin Resistance Atherosclerosis Study[J].Metabolism,1998,47(10):1174-1179.
[16]Pollex R L,Hegele R A.Genetic determinants of the metabolic syndrome[J].Nat Clin Pract Cardiovasc Med,2006,3(9):482-489.
[17]Reaven G M,Mondon C E,Chen Y D,et al.Hypertriglyceridemic mice transgenic for the human apolipoprotein C-III gene are neither insulin resistant nor hyperinsulinemic[J].J Lipid Res,1994,35(5):820 -824.
[18]Goharkhay N,Tamayo E H,Yin H,et al.Maternal hypercholesterolemia leads to activation of endogenous cholesterol synthesis in the offspring[J].Am J Obstet Gynecol,2008,199(3):273.e1 -6.
[19]崔常清.胰岛素抵抗的机制与临床研究进展[J].中国煤炭工业医学杂志,2012,15(7):1119 -1121.
[20]胡丽叶,朱旅云,李晓玲,等.不同糖耐量人群胰岛素抵抗指数及血管内皮功能变化的意义[J].临床误诊误治,2010,23(4):309 -311.
