在线富集离子色谱-质谱联用法同时测定饲料添加剂中的16种有机酸
2014-10-22熊治渝周洪斌
熊治渝,董 英*,周洪斌,余 杨,李 静,孙 莉
(1.江苏大学食品与生物工程学院,江苏 镇江 212013;2.国家食品添加剂及调味品检测重点实验室,江苏 镇江 212008)
有机酸及其盐类化合物由于其结构含有酸根而 有特殊的化学性质,可作为酸化剂、防腐剂等添加于饲料中。有机酸具有可以改变畜禽肠道微生物菌群,抑制、杀灭有害菌,改善饲料适口性,促进矿物质和维生素的吸收,提高饲料消化率等功能[1-4],如今已成为饲料中抗生素最普及的替代品。饲料中添加适量的酸化剂可以促进肠道有益菌群如乳酸杆菌的生长繁殖,但添加过少可能起不到酸化日粮的作用,添加过量则会引起动物适口性下降和体内代谢的紊乱。我国GB/T 22142-2008明确规定了饲料中10种有机酸添加剂的通用要求,因此对有机酸种类与含量的监控可作为评价饲料质量的重要指标。
已报道对有机酸测定的方法很多,包括酸碱滴定法[5]、分光光度法[6]、毛细管电泳法[7,8]、色谱法[9]等。上述方法中,由于色谱法最为灵敏、准确而得到广泛运用,但其也存在不足之处。采用气相色谱法(GC)[10]和气相色谱-质谱联用法(GCMS)[11]进行测定时,由于大多有机酸需要进行衍生化,因此样品预处理较为繁冗,且衍生化反应不易定量;采用高效液相色谱法(HPLC)[12-14]及高效液相色谱-质谱联用法(HPLC-MS)[15,16]进行测定时,其流动相多含有甲醇、乙腈等有机溶剂,在一定程度上影响环境和人体健康,且HPLC多采用紫外检测器检测,以保留时间定性,容易出现假阳性结果。
目前涉及饲料中有机酸的研究报道较少[17-19]。曾有运用在线富集的方式,以HPLC-MS/MS检测磺酰脲和抗生素的报道[20,21];也有以在线富集离子色谱法(IC)测定奶粉中碘和硫氰酸盐的报道[22]。而以在线富集的方式对有机酸进行分析测定的方法在国内外还未见报道。本文采用在线富集的方式结合IC-MS对样品中的有机酸进行定性、定量分析,分离速度快,有机酸检测灵敏度高,且避免了假阳性结果的产生。
1 实验部分
1.1 仪器、材料与试剂
OTS550型无油空气压缩机(台州奥突斯工贸有限公司);Haskel AW-60高压匀浆装柱系统(天津倍思乐色谱技术开发中心);20 mm×4.6 mm色谱柱管和250 mm×1.0 mm色谱柱管(进口柱,北京瑞景泽佑公司);5 μm的以硅胶为基质的带氨丙基的弱阴离子交换填料及5 μm的以硅胶为基质的带季铵盐的强阴离子交换填料、30 μm的惰性材料(本实验室制备);200 μL定量环(本实验室制备);Dionex ICS-3000型离子色谱仪(美国戴安公司),配有Dionex AS自动进样器、ASRS 3004-mm抑制器、DS60电导检测器、Chromeleon 6.8色谱工作站;自制富集柱和自制分离柱;MSQ质谱仪(Thermo Scientific公司),配大气压化学电离源(APCI)、Dionex AXP-MS独立泵;XW-80A涡旋混合器(上海医科大学仪器厂);H-2050R高速冷冻离心机(长沙湘仪离心机仪器有限公司);水相针式滤器(SCAA-101,上海安谱科学仪器有限公司);Milli-Q超纯水一体机(Millipore公司)。
乙腈、甲醇(德国Merck公司);50%(质量分数)氢氧化钠(NaOH)溶液。16种有机酸标准品:乳酸、磷酸、柠檬酸、草酸、苹果酸、焦谷氨酸、甲酸、丙酮酸、丁二酸、D-酒石酸、丙二酸、马来酸、富马酸、α-酮戊二酸、D-奎尼酸、反-乌头酸(纯度 >99%,北京瑞景泽佑公司)。
1.2 溶液配制
16种有机酸标准储备液和工作液:准确称取适量的16种有机酸标准品,用超纯水配制成2000 mg/L的标准储备液,置于4℃冰箱中保存。用超纯水将16种有机酸储备液稀释成不同质量浓度的混合标准工作液。
1.3 分离柱与富集柱的制备
分离柱:将250 mm×1.0 mm空色谱柱管与高压匀浆装柱系统中转换柱相连。在无油空气压缩机的作用下,用甲醇将甲醇溶解超声后的混合填料(弱阴离子、强阴离子交换填料按1∶2(质量比)混合)装入分离柱,装柱压力控制在13.79 MPa。结束后将分离柱与转化柱分离,并迅速装上筛板,以防止柱内填料自动挤出,造成柱内填料的自然塌陷。
富集柱:富集柱(20 mm×4.6 mm)的制备过程与分离柱相似。不同的是富集柱填料为带季铵盐的强阴离子交换填料,且两端各添加了0.2 cm厚耐酸碱的惰性材料。装柱压力控制在10.34 MPa。
1.4 样品前处理
精确称取市售饲料添加剂样品0.2 g于10 mL离心管中,加入2 mL正己烷饱和的乙腈和1 mL水,涡旋混匀后高速冷冻离心(5000 r/min,-15℃)20 min,取500 μL清液于试管中,氮气吹干后加水复溶,过0.45 μm水相滤膜备用。
1.5 IC-MS 条件
色谱柱:自制分离柱和富集柱。淋洗液:NaOH溶液。梯度洗脱程序:0~3 min,0~10.0 mmol/L(线性梯度);3~5 min,10.0 mmol/L;5~10 min,10.0~20.0 mmol/L;10~15 min,20.0~30.0 mmol/L;15~18 min,30.0~40.0 mmol/L;18~21 min,40.0~50.0 mmol/L;21~24 min,50.0~60.0 mmol/L;24~26.5 min,60~80.0 mmol/L;26.5~35 min,0.0 mmol/L。梯度泵流速:0.45 mL/min(分离柱淋洗液)。恒流泵流速:1.0 mL/min(为抑制器提供水源)。ASRS 3004-mm抑制器电流:151 mA。进样量:200.0 μL。独立泵供水流速:0.7 mL/min。富集时间:3 min。
质谱采用APCI负离子化模式;离子源温度450℃;雾化气为氮气(纯度为 99.9%、压力 379.2 kPa)。各有机酸的特征离子、保留时间参数见表1。
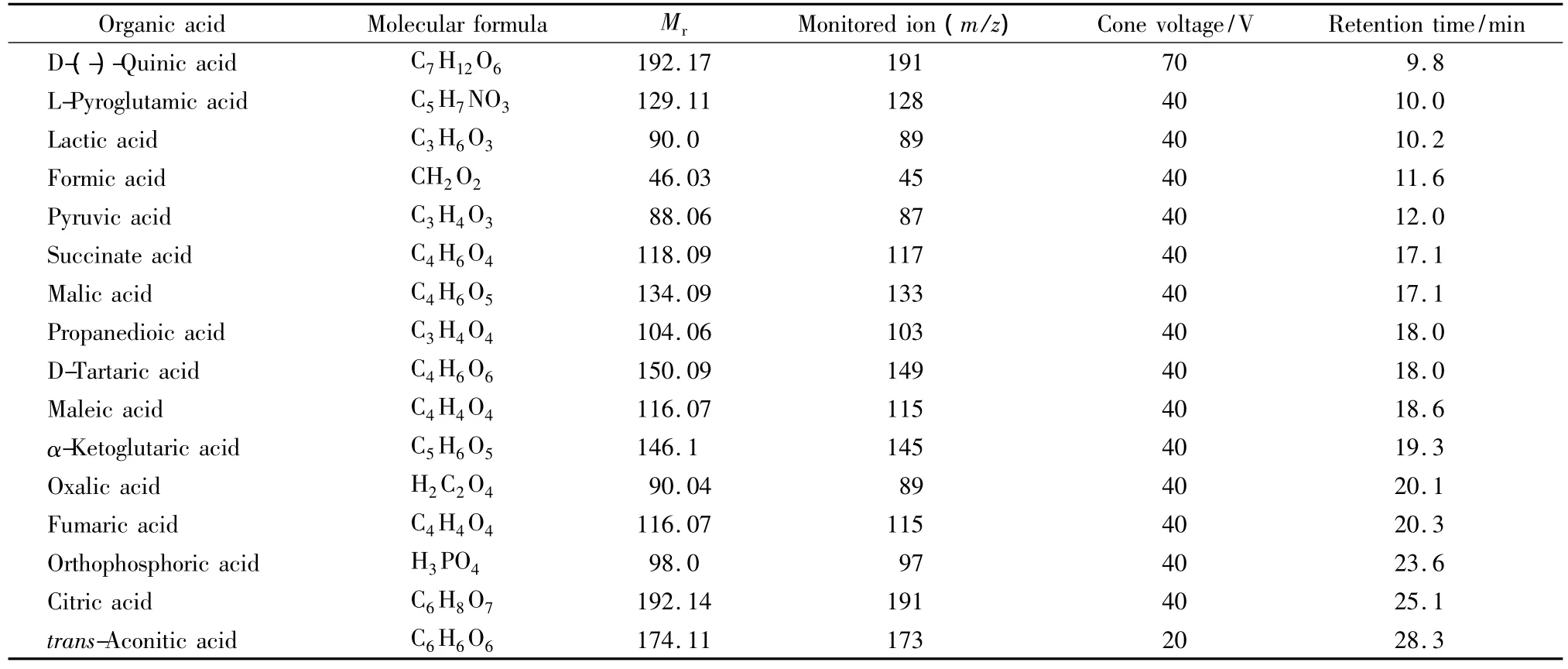
表1 16种有机酸的IC-MS检测参数Table 1 IC-MS parameters for the 16 organic acids
1.6 IC-APCI-MS 分析
如图1所示,自动进样器通过六通阀A的6号位向定量环中注入200 μL样品溶液(一般情况下进样量为20 μL);六通阀A切换,由独立泵带动纯水以0.7 mL/min的流速将定量环中的样液推入六通阀B的6号位至富集柱,在线富集3 min;然后六通阀B切换,由四元梯度泵带动NaOH淋洗液以0.45 mL/min的流速将富集柱内样品推向分离柱;样品经分离柱分离后进入抑制器,再进入DS60电导检测器,最后进入MS检测。MS采用APCI源负离子模式,对m/z 20~500范围进行全扫描。循环时间0.2 s,锥孔电压40 V,离子源温度450℃。
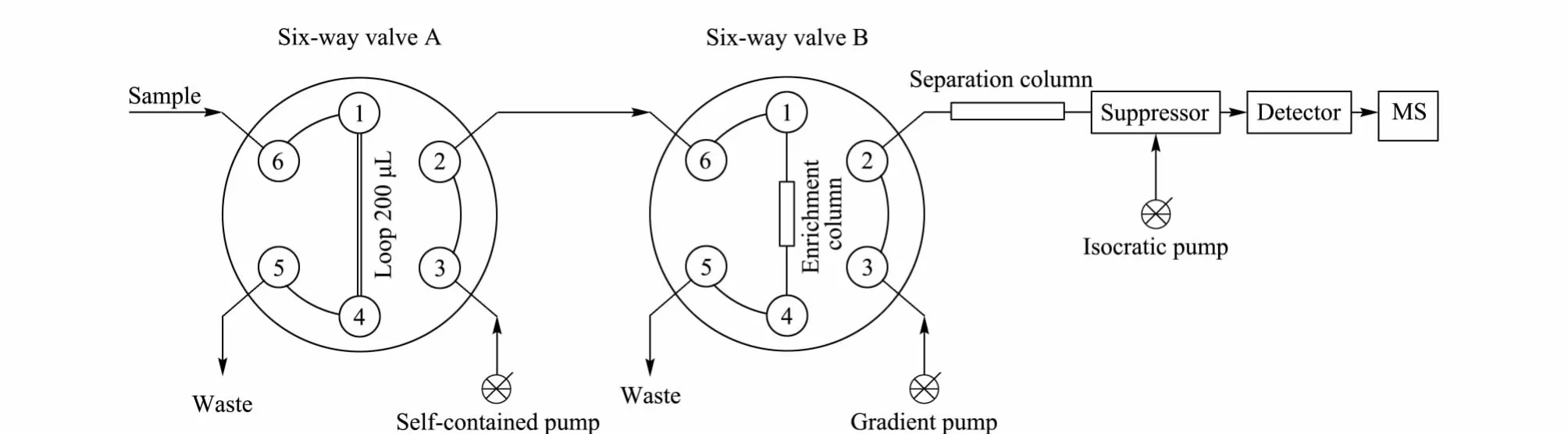
图1 在线富集离子色谱-质谱联用装置Fig.1 On-line enrichment system of IC-MS
2 结果与讨论
2.1 自制柱评价
分离柱制备完成后,将其连接于流动相为纯水的独立泵上,控制水的流速恒定,清洗柱内甲醇,并观察色谱柱压力的变化情况。观察显示,当流速为1 mL/min时,柱压保持13.34 MPa不变。这表明柱填料的紧密性较好。将分离柱连接在离子色谱上,以NaOH溶液为淋洗液,进样20 μL有机酸混合标准溶液,观察质谱信号图,显示16种有机酸均有信号响应;连续进样5个不同浓度的混合标准溶液,发现各有机酸的出峰时间保持相对稳定(RSD<0.5%,n=5),表明柱填料对有机酸具有保留吸附的能力,且填料紧密性高,没有发生塌陷。对于富集柱,采用类似的方法对其进行评价。发现当流速为0.7 mL/min时,柱压保持10.11 MPa相对稳定。离子色谱添加富集柱后,采用大体积(200 μL)进样,发现有质谱峰响应,说明富集柱对有机酸有吸附性。分别对分子结构含有不同羧基数的乳酸、马来酸、柠檬酸进行高浓度(2000 mg/L)进样,对比发现与低浓度(1 mg/L)进样时的保留时间相差不大(见表2)。这表明富集柱对有机酸有较强的吸附能力且填料紧密性好。3种有机酸的保留时间不同,可能是柱填料对有机酸的吸附能力与其分子结构含有的不同羧基数有关。而高浓度柠檬酸与低浓度柠檬酸相比,保留时间相同。可能原因是进样柠檬酸浓度太大,目标化合物没有得到充分保留,致使样品分子提前流出色谱柱,造成化合物响应峰前移;而浓度过高又造成峰宽变大,致使峰保留时间与低浓度一致。
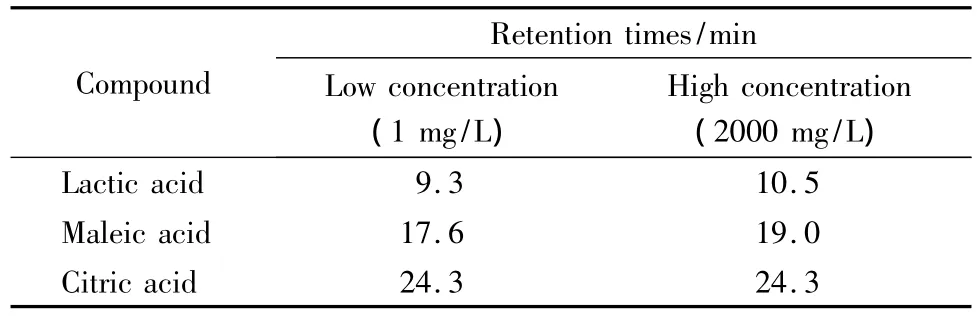
表2 低浓度与高浓度有机酸分析的保留时间比较Table 2 Comparison of retention times of the organic acids in low concentration and high concentration
2.2 IC-MS条件的优化
实验过程中,水溶液可以在1 min内以0.7 mL/min的流速将样品从200 μL定量环推向富集柱内。选择富集时间为3 min可以将样品最大程度地带向富集柱,同时实现富集过程中水对样品的在线清洗,去除样品中部分杂质。本实验中离子色谱采用NaOH溶液为淋洗液,选择0.45 mL/min的淋洗流速使整个管路压力保持在安全承受范围(<20.69 MPa)。当采用70 mmol/L的NaOH溶液等度洗脱有机酸时,尽管全部出峰时间较短,但各峰之间的分辨率较差,分离度不好,如乳酸和草酸、奎尼酸和柠檬酸等相对分子质量相近的有机酸则不能被很好地分开,马来酸与富马酸互为同分异构体,几乎完全不能分开。而采用梯度洗脱,则能将各种有机酸完全分开。在整个实验期间,柱压保持相对稳定,有机酸出峰时间相对稳定。
分别对质谱电喷雾离子(ESI)源和APCI源进行了测试。发现相同条件下,采用ESI源分析有机酸时,质谱没有相应的响应信号;而采用APCI源负离子模式时,质谱信号明显。采用负离子模式可使有机酸结构离子化,以[M-H]-的形式存在。
质谱锥孔电压对有机酸的峰值灵敏度有较大的影响。分别考察了锥孔电压为20、40、50、70 V时对16种有机酸的分析结果的影响,发现锥孔电压为40 V时14种有机酸(乳酸、磷酸、柠檬酸、草酸、苹果酸、焦谷氨酸、甲酸、丙酮酸、丁二酸、D-酒石酸、丙二酸、马来酸、富马酸、α-酮戊二酸)的峰面积最大,从而确定这14种有机酸的最佳锥孔电压都为40 V。另外,D-奎尼酸的最佳锥孔电压为70 V,反-乌头酸的最佳锥孔电压为20 V。在以上优化条件下,得到16种有机酸的选择离子监测图(见图2)。

图2 16种有机酸标准品的IC-APCI-MS选择离子监测色谱图Fig.2 SIM chromatograms of the 16 organic acid standards by IC-APCI-MS
2.3 线性关系、检出限及定量限
在优化的实验条件下,对一系列浓度的标准溶液进行测定,以峰面积(y)为纵坐标,有机酸质量浓度(x,mg/L)为横坐标进行线性回归;以S/N=3和S/N=10分别确定各有机酸在样品中的检出限(LOD)和定量限(LOQ),结果见表3。结果表明,各有机酸在一定浓度范围内的线性关系良好(R2≥0.988),方法的LOD为0.01~0.22 mg/L,LOQ为0.03~0.80 mg/L,表明所建立的方法灵敏度较高,可对有机酸含量较低的样品进行检测。
2.4 回收率及精密度
在A、B两种市售饲料添加剂样品中分别添加不同水平的有机酸混合标准溶液,按1.4节方法处理并按1.5节条件测定,每一加标水平平行测定6次,计算平均回收率。由表4可见16种有机酸的加标平均回收率为70.6%~110.8%,RSD≤6.3%。结果表明,在不同的加标水平下,16种有机酸的回收率较为稳定,精密度良好,满足样品中有机酸的分析要求。表5为两个样品中有机酸含量的测定结果。
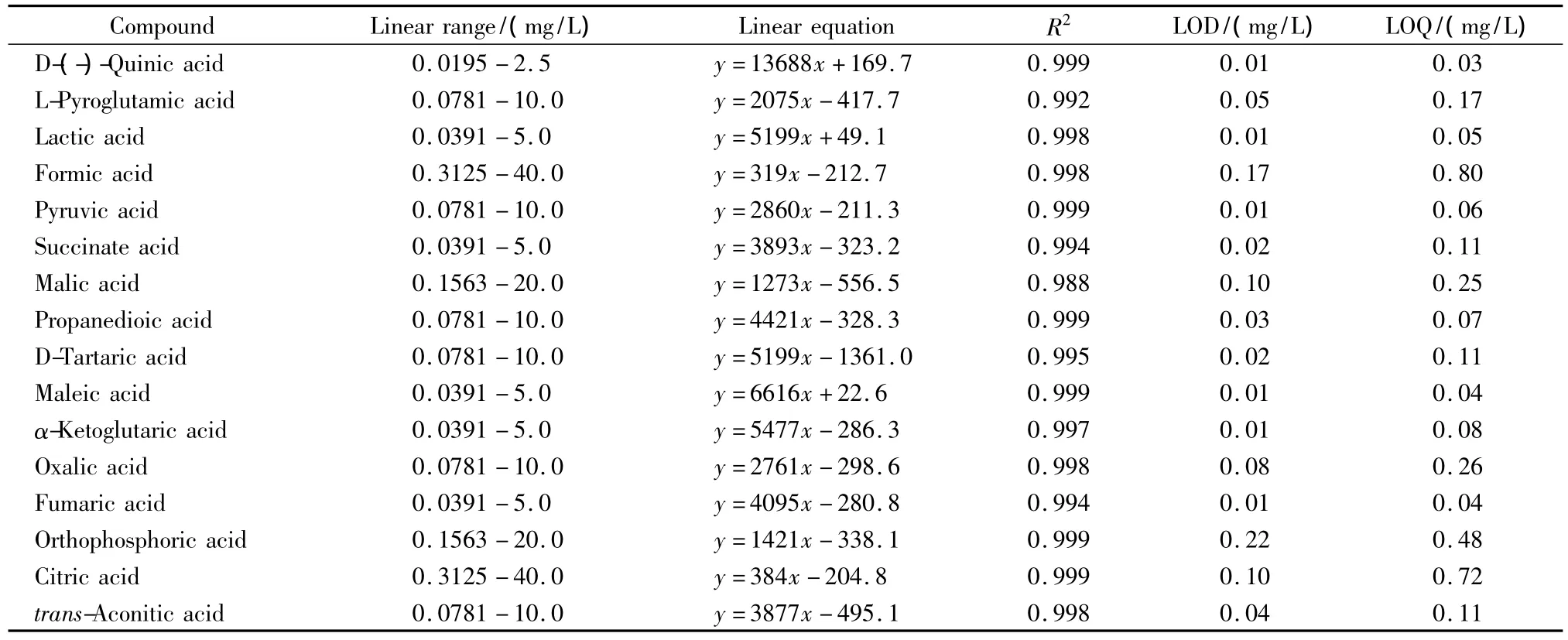
表3 16种有机酸的线性关系、检出限和定量限Table 3 Linear relationships,limits of detection(LODs,S/N=3)and limits of quantification(LOQs,S/N=10)of the 16 organic acids
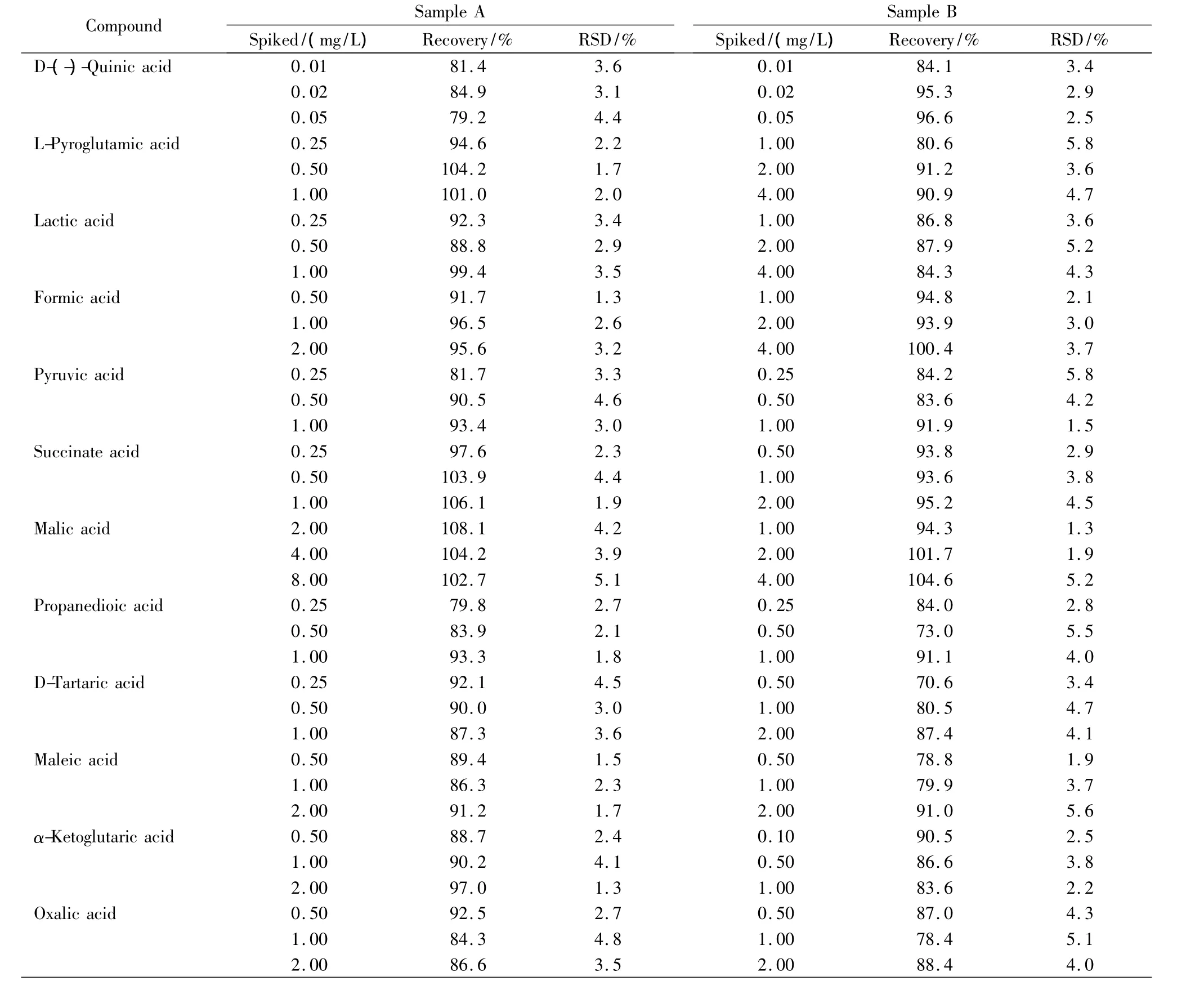
表4 16种有机酸的加标回收率及相对标准偏差(n=6)Table 4 Recoveries and RSDs of the 16 organic acids spiked in the samples(n=6)
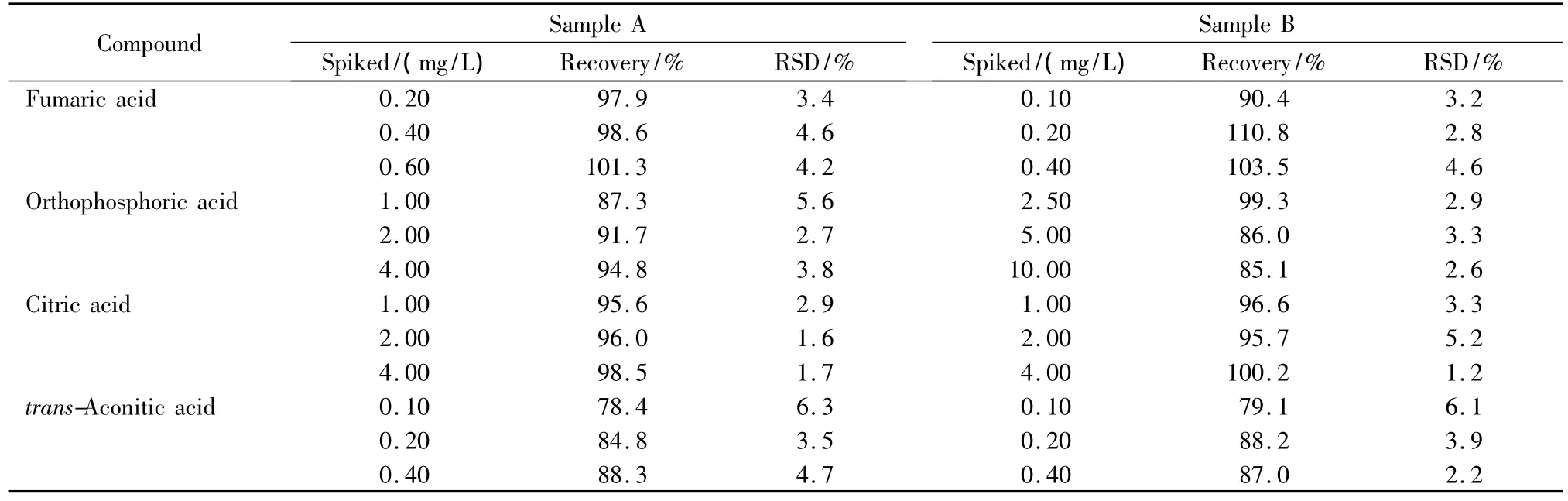
表4 (续)Table 4 (Continued)
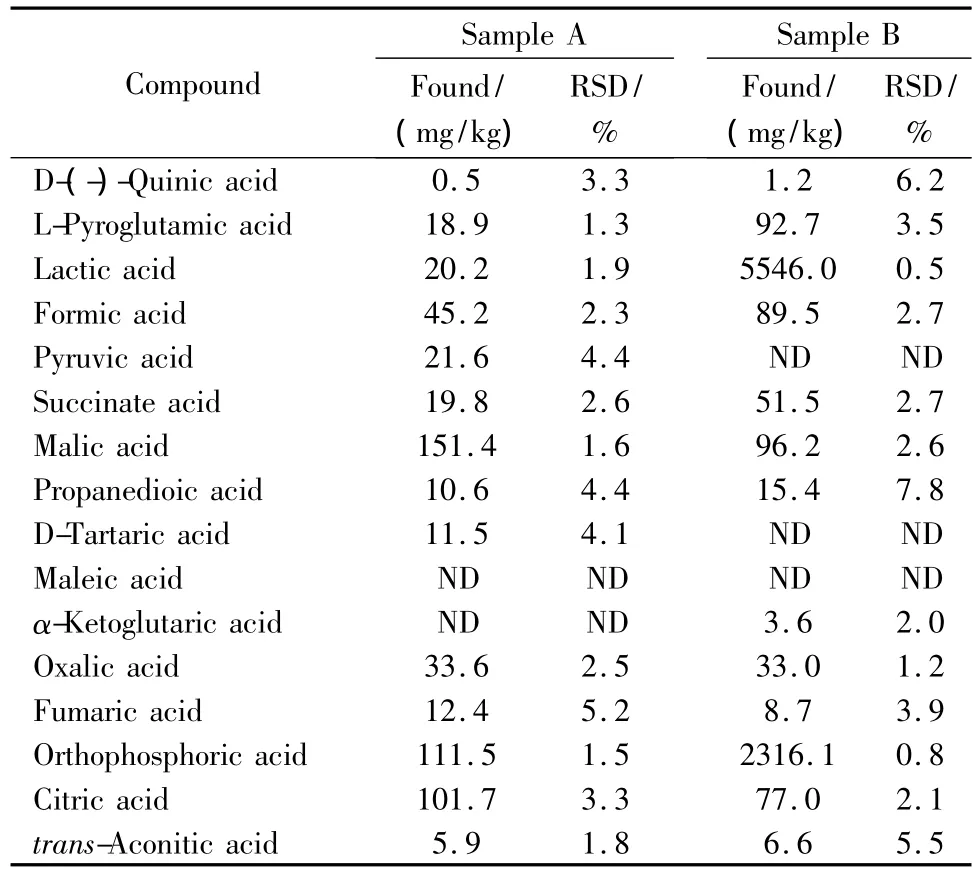
表5 两个样品中16种有机酸的含量(n=3)Table 5 Contents of 16 organic acids in two samples(n=3)
3 结论
本研究建立了一种可同时快速测定饲料添加剂中16种有机酸的在线富集离子色谱-质谱分析方法。自制富集柱和分离柱对有机酸表现出较好的富集能力和分离能力;采用大体积进样,样品检测灵敏度较高;采用质谱对有机酸定性,避免了假阳性结果的出现。此外,在线富集方式能对样品进行在线清洗,避免杂质对色谱柱的污染,减少了样品杂质对有机酸峰值灵敏性的影响。16种有机酸能在30 min内实现完全分离。该方法的流动相中不含甲醇、乙腈等有机溶剂,在一定程度上减少了对环境及人体健康的影响。该方法可应用于饲料中有机酸添加剂的检测监控。
[1]Chen C Y,Wang T.Feed Research(陈才勇,王恬.饲料研究),2004(1):37
[2]Chen Y,Zhen L.China Feed(陈勇,甄莉.中国饲料),2004(9):30
[3]Ma J F,Ma Y L.Feed Industry(马吉锋,马玉龙.饲料工业),2005,26(10):17
[4]Li C L,Zhou A G,Wang Z S.Feed Industry(李成良,周安国,王之盛.饲料工业),2006,27(11):35
[5]Liu X T,Zhang W M,Jiang H F,et al.Food Research and Development(刘晓棠,张卫明,姜洪芳,等.食品研究与开发),2010,31(1):100
[6]Niu J G,Liang X J,Liu X,et al.Chinese Journal of Applied Chemistry(牛金刚,梁晓静,刘霞,等.应用化学),2010,27(3):342
[7]Tang Y J,Wu M J.Food Chem,2007,103:243
[8]Han H F,Wang Q,Liu X,et al.Chinese Journal of Chromatography(韩海峰,王庆,刘霞,等.色谱),2012,30(5):538
[9]Uckoo R M,Jayaprakasha G K,Nelson S D,et al.Talanta,2011,839:48
[10]Yang M H,Choong Y M.Food Chem,2001,75:101
[11]Koubaa M,Cocuron J C,Thomasset B,et al.Anal Biochem,2013,436:151
[12]Qureshi M S,Bhongale S S,Thorave A K.J Chromatogr A,2011,1218:7147
[13]Barros L,Pereira C,Ferreira I C F R.Food Anal Method,2013,6:309
[14]Ma R,Ouyang J,Li X,et al.Chinese Journal of Chromatography(马瑞,欧阳嘉,李鑫,等.色谱),2012,30(1):62
[15]Scherer R,Rybka A C P,Ballus C A,et al.Food Chem,2012,135:150
[16]Ehling S,Cole S.J Agric Food Chem,2011,59:2229
[17]Fu T,Liu Q S,Fan Z Y,et al.China Animal Husbandry and Veterinary Medicine(傅彤,刘庆生,范志影,等.中国畜牧兽医),2005,32(5):16
[18]Liu X,Zheng T,Shi C O,et al.China Feed(刘霞,郑婷,施超欧,等.中国饲料),2009(8):39
[19]Zheng T,Cai Y X,Liu X,et al.Chinese Journal of Analysis Laboratory(郑婷,蔡玉兴,刘霞,等.分析试验室),2009,28(Suppl):230
[20]Losito I,Amorisco A,Carbonara T,et al.Anal Chim Acta,2006,575:89
[21]Dinh Q T,Alliot F,Moreau-Guigon E,et al.Talanta,2011,85:1238
[22]Niemann R A,Anderson D L.J Chromatogr A,2008,1200:193
