固相萃取-液相色谱-串联质谱法测定蔬菜中4种有机磷农药及其代谢产物
2014-10-22唐英斐宋金凤胡志伟
刘 永,唐英斐,宋金凤,胡志伟
(1.黑龙江出入境检验检疫局技术中心,黑龙江 哈尔滨 150001;2.东北林业大学,黑龙江 哈尔滨 150040;3.黑龙江工商行政管理局,黑龙江 哈尔滨 150018)
有机磷农药具有广谱、高效等众多优点,是当前三大支柱农药之一,经过几十年的不断发展,在品种的数量、产量规模等方面都位居各种农药首位[1]。由于有机磷农药对细菌、害虫、杂草生长等具有有效的控制作用和提高农业产量而被广泛使用,但有机磷农药使用过多,产生的负面效应也日益突显,致使农产品中农药残留严重超标,长期摄取含有机磷农药及代谢产物的农作物会对人的健康造成较大影响[2]。
随着检测技术的发展和各国在食品安全研究方面的突破,除了对原药残留进行检测外,增加了对药物残留代谢产物的研究,并对其毒性较强的代谢产物进行检测。有机磷农药降解产物往往具有较强毒性,如敌百虫在一定条件下可迅速转化成毒性更强的敌敌畏[3],乙酰甲胺磷在环境中容易降解成甲胺磷[4],甲基对硫磷等含有苯硝基类有机磷农药最主要的降解产物是对硝基酚[5],马拉硫磷代谢产物为中间体O,O-二甲基二硫代磷酸酯等[6]。我国在国家标准GB 2763-2012中对蔬菜中各种有机磷农药的残留限量有明确的规定,4种有机磷农药及其代谢产物的残留限量为0.02~8 mg/kg(对硝基酚及O,O-二甲基二硫代磷酸酯没有规定),美国及欧盟的残留限量标准与GB 2763-2012所规定的限量基本一致[7]。
有机磷农药的检测方法主要有气相色谱法[8]、气相色谱-质谱联用法[9]、气相色谱-串联质谱法[10]、液相色谱-串联质谱法[11]及毛细管电泳法[12]等,前处理方法主要为液液萃取[8,11]、QuEChERS 技术[10,13]、固相萃取[9,14]、固相微萃取[15]等,但方法都局限于农药母体的检测,很少关注农药代谢产物的同时检测,而部分有机磷农药代谢产物在食品中的残留富集,对人体带来的伤害甚至远高于有机磷农药本身[4]。有机磷农药代谢物的检测,若局限于某一种化合物或者是几种可能代谢物的检测,不具有针对性,不能作为有机磷农药的标记物[16,17]。农药及其代谢产物的检测,对食品安全具有更重要的价值,可能是未来农药残留检测的热点和难点。本文以菠菜和洋葱为研究对象,用固相萃取-液相色谱-质谱联用技术同时检测4种有机磷农药及其代谢产物,对农药残留检测的技术储备及农药代谢产物的研究具有重要意义。
1 实验部分
1.1 仪器与试剂
Waters ACQUITY Ultra Performance液相色谱系统,并配有溶剂管理器;Waters XEVO TQ三重四极杆质谱仪(Waters公司);均质机(T 25,IKA公司);组织捣碎机(Philips公司);固相萃取装置(Supelco公司)等。
有机磷农药及其代谢产物标准品:马拉硫磷(malathion,纯度99.5%,Fluka公司),O,O-二甲基二硫代磷酸酯(dimethyl dithiophosphate,纯度97%,维赛诺化学技术有限公司),甲基对硫磷(parathionmethyl,纯度99.8%,Sigma公司),对硝基酚(4-nitrophenol,纯度99.5%,国药集团化学试剂有限公司),敌百虫(trichlorfon,纯度99.5%,Sigma公司),敌敌畏(dimethyl dichloroviny phosphate,DDVP,纯度99.8%,Fluka公司),乙酰甲胺磷(acephate,纯度99.5%,Fluka公司),甲胺磷(methamidophos,纯度99.5%,Fluka公司)。标准品用乙腈溶解,于4℃冰箱中保存,使用时用流动相定容。500 mg 6 mL活性炭固相萃取柱及500 mg 6 mL弗罗里硅土固相萃取小柱均购自Supelco公司,其他试剂均为分析纯试剂。
1.2 样品前处理方法
叶菜以菠菜为试验样本。提取:样品用组织捣碎机处理后,称取约5 g(精确到0.01 g)于50 mL离心管中,加入2 g MgSO4、20 mL乙酸乙酯,均质器均质2 min(不低于10000 r/min),然后于4000 r/min下离心5 min,取上层清液。净化:取10 mL上层清液过500 mg 6 mL活性炭和500 mg 6 mL弗罗里硅土串联小柱(小柱经5 mL乙酸乙酯活化处理),再用10 mL乙酸乙酯洗脱小柱,合并流出液和上样液,氮吹至近干,用1.0 mL乙腈-5 mmol/L乙酸铵水溶液(1∶1,v/v)溶解残渣,待测定。
其他色素含量较低的蔬菜以洋葱为试验样本。提取方法与叶菜相同,净化方法略有不同,10 mL上层清液只经过弗罗里硅土小柱,其他操作完全相同。
1.3 液相色谱条件
色谱柱:ACQUITY UPLC BEH HILIC(50 mm×2.1 mm,1.7 μm);柱温:30℃。进样器用强溶剂(30%乙腈水溶液)和弱溶剂(70%乙腈水溶液)清洗。流动相:溶剂A为乙腈,溶剂B为5 mmol/L的乙酸铵水溶液。梯度洗脱程序:0~1.0 min,50%B;1.0~1.5 min,50%B~70%B;1.5~2.0 min,70%B;2.0~2.1 min,70%B~50%B;2.1~3.0 min,50%B。流速:0.25 mL/min。
1.4 质谱条件
毛细管电压:2.5 kV;离子源温度:150℃;脱溶剂气(N2)流速:650 L/h;雾帘气(N2)流速:50 L/h;脱溶剂气温度:400℃;碰撞气:氩气。数据处理为MassLynx v 4.1系统。其他质谱参数见表1。
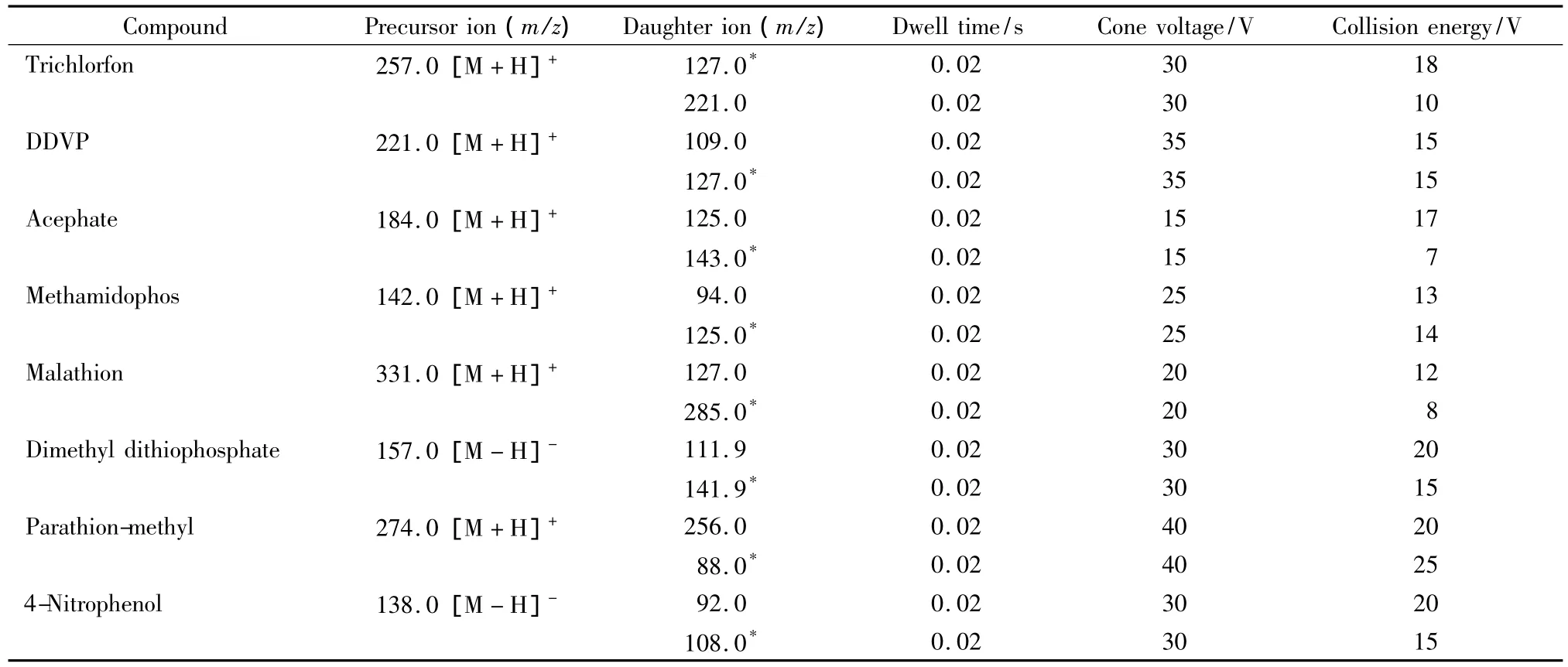
表1 有机磷农药及其代谢产物的质谱参数Table 1 Optimized mass spectrum conditions of the organophosphorus pesticides and their metabolites
2 结果与讨论
2.1 前处理条件的选择
有机磷农药及其代谢产物在乙酸乙酯、乙腈、丙酮及二氯甲烷等试剂中均有较好的溶解度,考虑到二氯甲烷对环境的污染及乳化问题,丙酮更适合于粮谷等物质中的有机磷及代谢物提取,蔬菜通常采用乙腈和乙酸乙酯作提取试剂。叶菜类蔬菜由于多数色素含量较高,而乙腈对叶绿素、叶黄素及胡萝卜素的提取效率高,提取液颜色较深,净化效果不好;采用乙酸乙酯进行提取,色素含量较低,再用活性炭小柱除去残留的色素,效果较为理想。试验中选择反相C18净化小柱,将提取液浓缩后用含5%甲醇的乙酸铵溶液溶解过柱,由于O,O-二甲基二硫代磷酸酯及对硝基酚极性较强,柱保留效果不好,损失较大;采用正相净化方式,用乙酸乙酯溶解,过氧化铝小柱,对硝基酚的吸附作用较大,造成回收率不高;使用乙酸乙酯溶解,过弗罗里硅土小柱,净化效果最佳,因而采用弗罗里硅土的正相取净化方式。
2.2 检测条件的选择
传统有机磷农药的检测一般采用气相色谱或气相色谱-质谱联用的方法[8,9],但在检测 O,O-二甲基二硫代磷酸酯及敌百虫的过程中都遇到了一些问题[16]。O,O-二甲基二硫代磷酸酯和敌百虫都是一种遇热易分解的物质,实验发现,O,O-二甲基二硫代磷酸酯遇热甲基化或分解成其他小分子化合物(见图1),但转化效率不高,速率较慢,因而色谱峰对称性不好,峰形不尖锐,定量误差较大。O,O-二甲基二硫代磷酸酯的检测多采用五氟溴苄苯(PFBBr)衍生,将羟基屏蔽以减小O,O-二甲基二硫代磷酸酯的活性,再进行气化检测的方式,但是衍生效率不高,且步骤较为繁琐,也不利于多组分的同时检测[16]。敌百虫由于在高温条件下C-P键易发生断裂,分子重排后生成三氯乙醛和亚磷酸二甲酯,一般采用对亚磷酸二甲酯的检测来确定敌百虫的含量,但是敌百虫的定量分解与温度条件关系密切,只有在气相色谱进样口超过260℃时,定量分解才较为充分[18]。所以O,O-二甲基二硫代磷酸酯和敌百虫的检测条件有一定的矛盾性,采用气相色谱或气相色谱-质谱联用直接或衍生的检测方法,都不利于多组分的同时检测。
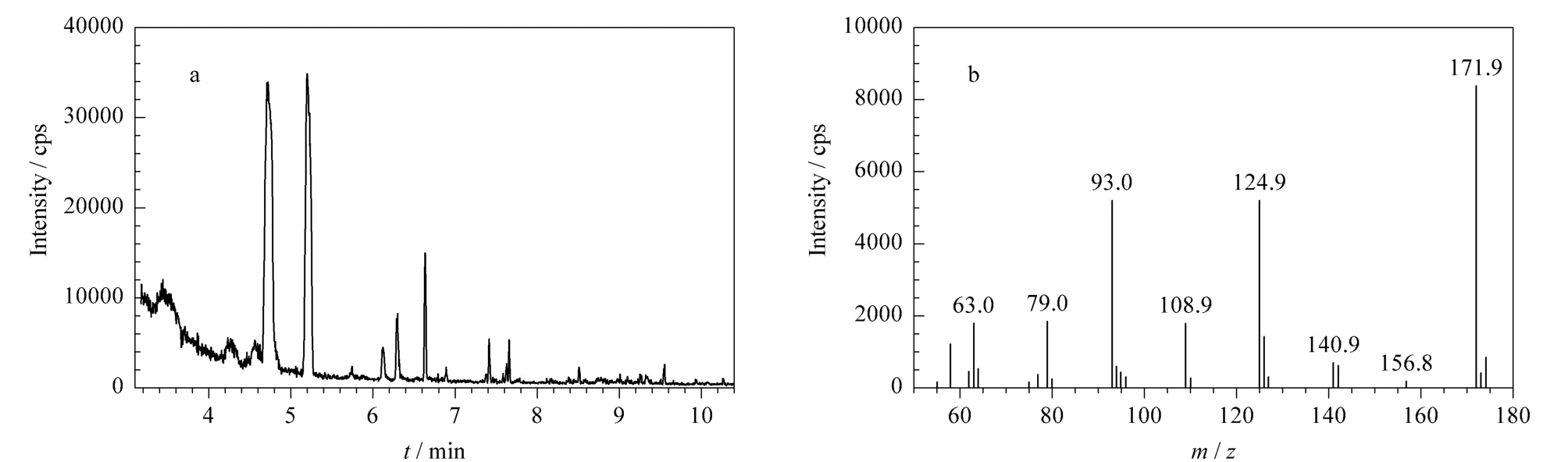
图1 O,O-二甲基二硫代磷酸酯的(a)气相色谱图和(b)质谱图Fig.1 (a)Gas chromatogram and(b)mass spectrum of dimethyl dithiophosphate
采用液相色谱-质谱联用的方式进行检测,多数化合物效果较好,灵敏度高,且不需要衍生,但是O,O-二甲基二硫代磷酸酯和对硝基酚极性较强,保留弱,使用C18色谱柱不能满足分离要求。试验对色谱条件进行了优化和选择,使用ACQUITY UPLC BEH HILIC色谱柱进行分离,效果较好(见图2)。
以菠菜作为基质,对4种有机磷农药及其代谢物采用活性炭和弗罗里硅土串联固相萃取小柱净化后的绝对基质效应进行了考察,其基质效应都不高于45.1%(见表2),说明净化效果及质谱条件较为合理,有利于定量分析的准确性。
2.3 回收率和精密度
在蔬菜(菠菜)中添加有机磷农药及其代谢产物标准品进行回收率测定,每个水平测定6次,其加标回收率为76.9%~102.8%,RSD为5.92%~10.19%(见表2),结果表明方法符合检测要求。
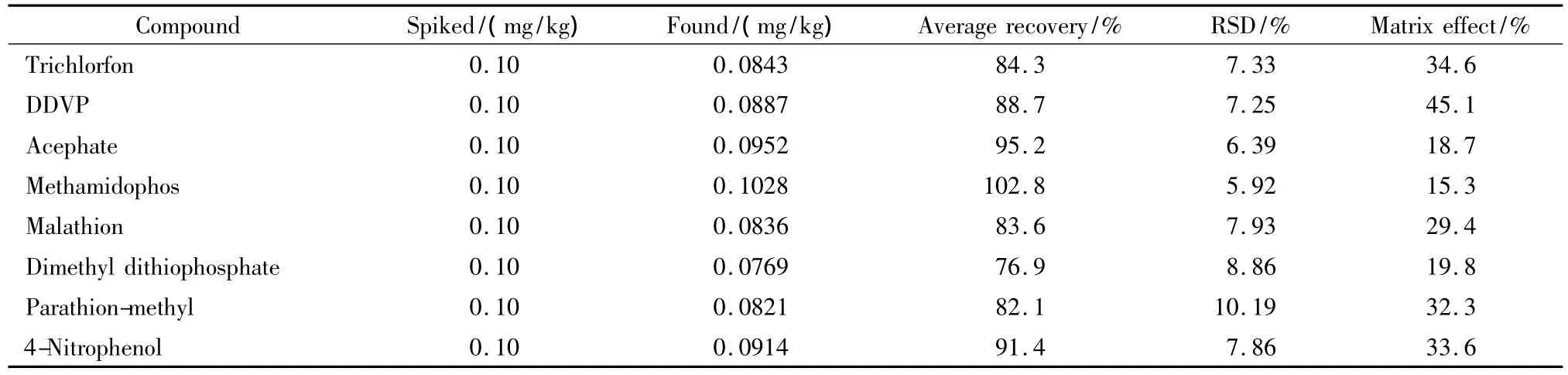
表2 菠菜中有机磷农药及其代谢产物的加标回收率、精密度(n=6)及基质效应Table 2 Recoveries,relative standard deviations(RSDs)(n=6)and matrix effects of the organophosphorus pesticides and metabolites spiked in spinach
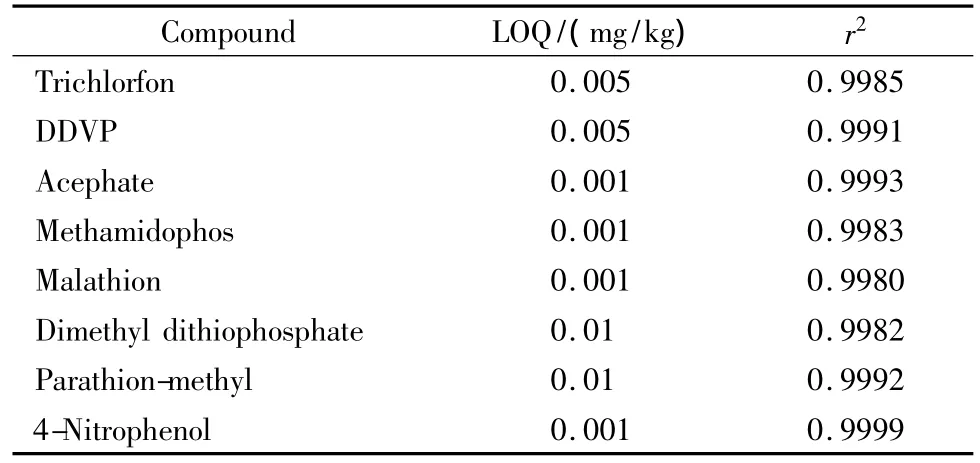
表3 菠菜中有机磷农药及其代谢产物的定量限及标准曲线的线性相关系数Table 3 Limits of quantification(LOQs,S/N >10)in spinach and correlation coefficients(r2)of standard curves for the organophosphorus pesticides and metabolites
2.4 定量限及线性关系
将8种标准品配制成系列浓度的标准溶液,定量限采用在样品处理后的基质中添加标准品的方式获得,以至少大于10倍信噪比时的测得浓度计;以峰面积为纵坐标、标准品的质量浓度为横坐标绘制标准曲线,计算相关系数,结果表明,在0.01~1.00 mg/kg范围内均线性关系良好,相关系数(见表3)均满足检测要求。
2.5 应用
试验采用购自哈尔滨市农贸市场的白菜、辣椒及西红柿,每个品种均有两个样本,用建立的固相萃取-液相色谱-串联质谱检测方法进行检测,发现一个西红柿样本中检测到2.3 μg/kg的马拉硫磷;一个辣椒样本中检测到1.2 μg/kg的对硝基酚,但由于对硝基酚也可能为环境污染物,不能说明对硝基酚一定来自甲基对硫磷的降解。其他样本均未检出目标农药及其代谢物。
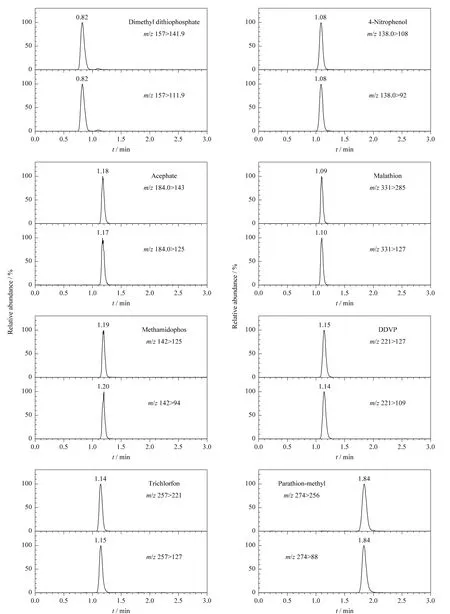
图2 有机磷农药及其代谢产物混合标准溶液(0.05 mg/L)的LC-MS/MS谱图Fig.2 LC-MS/MS chromatograms of a mixed standard solution of the organophosphorus pesticides and metabolites(0.05 mg/L)
3 结论
色素含量高的蔬菜前处理采用活性炭和弗罗里硅土串联固相萃取净化方式,色素含量低的蔬菜用弗罗里硅土固相萃取净化方式,结果表明色素及其他杂质处理效果良好,经前处理的样品均为无色或浅黄色;液相色谱柱选择ACQUITY UPLC BEH HILIC色谱柱,增强极性化合物保留的同时,也起到了良好的净化分离作用,绝对基质效应较低。该方法具有良好的回收率、精密度、线性范围和定量限,符合农产品中农药残留检测方法的要求,适合科研或日常工作中检测有机磷农药及其代谢物。
[1]Zhang Q.Guangdong Chemical Industry(张强.广东化工),2013,40(10):142
[2]Wang J,Zheng X Y.Science & Technology Association Forum(王晶,郑晓燕.科协论坛),2013(4):89
[3]Jin T M,Sun X H.Journal of Inner Mongolia University for Nationalities(金天明,孙晓辉.内蒙古民族大学学报:自然科学版),2002,17(5):420
[4]Kong Z Q,Dong F S,Xu J,et al.Food Control,2012,23(1):149
[5]Chávez-López C,Blanco-Jarvio A,Luna-Guido M,et al.Eur J Soil Biol,2011,47:264
[6]Loewenherz C,Fenske R A,Simcox N J,et al.Environ Health Perspect,1997,105(12):1344
[7]Lin W X.The Compilation of Residue Limits Standards for Pesticides and Veterinary Drugs in Foodstuffs in the World(林维宣.各国食品中农药兽药残留限量规定.大连:大连海事大学出版社),2003
[8]Liu X P,Mitrevski B,Li D K,et al.Microchem J,2013,111(7):25
[9]Rodrigues F de M,Mesquita P R R,de Oliveira L S,et al.Microchem J,2011,98(1):56
[10]Chen X S,Bian Z Y,Yang F,et al.Chinese Journal of Chromatography(陈晓水,边照阳,杨飞,等.色谱),2013,31(11):1116
[11]Xu Z L,Deng H,Deng X F,et al.Food Chem,2012,131(4):1569
[12]Cao L W,Liang S L,Tan X F,et al.Chinese Journal of Chromatography(曹丽伟,梁丝柳,谭小芳,等.色谱),2012,30(12):1295
[13]Wang L Z,Zhou Y,Chen Y,et al.Chinese Journal of Chromatography(王连珠,周昱,陈泳,等.色谱),2012,30(2):146
[14]Song W,Lin S S,Sun G D,et al.Chinese Journal of Chromatography(宋伟,林姗姗,孙广大,等.色谱),2012,30(3):323
[15]Jiang S X,Feng J J.Chinese Journal of Chromatography(蒋生祥,冯娟娟.色谱),2012,30(3):219
[16]Wu C H,Zheng L X,Zhou Z J.Fudan Univ J:Med Sci(邬春华,郑力行,周志俊.复旦学报:医学版),2006,33(4):552
[17]Huang Y,Li Z Y,Zhao B S.Environmental Science and Management(黄雅,李政一,赵博生.环境科学与管理),2009,34(4):20
[18]Liu Y,Yang C Z,Kang Q H,et al.Chinese Journal of Analysis Laboratory(刘永,杨长志,康庆贺,等.分析试验室),2008,27(2):119
