吸附-催化氧化耦合脱硫剂的结构和脱硫性能
2014-10-22赵江涛刘欣梅阎子峰
赵江涛,刘欣梅,阎子峰
(中国石油大学 重质油国家重点实验室,山东 青岛,266580)
目前,国内外常用的脱除液化气中硫化物的方法主要可分为湿法和干法两大类[1]。湿法脱硫费用较低,可以用来处理硫含量较高、处理量较大的原料气,但是脱硫后总硫含量不合格,特别是不能脱除非活性有机硫化物。相比之下,干法脱硫精度较高,主要用于处理硫含量较低或处理量较小的原料气。干法脱硫又可分为吸附脱硫、选择性催化氧化(SCO)脱硫和加氢脱硫(HDS)[2]。与后两者相比,吸附脱硫可在环境所处的压力和温度下实现硫化物的脱除。常见的吸附脱硫剂有分子筛、金属氧化物、活性炭等[3-6]。
近年来,国内外以活性炭基材料作为脱硫剂的研究报道很多。美国Bandosz等[7-10]选用不同碳源(沥青基、木基、椰壳基、泥煤基等)的活性炭作为脱硫剂,详细考察了脱硫剂的孔结构、表面酸碱性、含氮基团,以及操作条件中湿度、氧含量、硫化物浓度等对脱硫性能的影响,其最高穿透硫容可达29.5%,热再生性能良好。吴迪镛等[11-14]采 用Na2CO3溶液对活性炭进行浸渍改性,系统地研究了各操作条件对其脱除H2S性能的影响,建立了固定床反应器模型,并计算得到了相关动力学参数,在一定条件下,该浸渍改性活性炭的饱和硫容高达52%。房倚天等[15-17]分别考察了负载有 Mn、Cu、Ce、Fe、Co、V等金属的活性炭的中温(150~250℃)脱硫性能,发现负载Mn的活性炭脱硫效果最好,硫容达14.2%,且再生性能良好;进一步研究发现,单质硫是主要的脱硫产物。
本课题组[18]曾采用固相反应法、化学活化法分别制备出了介孔结构丰富的纳米氧化铁和微孔结构发达的石油焦基活性炭,二者均具有良好的低温脱硫性能。在此基础上,笔者以高比表面积商业活性炭为载体,采用浸渍法实现了氧化铁的高度分散,成功制备了吸附-催化氧化耦合脱硫剂(以下简称耦合脱硫剂),以期结合二者脱硫优势,设法解决现有脱硫剂传质速率慢和硫容低的不足,并初步考察脱硫剂对不同类型硫化物的脱除效果及再生性能。
1 实验部分
1.1 原料
硝酸铁(Fe(NO3)3·9H2O),AR,国药集团化学试剂有限公司产品;椰壳活性炭,45目,比表面积1225m2/g,表观密度0.40~0.55g/cm3,巩义市嵩山滤材有限公司产品。
硫化氢标气(4032.5mg/m3,平衡气为 N2)、乙硫醇标气(338.0mg/m3)、二甲基二硫醚标气(2068.0mg/m3)及噻吩标气(3057.8mg/m3),上海神开气体技术有限公司产品。
1.2 耦合脱硫剂的制备
根据负载量(以中心原子质量比m(Fe)/m(C)表示)的不同,称取一定质量的硝酸铁,溶于9mL去离子水中,充分搅拌使之溶解;加入6g椰壳活性炭,室温下浸渍10h后于80℃下干燥,将所得样品于N2气氛下300℃焙烧。再次重复上述过程,即得耦合脱硫剂(20~60目)。
1.3 耦合脱硫剂的分析与表征
采用Micromeritics公司ASAP-2020型低温N2吸附仪测定样品的比表面积、孔体积及孔径分布。采用PANalytical公司X’Pert MPD Pro型X射线衍射(XRD)仪进行样品的物相分析。采用JEOL公司JSM-5410型扫描电子显微镜(SEM)和JEM-2010型透射电子显微镜(TEM)表征其微观形貌特征。采用Versa Probe公司PHI 5000型X射线光电子能谱(XPS)仪分析脱硫剂表面Fe、S等元素的化学态,以C1s标准结合能284.8eV对所测元素结合能数据进行校正。
1.4 评价装置及流程
采用固定床反应器对所制耦合脱硫剂的脱硫及再生性能进行评价,反应管为φ39mm×14mm硫化不锈钢管,内置热电偶套管,可准确控制并实时测定床层温度。整个反应器采用外部管式炉加热。
含硫原料气体包括硫化氢标气、乙硫醇标气、二甲基二硫醚标气及噻吩标气。采用美国布鲁克道尔顿公司G450型气相色谱仪(PFPD检测器)检测反应管出口气体中硫化物含量。脱硫剂用量为3mL。含硫化氢原料气流量为350mL/min。脱硫剂被硫化物穿透的质量浓度界定为343mg/m3(国家工业和民用燃料用液化石油气执行质量标准GB11174-1997)。特别地,在考察脱硫剂对不同硫化物脱除性能实验中,流量为125mL/min,且当出口与入口硫化物质量浓度之比即cout/cin>10%时视为穿透。由此计算脱硫剂的一次穿透硫容(以下简称硫容),近似硫容计算公式[19]如式(1)所示。
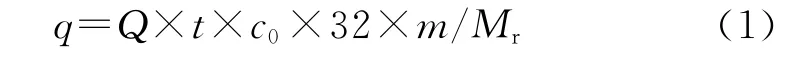
式(1)中,q表示硫容,%;Q表示含硫原料气流量,m3/min;t表示到达穿透点的时间,min;c0表示原料气中硫化物质量浓度,g/m3;m表示脱硫剂的装填质量,g;Mr表示原料气中硫化物的相对分子质量。
脱硫后耦合脱硫剂的再生在同一固定床反应器上进行。再生气氛为普通N2,流量300mL/min,再生温度475℃。再生实验中,F表示氧化铁负载量为12%的耦合脱硫剂;R1、R2、R3分别表示一次、二次、三次再生后样品。
2 结果与讨论
2.1 耦合脱硫剂的孔结构和脱硫性能
图1为不同Fe2O3负载量(m(Fe)/m(C))耦合脱硫剂的XRD谱。由图1可以看出,Fe2O3在耦合脱硫剂表面为纯Fe2O3相。其中,当m(Fe)/m(C)为0.04时,仅有活性炭的弥散峰,未出现Fe2O3的特征衍射峰;当m(Fe)/m(C)增大至0.06时,开始出现Fe2O3的特征衍射峰;随着m(Fe)/m(C)的增加,Fe2O3的特征衍射峰增强。但总体看来,耦合脱硫剂中Fe2O3所呈现出的特征衍射峰强度较弱,表明活性炭的高比表面积使铁在耦合脱硫剂表面实现了高度分散。
不同m(Fe)/m(C)耦合脱硫剂脱硫前后的孔结构和硫容数据列于表1。由表1可知,与单纯活性炭相比,随着m(Fe)/m(C)的变化,耦合脱硫剂的平均孔径无明显变化,皆在2.1~2.3nm之间;比表面积和孔体积因Fe2O3的沉积而随m(Fe)/m(C)的增加而减小。耦合脱硫剂的比表面积和孔体积在脱硫后均降低,降低幅度在40%以上。比表面积和孔体积的明显减小是由固态硫化物在脱硫剂表面的沉积所致,降低幅度的差异表明不同脱硫剂脱除硫化物能力不同。
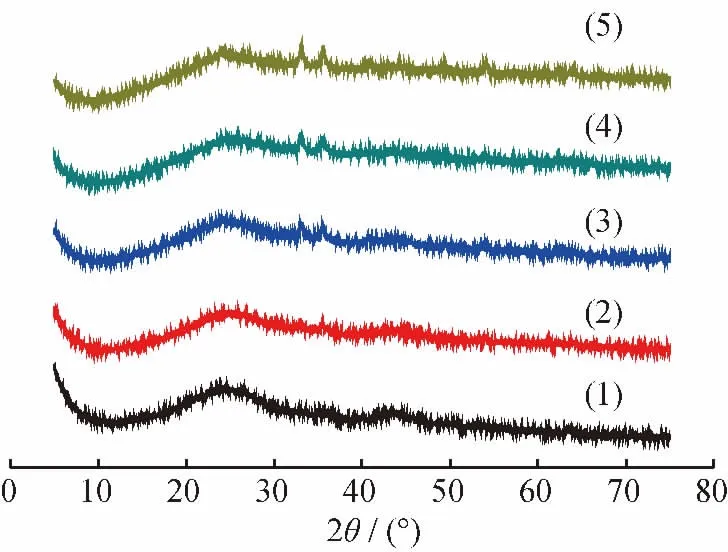
图1 不同Fe2O3 负载量(m(Fe)/m(C))耦合脱硫剂的XRD谱Fig.1 XRD patterns of coupled desulfurizers with different m(Fe)/m(C)
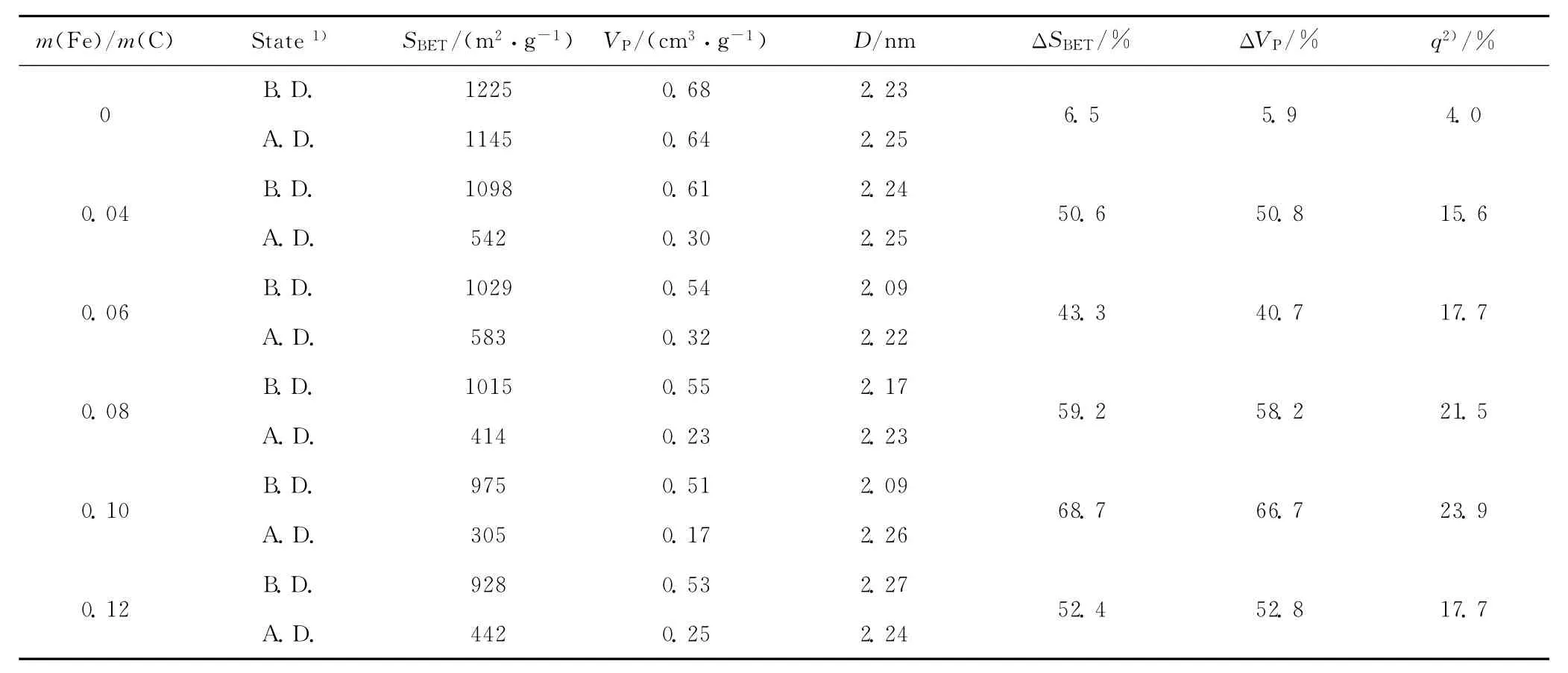
表1 不同m(Fe)/m(C)耦合脱硫剂脱硫前后的孔结构和硫容Table 1 Pore structure and sulfur capacity of coupled desulfurizers with different m(Fe)/m(C)before and after desulfurization
图2为不同m(Fe)/m(C)耦合脱硫剂的低温N2吸附-脱附等温线。图3为m(Fe)/m(C)=0.10耦合脱硫剂的孔径分布曲线。由图2可见,无论是活性炭还是耦合脱硫剂,都具有类I型吸附-脱附等温线,但与前者相比,后者不仅对N2的吸附量明显降低,而且滞后回环也减小,表明Fe2O3在活性炭微孔和介孔内均有所沉积。由图3可见,m(Fe)/m(C)=0.10的耦合脱硫剂脱硫后,小于2.0nm的微孔孔体积大幅下降,充分验证了固态脱硫产物沉积在其微孔孔道内。
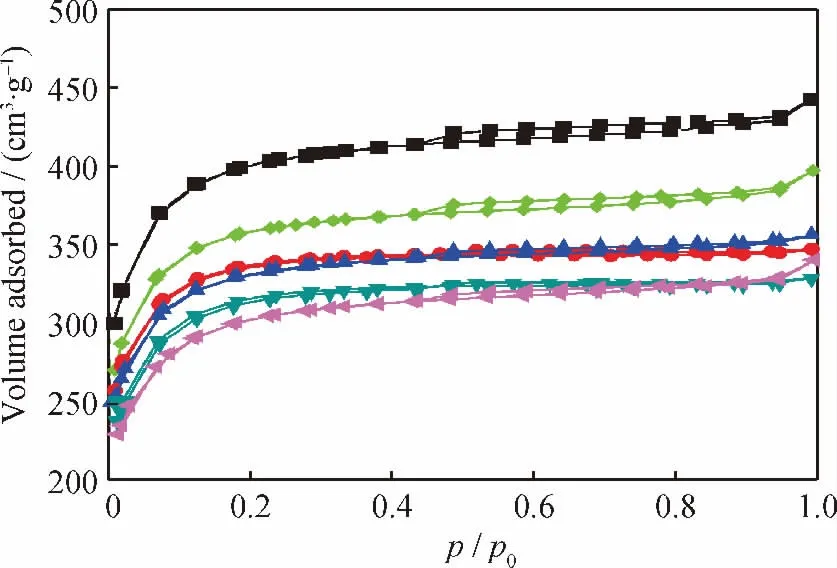
图2 不同m(Fe)/m(C)耦合脱硫剂的低温N2吸附-脱附等温线Fig.2 N2adsorption-desorption isotherms of coupled desulfurizers with different m(Fe)/m(C)
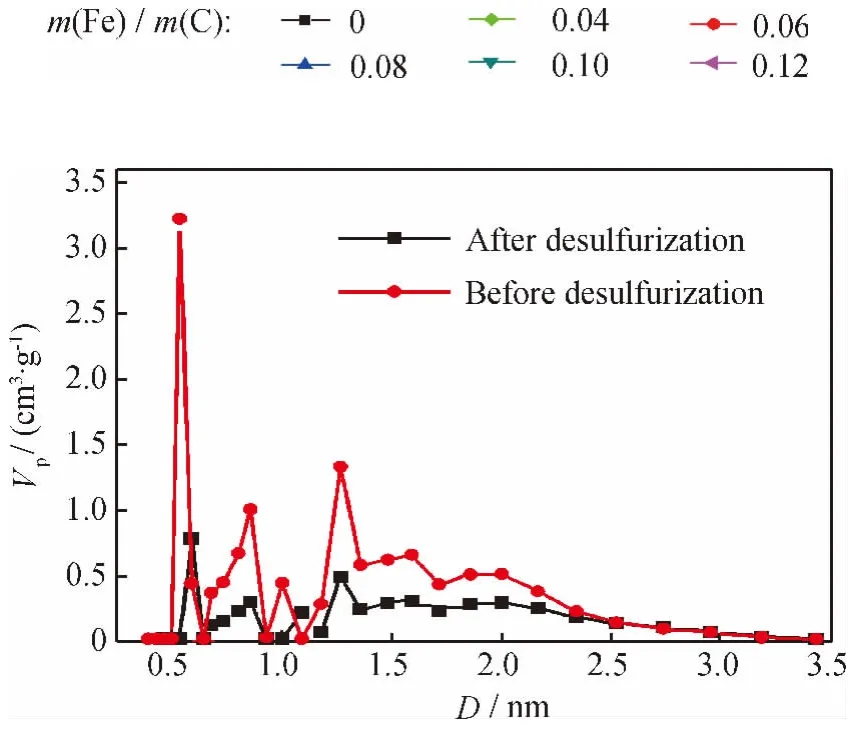
图3 m(Fe)/m(C)=0.10耦合脱硫剂的孔径分布曲线Fig.3 Pore size distribution curves of coupled desulfurizer with m(Fe)/m(C)=0.10
由脱硫剂的脱硫性能来看,单纯活性炭的硫容为4.0%,耦合脱硫剂的硫容皆在15%以上,表明Fe2O3的引入显著地提高了脱硫剂的脱硫性能。单纯活性炭的脱硫主要通过物理吸附和氧化作用完成,因物理作用而被吸附的少量H2S可与载体活性炭表面的活性氧原子(O*)发生氧化反应生成单质硫[20],但由于物理吸附作用弱及活性炭表面O*密度低,致使单纯活性炭一次穿透硫容低。而对于耦合脱硫剂,其在结构上实现了Fe2O3在高比表面积活性炭上的高度分散,在脱硫过程中,除包含上述物理吸附和氧化作用外,硫化物更多的在金属活性位(C—Fe—O)催化作用下转化为单质硫[16],即由单纯的吸附氧化作用转变为吸附氧化作用和催化氧化作用的协同过程,且以催化氧化作用为主。
耦合脱硫剂的硫容随m(Fe)/m(C)的逐渐增大呈现先增加后减小的趋势。当m(Fe)/m(C)=0.10时硫容达到最大,为23.9%。这是因为m(Fe)/m(C)低时,表面Fe2O3数目不足,导致脱硫剂脱硫活性较低,从而所得硫容不高。但当m(Fe)/m(C)过高时,使得Fe2O3晶粒聚集长大,表面活性Fe2O3数目减少,致使催化氧化脱硫活性也相应降低;聚集长大的Fe2O3颗粒还会堵塞孔道,影响传质过程,不利于脱硫反应的发生,不利于耦合脱硫剂硫容的进一步提高。
图4为m(Fe)/m(C)=0.10的耦合脱硫剂脱硫前后的SEM和TEM照片。由图4(a)可以看出,耦合脱硫剂表面呈微球状,该微球状活性炭颗粒分布均匀;而图4(c)显示,载体活性炭具有发达的孔隙结构,Fe2O3在其表面分散性好,其颗粒粒径为30~50nm。由图4(b)、(d)可以看出,脱硫后的耦合脱硫剂的表观形貌及活性组分的颗粒粒径均无明显变化,进一步说明脱硫产物主要沉积在耦合脱硫剂的微孔及介孔结构中。
2.2 脱硫前后耦合脱硫剂中物种的配位方式
图5为脱硫(H2S)前后m(Fe)/m(C)=0.10耦合脱硫剂中Fe2p电子的XPS谱。由图5(a)可见,结合能为719.0eV和725.0eV的2个峰分别为Fe2p3/2电子和 Fe2p1/2电子的附属峰[21],711.2eV处的峰对应Fe(Ⅲ)—O中Fe2p3/2电子的结合能信号[22],表明新鲜脱硫剂表面铁物种仅为Fe2O3,与XRD分析结果一致。图5(b)中,结合能为711.4eV、710.4eV与714.0eV和713.1eV等处的峰,分别对应Fe(Ⅲ)—O、Fe(Ⅱ)—S和Fe3+(结合S的结合能信号,其对应 Fe2(SO4)3)中 Fe2p3/2电子的结合能信号[5,22-23],脱硫后,脱硫剂表面除了存在生成的铁的硫化物外,而且还残留有未参与反应的Fe2O3。
图6为脱硫后m(Fe)/m(C)=0.10耦合脱硫剂中S2p3/2电子的XPS谱,各信号峰分别对应S2-(161.0eV)[5,24-25]、 单 质 硫 (S8、S)(163.5eV、164.2eV)[23,26]及 S(168.8eV、169.5eV)[22-26]。综上所述,脱硫后耦合脱硫剂表面生成FeS、Fe2(SO4)3及单质硫。脱硫后m(Fe)/m(C)=0.10耦合脱硫剂表面Fe和S的存在形式及含量列于表2。由表2可见,脱硫后耦合脱硫剂表面3种硫化物中Fe2(SO4)3所占比例最大(85.8%),由此表明,耦合脱硫剂具有较强的氧化脱硫功能。由表2还可知,表面铁物种除了对应的硫化物外,还含有未参与反应的Fe2O3,以Fe2O3形式存在的Fe所占比例为41.1%。该数据说明,表面Fe2O3的减少是导致脱硫活性大幅度下降的主要原因。

图4 m(Fe)/m(C)=0.10的耦合脱硫剂脱硫前后的SEM和TEM照片Fig.4 SEM & TEM photos of coupled desulfurizer with m(Fe)/m(C)=0.10
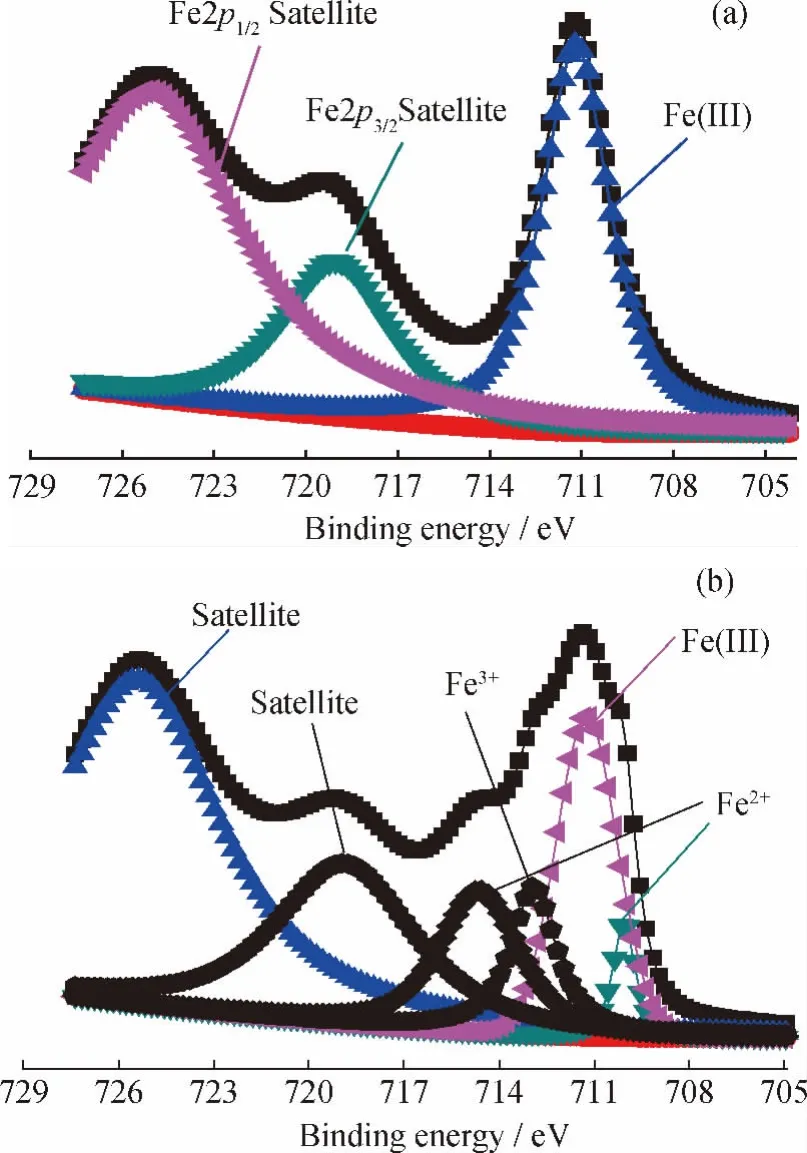
图5 脱硫前后m(Fe)/m(C)=0.10耦合脱硫剂中Fe2p电子的XPS谱Fig.5 XPS profiles of Fe2pin coupled desulfurizer with m(Fe)/m(C)=0.10before and after desulfurization

图6 脱硫后m(Fe)/m(C)=0.10耦合脱硫剂中S2p3/2电子的XPS谱Fig.6 XPS profiles of S2p3/2in coupled desulfurizer with m(Fe)/m(C)=0.10after desulfurization
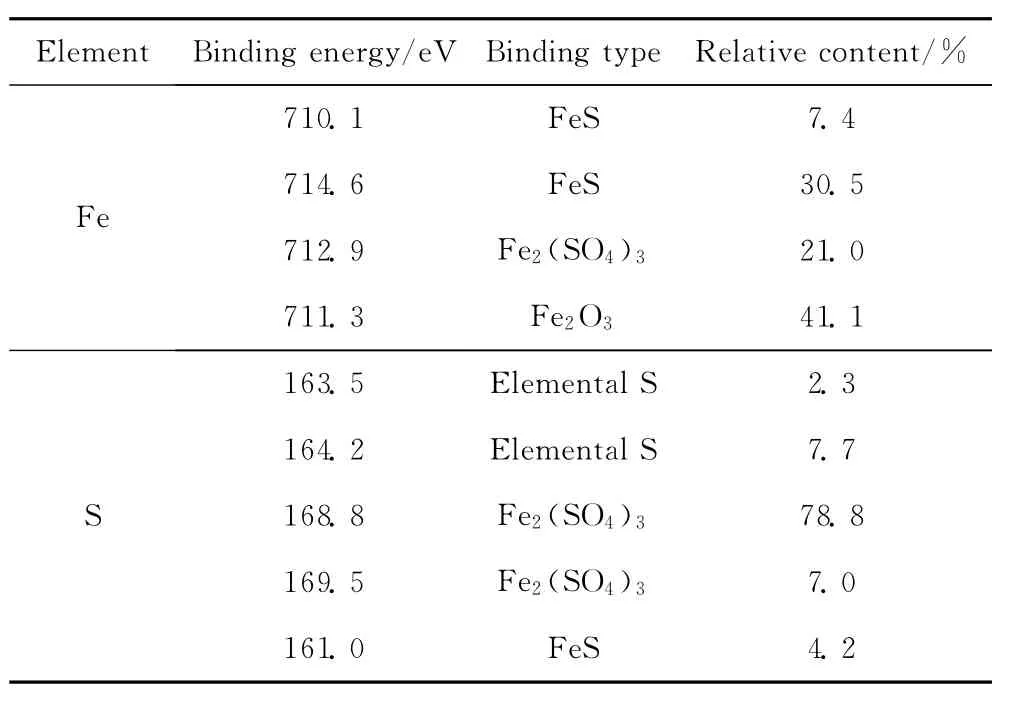
表2 脱硫后m(Fe)/m(C)=0.10耦合脱硫剂表面Fe和S的存在形式及含量Table 2 Type and content of Fe and S species on the used coupled desulfurizer with m(Fe)/m(C)=0.10
2.3 耦合脱硫剂对不同硫化物的脱除性能
本研究实验结果显示,m(Fe)/m(C)=0.10耦合脱硫剂对硫化氢、乙硫醇、二甲基二硫醚、噻吩的穿透硫容分别为24.3%、0.9%、6.0%、0.3%。硫化氢是一种结构简单且反应活性很高的无机硫化物,很容易被吸附并通过催化氧化作用脱除,实验结果表明,其一次穿透硫容最高。在脱硫过程中,二甲基二硫醚反应活性很低,但由于分子较小,且与载体活性炭极性相近,其易以分子的形式吸附在脱硫剂孔隙结构中[27-28]。同种条件下,尽管乙硫醇反应活性远低于硫化氢,但作为活性硫化物,前者在脱硫过程中可以生成二乙基二硫醚[28];该醚因具有较大的动力学半径,极易堵塞脱硫剂孔道,阻碍反应进一步发生,故导致脱硫剂对其一次穿透硫容较小,甚至低于化学活性更差的二甲基二硫醚。噻吩的化学活性最低,被吸附的噻吩分子可通过自身芳环与活性炭载体形成离域大π键,或通过给出S的孤对电子与脱硫剂表面上的Fe形成π键;π键的形成往往导致噻吩在孔道内发生垂直吸附,而脱硫剂孔道很容易因此而被堵塞,从而阻止噻吩分子进一步被吸附,致使耦合脱硫剂对其一次穿透硫容在所考察的硫化物中最低[29]。
2.4 耦合脱硫剂的再生性能
在脱除H2S的过程中,脱硫后在耦合脱硫剂表面沉积的硫化物主要有FeS、Fe2(SO4)3及单质硫等。其中,单质硫大量吸附储存于耦合脱硫剂孔道中,致使后者孔道堵塞,活性位被覆盖,玷污失活;而生成的FeS、Fe2(SO4)3造成脱硫剂中毒失活。因此,耦合脱硫剂的再生应包括覆盖活性位的单质硫的去除和Fe2O3活性位的恢复[17]。
表3列出了m(Fe)/m(C)=0.12耦合脱硫剂脱硫-再生循环使用效果。图7为该脱硫剂的脱硫-再生后的穿透曲线。由表3可知,一次再生后耦合脱硫剂硫容仍达新鲜脱硫剂的87.0%,三次循环后硫容为49.5%。耦合脱硫剂之所以能够实现再生是因为,一方面,高温(475℃)下沉积在脱硫剂孔道中的单质硫以蒸气的形式被N2夹带而出,实现了被单质硫覆盖的Fe2O3活性位及吸附氧活性位的再生;另一方面,纳米尺度的Fe2(SO4)3能够发生部分分解而重新释放出Fe2O[30]3。对于H2S的脱除,脱硫剂表面的脱硫产物主要为Fe2(SO4)3(见表2),但总的来说,脱硫产物绝大多数为生成后迁移至脱硫剂微孔结构中的单质硫(见图3、图4),因此,脱硫剂在低于Fe2(SO4)3的分解温度(>480℃)下一次再生后,硫容依旧可以维持较高水平。但再生后脱硫剂的脱硫性能未能完全恢复,且随着再生次数的增加,硫容逐渐下降。这是由于N2气氛下不可再生的FeS的生成量不断增加,且多数Fe2(SO4)3在475℃不能发生分解,使得Fe2O3活性位的数目总体来看不断减少。此外,由图7可以看出,耦合脱硫剂脱硫-再生后的穿透曲线整体走势随再生次数的增加而逐渐变得陡峭。随着再生次数的增加,耦合脱硫剂表面活性位不断减少,进料气中硫化物的脱除速率也随之下降,使得尾气中硫化物浓度增加迅速,因此,穿透曲线走势变得陡峭。

表3 m(Fe)/m(C)=0.12耦合脱硫剂脱硫-再生循环使用效果Table 3 Results of desulfurization-regeneration recycle for coupled desulfurizer with m(Fe)/m(C)=0.12
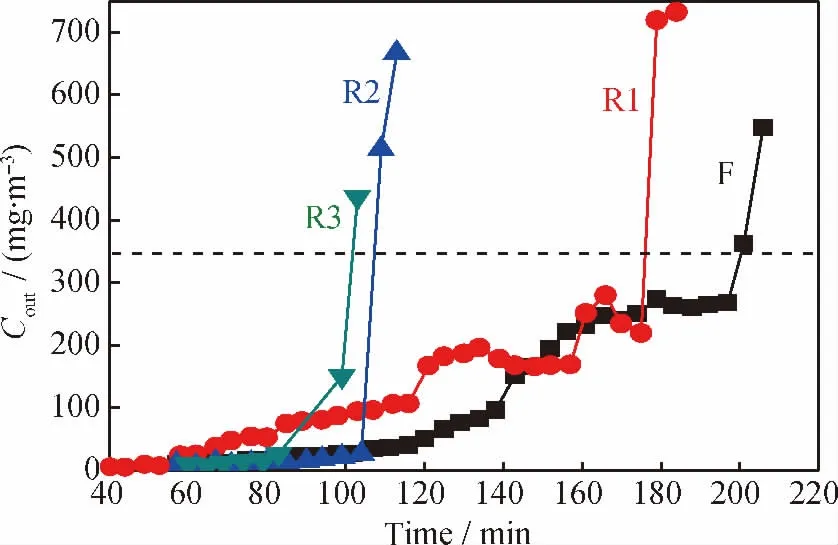
图7 m(Fe)/m(C)=0.12耦合脱硫剂脱硫-再生后的穿透曲线Fig.7 Breakthrough curves of the coupled desulfurizer with m(Fe)/m(C)=0.12after desulfurization-regeneration recycle
3 结 论
(1)以Fe2O3为脱硫活性相、活性炭为载体,采用二次浸渍法制备了高效吸附-催化氧化耦合脱硫剂,其脱硫性能优于单纯活性炭脱硫剂。
(2)在耦合脱硫剂脱除H2S过程中存在吸附氧化脱硫和催化氧化脱硫的协同作用,生成的硫化物主要有单质硫、FeS和Fe2(SO4)3;耦合脱硫剂对乙硫醇、二甲基二硫醚及噻吩均有一定的脱除效果,但脱除效率低于对H2S的脱除。
(3)耦合脱硫剂在脱除H2S过程中的失活包括玷污失活和中毒失活。失活的脱硫剂可在N2气氛下实现热再生,一次再生后的硫容可恢复至新鲜剂的87.0%。
[1]石亚华.石油加工过程中的脱硫[M].北京:中国石化出版社,2009:18-19.
[2]CUI H,TURN S Q,REESE M A.Removal of sulfurcompounds from utility pipelined synthetic natural gas using modified activated carbons[J].Catalysis Today,2009,139(4):274-279.
[3]段林海,孟秀红,施岩,等.不同硫化物在改性Y分子筛上的选择性吸附脱硫性能及机理[J].石油学报(石油加工),2009,25(增刊):70-76.(DUAN Linhai,MENG Xiuhong,SHI Yan,et al.Selective adsorption desulfurization performance and mechanism of sulfur compounds over modified Y zeolite[J].Acta Petrolei Sinica (Petroleum Processing Section),2009,25(Suppl):70-76.)
[4]朱永军,上官炬,梁丽彤,等.复合ZnO高温煤气脱硫剂的物相、还原及硫化行为[J].石油学报(石油加工 ),2009,25(1):108-113. (ZHU Yongjun,SHANGGUAN Ju,LIANG Litong,et al.The phase,reduction &sulfidation performance of the mixed ZnO hot coal desulfurization sorbents[J].Acta Petrolei Sinica(Petroleum Processing Section),2009,25(1):108-113.)
[5]王青宁,韩维亮,蒋金龙,等.脱除硫化氢的凹凸棒石基纳米氧化锌脱硫剂的实验研究[J].石油学报(石油加工),2012,28(5):757-763.(WANG Qingning,HAN Weiliang,JIANG Jinlong,et al.Experimental study on nano-zinc oxide desulfurizer with attapulgite as support for H2S removal[J].Acta Petrolei Sinica(Petroleum Processing Section),2012,28(5):757-763.)
[6]WANG Jiancheng,QIU Biao,HAN Lina,et al.Effect of precursor and preparation method on manganese based activated carbon sorbents for removing H2S from hot coal gas[J].Journal of Hazardous Materials,2012,213-214:184-192.
[7]BANDOSZ T J.Effect of pore structure and surface chemistry of virgin activated carbons on removal of hydrogen sulfide[J].Carbon,1999,37(3):483-491.
[8]BANDOSZ T J. On the adsorption/oxidation of hydrogen sulfide on activated carbons at ambient temperatures[J].Journal of Colloid and Interface Science,2002,246(1):1-20.
[9]ELSAYED Y, SEREDYCH M, DALLAS A.Desulfurization of air at high and low H2S concentrations[J].Chemical Engineering Journal,2009,155(3):594-602.
[10]KANTE K,DELGADO C N,MENDEZ R R,et al.Spent coffee-based activated carbon:Specific surface features and their importance for H2S separation process[J].Journal of Hazardous Materials,2012,201-202:141-147.
[11]XIAO Yonghou,WANG Shudong,WU Diyong,et al.Catalytic oxidation of hydrogen sulfide over unmodified and impregnated activated carbon[J].Separation and Purification Technology,2008,59(3):326-332.
[12]肖永厚,王树东,吴迪镛,等.浸渍活性炭脱除低质量浓度H2S性能的研究[J].燃料化学学报,2007,35(1):61-65.(XIAO Yonghou,WANG Shudong,WU Diyong,et al.Investigation of removal of low concentration hydrogen sulfide on impregnated activated carbon[J].Journal of Fuel Chemistry and Technology,2007,35(1):61-65.)
[13]谭小耀,吴迪镛,袁权.浸渍活性炭脱除H2S固定床反应器模型(Ⅰ)数值分析[J].化工学报,1996,47(5):531-538.(TAN Xiaoyao,WU Diyong,YUAN Quan.A model of fixed bed reactor for removing H2S by impregnated activated carbon(Ⅰ)Numerical analysis[J].Journal of Chemical Industry and Engineering(China),1996,47(5):531-538.
[14]谭小耀,吴迪镛,袁权.浸渍活性炭脱除H2S固定床反应器模型(Ⅱ)实验研究.化工学报,1996,47(5):539-545.(TAN Xiaoyao,WU Diyong,YUAN Quan.A model of fixed bed reactor for removing H2S by impregnated activated carbon(Ⅱ)Experimental study[J].Journal of Chemical Industry and Engineering(China),1996,47(5):539-545.)
[15]FANG Huibin,ZHAO Jiantao,FANG Yitian,et al.Selective oxidation of hydrogen sulfide to sulfur over activated carbon-supported metal oxides[J].Fuel,2013,108:143-148.
[16]郝海刚,王胜,方惠斌,等.Fe/AC催化脱硫剂再生性能的研究[J].煤炭转化,2011,34(4):66-71.(HAO Haigang,WANG Sheng,FANG Huibin,et al.Study on regeneration property of Fe/AC catalytic desulfurizer[J].Coal Conversion,2011,34(4):66-71.)
[17]方惠斌,赵建涛,黄戒介,等.活性炭担载金属氧化物用于热煤气脱硫[J].化学工程,2010,38(10):56-59.(FANG Huibin,ZHAO Jiantao,HUANG Jiejie,et al.Activated carbon-supported metal oxides for hot gas desulfurization[J].Chemical Engineering(China),2010,38(10):56-59.)
[18]孟欣.吸附催化氧化脱硫剂的制备及脱硫性能研究[D].青岛:中国石油大学(华东),2012.
[19]张翠清.常温铁系煤气脱硫剂的研究[D].北京:煤炭科学研究总院,2004.
[20]KLEIN J,HENNING K D.Catalytic oxidation of hydrogen sulphide on activated carbons[J].Fuel,1984,63(8):1064-1067.
[21]KO T H,CHU H.Spectroscopic study on sorption of hydrogen sulfide by means of red soil [J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2005,61(9):2253-2259.
[22]KNIPE S W,MYCROFT J R,PRATT A R,et al.X-ray photoelectron spectroscopic study of water adsorption on iron sulphide minerals[J].Geochimicaet Cosmochimica Acta,1995,59(6):1079-1090.
[23]REN Xiurong,CHANG Liping,LI Fang,et al.Study of intrinsic sulfidation behavior of Fe2O3for high temperature H2S removal[J].Fuel,2010,89(4):883-887.
[24]KO T H,CHU H.Characterization of southern Taiwan red soils as a regenerable sorbent for sorption of hydrogen sulfide from coal gas with spectroscopic techniques[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2005,62(1-3):407-414.
[25]ESNEYDER P P,BRITO J L.Effect of the type of precursor and the synthesis method on thiophene hydrodesulfurization activity of activated carbon supported Fe-Mo,Co-Mo and Ni-Mo carbides[J].Journal of Molecular Catalysis A:Chemical,2008,281(1-2):85-92.
[26]LAAJALEHTO K,KARTIO I,SUONINEN E.XPS and SR-XPS techniques applied to sulphide mineral surfaces [J]. International Journal of Mineral Processing,1997,51(1-4):163-170.
[27]LEE S W, WMAW D,LEE M G. Adsorption characteristics of methyl mercaptan,dimethyl disulfide,and trimethylamine on coconut-based activated carbons modified with acid and base[J].Journal of Industrial and Engineering Chemistry,2010,16(6):973-977.
[28]BASHKOVA S,BAGREEV A,BANDOSZ T J.Catalytic properties of activated carbon surface in the process of adsorption/oxidation of methyl mercaptan[J].Catalysis Today,2005,99(3-4):323-328.
[29]SEREDYCH M,BANDOSZ T J.Template-derived mesoporous carbons with highly dispersed transition metals as media for the reactive adsorption of dibenzothiophene [J]. Langmuir,2007,23(11):6033-6041.
[30]ARCIBAR-OROZCOA J A,RANGEL-MENDEZA J R,BANDOSZ T J.Reactive adsorption of SO2on activated carbons with deposited iron nanoparticles[J].Journal of Hazardous Materials,2013,246-247:300-309.
