盐酸三乙胺-氯化铁离子液体吸收H2S的研究
2020-06-15关健
关 健
(河钢集团唐山分公司能源环保部,河北唐山,063016)
前言
目前,在工业上得到普遍应用的脱除H2S 技术主要包括湿法脱硫和干法脱硫[1,2]。干法脱除H2S技术由于吸收硫容有限,只适用于H2S 浓度较低的气体。湿法脱除H2S 技术普遍存在吸收剂成本较高、工艺流程复杂、能耗较高、脱硫效率较低、脱硫废液易引起二次污染以及吸收剂长期与管道接触后导致设备腐蚀等问题[1-4]。
离子液体[5]是一种完全由离子组成的液体,在低温(<100 ℃)下呈液态的盐,也称为低温熔融盐。离子液体具有不易挥发、性质可以设计、低毒或者无毒、可在常温下吸收等优点[5],开始应用到诸如脱除H2S这样的气体处理领域[6-8]。其中,盐酸三乙胺-氯化铁离子液体吸收H2S 的工艺,既可以避免一般液相脱硫剂易挥发和损失的缺点,又可以回收硫单质、脱硫效率较高、工艺绿色化。此外,盐酸三乙胺-氯化铁离子液体还具有原料易于合成、价格便宜、来源广等优势[9,10],因此研究此脱硫工艺具有应用前景和研究意义。本文讨论了温度、时间、除硫次数和ZnCl2(二次脱硫剂)添加量对吸收硫容的影响,为此法的工程应用提供数据支持和理论依据。
1 实验部分
1.1 实验试剂与仪器(试剂见表1)
表1 实验试剂
实验仪器见表2。
表2 实验仪器
2.2 Et3NHCl-FeCl3离子液体的制备
当Et3NHCl与FeCl3·6H2O 的摩尔比值x低于1.4或高于1.8 时,在室温下的混合物中会存在未反应的固体。因此x 取1.4、1.5、1.6、1.7、1.8。将称好的盐酸三乙胺和六水合氯化铁置于圆底烧瓶中,将圆底烧瓶放在恒温磁力搅拌器中,两种固体在80℃的水浴条件下均匀混合并反应[11],直到得到一种澄清的棕色液体形成--Et3NHCl-FeCl3离子液体[10]。将离子液体置于真空干燥器内保存。
2.3 Et3NHCl-FeCl3离子液体吸收H2S
如图1 所示,储气钢瓶中为纯的H2S 气体,以鼓泡形式进入装有离子液体的吸收管,尾气用NaOH水溶液吸收净化。吸收管部分浸在集热式恒温加热磁力搅拌器中,以保证吸收液的温度恒定和可控。图2为Et3NHCl-FeCl3离子液体与H2S气体发生反应的过程。

图1 实验流程图
用电子天平(精度0.0001 g)分别称量0.14 mol、0.15 mol、0.16 mol、0.17 mol、0.18 mol的盐酸三乙胺,0.1 mol 的六水合氯化铁以及装有已知质量离子液体的吸收管总质量。吸收过程中密切观察实验现象,每隔5 min 称量一次吸收管总质量,当连续两次称量的总质量几乎不变化时,即可认为吸收过程已达平衡。由于Et3NHCl-FeCl3离子液体在实验温度范围内几乎不挥发,因此吸收前后吸收管的质量增量可认为是吸收H2S 的质量。由此计算出H2S 在该离子液体中的硫容C,其计算公式如下:

式中:m1-吸收的H2S的质量;
m2-离子液体的质量。
将吸收后的离子液体溶于丙酮,把混合液进行抽滤,将固体过滤掉后的液体倒入圆底烧瓶中进行旋转蒸发,水浴温度为60 ℃,旋转蒸发的时间为45 min,转速为90 r/min。将旋转蒸发后的离子液体再次用于吸收H2S。

图2 Et3NHCl-FeCl3离子液体与H2S气体发生反应
2.4 溶有ZnCl2 的Et3NHCl-FeCl3 离子液体吸收H2S
分别将0.01 mol、0.05 mol、0.1 mol 的ZnCl2加入到1 mol 的Et3NHCl-FeCl3离子液体中。在恒温80 ℃水浴条件下搅拌使其溶解。将混合液静置冷却8 h 以上,并将其保存于真空干燥器内在吸收H2S时使用。
3 数据分析与讨论
3.1 温度和摩尔比对硫容的影响

图3 20 ℃下硫容随时间的变化

图4 35℃下硫容随时间的变化
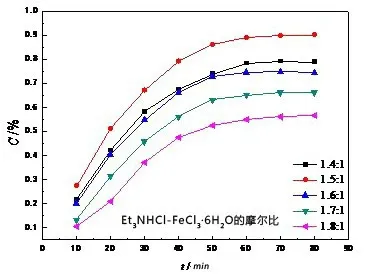
图5 45℃下硫容随时间的变化
从图3-5 可知,随着时间的延长,硫容先增大,然后趋于饱和。在20 ℃和45 ℃时,离子液体的硫容在60 min 时达到饱和;在35 ℃时,离子液体的硫容在50 min 时达到饱和。35 ℃时离子液体的硫容要明显高于20 ℃和45 ℃时的硫容。随着温度的升高,离子液体的粘度逐渐降低[12],扩散速率逐渐增大,越容易吸收。然而,温度越高,H2S 在离子液体中的溶解度越小[13]。温度较低时,高粘度限制了H2S在离子液体中的传质;温度较高时,溶解度降低制约了H2S 的吸收。因此,离子液体在308.15 K 时硫容较高,达到饱和的时间也较短。
在同一温度下,离子液体的硫容按不同的摩尔比例排序依次为:1.5:1>1.4:1>1.6:1>1.7:1>1.8:1。一方面,随着摩尔比的增大,离子液体中的有效的提取组分FeCl4-随之降低;另一方面,随着摩尔比的降低,离子液体的粘度逐渐增加[10]。较高的粘度限制了1.4:1 的离子液体对H2S 的吸收。综合两方面因素考虑,1.5:1 的离子液体吸收H2S 的效果最好。
3.2 除硫次数对硫容的影响
离子液体在旋蒸后进行了五次除硫,从图6 中可以得出,随除硫次数的增加硫容逐渐降低,未经除硫的离子液体的吸收硫容为1.183%,第五次除硫后吸收硫容为0.755%。随着反应的进行,不断有硫单质生成,这使得反应向正向进行的越来越缓慢。因此为了保证吸收效率,有必要进行定期的除硫。随着除硫次数的增多,离子液体中的有效成分逐渐降低,导致吸收硫容的降低。离子液体在进行前三次除硫时,吸收硫容都在1%以上,其中第三次的吸收硫容仍可达到1.022%。
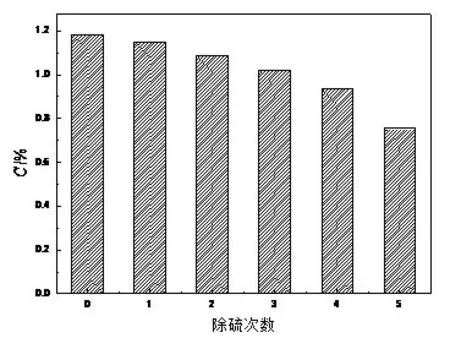
图6 除硫次数对硫容的影响
3.3 ZnCl2对硫容的影响
加入ZnCl2后的反应式为:
沉淀反应

氧化反应
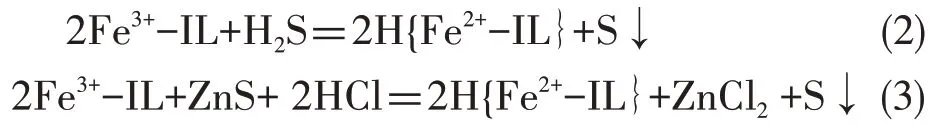
一方面,进入Et3NHCl-FeCl3离子液体的H2S 或者通过沉淀反应(1)生成硫化锌,或者通过氧化反应(2)生成硫磺,硫化锌和硫磺的不断生成保证了反应能够达到比较完全的程度,确保H2S 能够被高效吸收,因此反应(1)和(2)是取得高脱硫效率的关键。另一方面,三价铁基离子液体是一种高效氧化剂,在一定条件下可将硫化物氧化为硫磺。该离子液体与中间产物硫化锌的反应如(3)所示。
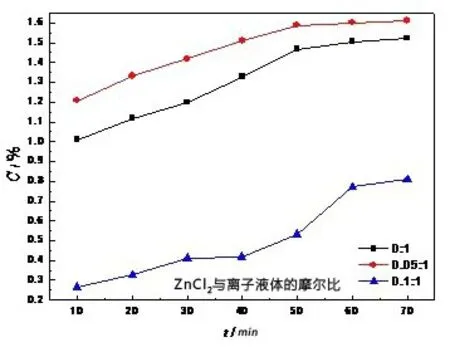
图7 添加ZnCl2对硫容的影响
由图7可知,随着时间的延长,三种离子液体的硫容不断的增大。当ZnCl2与离子液体的摩尔比为0.05:1时,离子液体的硫容最高。当ZnCl2与离子液体的摩尔比为0.1:1 时,离子液体的硫容最低。此时离子液体的粘度成为影响硫容的主要因素。由于添加ZnCl2的比例过高,使离子液体的粘度较大,高粘度限制了H2S 在离子液体中的传质,进而影响了硫容。
4 结论
(1)温度较低时,高粘度限制了H2S在离子液体中的传质;温度较高时,溶解度的降低制约了H2S的吸收。温度过高和过低均不利于硫容的升高。
(2)摩尔比较低时,较高的粘度限制了离子液体对H2S的吸收;摩尔比较高时,离子液体中的有效提取组分FeCl4-较低。摩尔比过高和过低均不利于硫容的升高。
(3)通过除硫,离子液体可以多次使用。离子液体在进行前三次除硫时,硫容都在1%以上,其中第三次的硫容仍可达到1.022%。
(4)离子液体在添加ZnCl2,ZnCl2与离子液体的摩尔数比例为0.05:1 时的硫容高于不添加ZnCl2时的硫容;离子液体不添加ZnCl2时的硫容高于添加ZnCl2比例为0.1:1时的硫容。
